Метилирование - Methylation
В химических науках, метилирование обозначает добавление метильная группа на субстрат или замещение атома (или группы) метильной группой. Метилирование - это форма алкилирование, с метильной группой, заменяющей водород атом. Эти термины обычно используются в химия, биохимия, почвоведение, а Биологические науки.
В биологические системы, метилирование катализированный от ферменты; такое метилирование может участвовать в модификации тяжелые металлы, регулирование экспрессия гена, регулирование функция белка, и Обработка РНК. Метилирование образцов тканей in vitro также является одним из методов снижения некоторых артефакты гистологического окрашивания. Аналог метилирования называется деметилирование.
В биологии
В биологических системах метилирование осуществляется ферментами. Метилирование может изменять тяжелые металлы, регулировать экспрессию генов, процессинг РНК и функцию белков. Это было признано ключевым процессом, лежащим в основе эпигенетика. Цикл метилирования в медицине относится к метаболизму различных систем, включая ДНК и производство глутатиона. Неправильный цикл метилирования был связан с различными аномальными состояниями, включая миалгический энцефаломиелит (ME CFS). [1]
Метаногенез
Метаногенез, процесс, который генерирует метан из CO2, включает серию реакций метилирования. Эти реакции осуществляются набором ферментов, содержащихся в семействе анаэробных микробов.[2]

В обратном метаногенезе метан служит агентом метилирования.[нужна цитата ]
О-метилтрансферазы
Большое разнообразие фенолы подвергаются O-метилированию, чтобы дать анизол производные. Этот процесс, катализируемый такими ферментами, как кофеил-КоА O-метилтрансфераза, является ключевой реакцией в биосинтезе лигнолы, перкурсоры к лигнин, важнейший структурный компонент растений.
Растения продуцируют флавоноиды и изофлавоны с метилированием по гидроксильным группам, т.е. метоксильные связи. Это 5-O-метилирование влияет на растворимость флавоноидов в воде. Примеры 5-O-метилгенистеин, 5-O-метилмирицетин или 5-O-метилкверцетин, также известный как азалеатин.
Белки
Вместе с убиквитином и фосфорилированием метилирование является основным биохимическим процессом изменения функции белка. Наиболее распространенные метилированные белки производят определенные гистоны из аргинина и лизина. В противном случае гистидин, глутамат, аспарагин, цистеин подвержены метилированию. Некоторые из этих продуктов включают S-метилцистеин, два изомера N-метилгистидин и два изомера N-метиларгинин.[3]
Метионинсинтаза

Метионинсинтаза регенерирует метионин (Встретил) из гомоцистеин (Hcy). Общая реакция трансформируется 5-метилтетрагидрофолат (N5-MeTHF) в тетрагидрофолат (THF) при переносе метильной группы в Hcy с образованием Met. Метионинсинтазы могут быть кобаламин-зависимыми и кобаламиннезависимыми: растения имеют и то и другое, животные зависят от метилкобаламин-зависимой формы.
В метилкобаламин-зависимых формах фермента реакция протекает в два этапа в реакции пинг-понга. Фермент изначально переходит в реактивное состояние за счет передачи метильной группы от N5-MeTHF в Co (I) в связанном с ферментом кобаламин (Cob), образуя метилкобаламин (Me-Cob), который теперь содержит Me-Co (III), и активируя фермент. Затем Hcy, который координировался с ферментом, связанным цинк с образованием реактивного тиолата вступает в реакцию с Me-Cob. Активированная метильная группа переносится от Me-Cob к тиолату Hcy, который регенерирует Co (I) в Cob, и Met высвобождается из фермента.[4]
Тяжелые металлы: мышьяк, ртуть, кадмий
Биометилирование - это путь превращения некоторых тяжелых элементов в более мобильные или более летальные производные, которые могут попасть в организм человека. пищевая цепочка. В биометилирование из мышьяк соединения начинается с образования метанарсонаты. Таким образом, трехвалентные неорганические соединения мышьяка метилируются с образованием метанарсоната. S-аденозилметионин является донором метила. Метанарсонаты являются предшественниками диметиларсонатов, опять же по циклу сокращение (до метиларсоновой кислоты) с последующим вторым метилированием.[5] Связанные пути применяются к биосинтез из метилртуть.
Эпигенетическое метилирование
Метилирование ДНК / РНК
Метилирование ДНК у позвоночных обычно встречается в CpG сайты (сайты цитозин-фосфат-гуанин - то есть, где цитозин сразу следует гуанин в последовательности ДНК). Это метилирование приводит к превращению цитозина в 5-метилцитозин. Образование Me-CpG происходит катализированный ферментом ДНК-метилтрансфераза. У млекопитающих метилирование ДНК часто встречается в клетках организма,[6] и метилирование сайтов CpG, по-видимому, происходит по умолчанию.[7][8] ДНК человека имеет около 80–90% метилированных сайтов CpG, но есть определенные области, известные как Острова CpG, которые богаты CG (высокое содержание цитозина и гуанина, около 65% CG остатки ), где не метилирован. Они связаны с промоутеры 56% генов млекопитающих, включая все повсеместно экспрессируемые гены. От одного до двух процентов генома человека составляют кластеры CpG, и существует обратная зависимость между метилированием CpG и транскрипционной активностью. Метилирование, способствующее эпигенетическому наследованию, может происходить либо путем метилирования ДНК, либо путем метилирования белка. Неправильное метилирование генов человека может привести к развитию болезней,[9][10] включая рак.[11][12] Точно так же метилирование РНК происходит у разных видов РНК, а именно. тРНК, рРНК, мРНК, тмРНК, мяРНК, snoRNA, miRNA, и вирусная РНК. Различные каталитические стратегии используются для метилирования РНК различными РНК-метилтрансферазами. Считается, что метилирование РНК существовало до метилирования ДНК в ранних формах жизни, развивающейся на Земле.[13]
N6-метиладенозин (m6A) является наиболее распространенной и распространенной модификацией метилирования в молекулах РНК (мРНК), присутствующей у эукариот. 5-метилцитозин (5-mC) также часто встречается в различных молекулах РНК. Последние данные убедительно свидетельствуют о том, что метилирование m6A и 5-mC РНК влияет на регуляцию различных биологических процессов, таких как стабильность РНК и трансляция мРНК,[14] и что аномальное метилирование РНК вносит вклад в этиологию заболеваний человека.[15]
Метилирование белков
Метилирование белков обычно происходит на аргинин или лизин аминокислота остатки в белковой последовательности.[16] Аргинин может быть метилирован один раз (монометилированный аргинин) или дважды, причем обе метильные группы находятся на одном концевом азоте (асимметричный диметиларгинин ) или один на обоих атомах азота (симметричный диметиларгинин), протеин-аргинин-метилтрансферазы (ПРМЦ). Лизин можно метилировать один, два или три раза лизинметилтрансферазы. Метилирование белков наиболее изучено в гистоны. Передача метил группы из S-аденозил метионин в гистоны катализируется ферментами, известными как гистоновые метилтрансферазы. Гистоны, метилированные по определенным остаткам, могут действовать эпигенетически подавить или активировать экспрессию генов.[17][18] Метилирование белков - это один из видов посттрансляционная модификация.
Эволюция
Метаболизм очень древний и может быть обнаружен у всех организмов на Земле, от бактерий до людей, что указывает на важность метаболизма метила для физиологии.[19] Действительно, фармакологическое подавление глобального метилирования у различных видов, от человека, мышей, рыб, мух, круглых червей, растений, водорослей и цианобактерий, вызывает такие же эффекты на их биологические ритмы, демонстрируя сохраняющуюся физиологическую роль метилирования в процессе эволюции.[20]
В химии
Термин метилирование в органическая химия относится к алкилирование процесс, используемый для описания доставки CH3 группа.[21]
Электрофильное метилирование
Метилирование обычно проводят с использованием электрофильный источники метила, такие как йодметан,[22] диметилсульфат,[23][24] диметилкарбонат,[25] или тетраметиламмоний хлорид.[26] Менее распространенные, но более мощные (и более опасные) метилирующие реагенты включают: метилтрифлат,[27] диазометан,[28] и метилфторсульфонат (магический метил ). Все эти реагенты реагируют через SN2 нуклеофильные замены. Например, карбоксилат может быть метилирован по кислороду с образованием метилового сложный эфир; ан алкоксид соль RO− может быть также метилирован, чтобы дать эфир, РОЧ3; или кетон энолировать может быть метилирован на углероде для получения нового кетон.
В Метилирование Пурди является специфическим для метилирования по кислороду углеводы с помощью йодметан и оксид серебра.[29]
Метилирование Эшвайлера-Кларка
В Реакция Эшвейлера – Кларка это метод метилирования амины.[30] Этот метод позволяет избежать риска кватернизация, которое происходит при метилировании аминов метилгалогенидами.

Диазометан и триметилсилилдиазометан
Диазометан и более безопасный аналог триметилсилилдиазометан метилат карбоновых кислот, фенолов и даже спиртов:
- RCO2H + tmsCHN2 + CH3OH → RCO2CH3 + CH3ОТМС + Н2
Преимущество метода заключается в том, что побочные продукты легко удаляются из смеси продуктов.[31]
Нуклеофильное метилирование
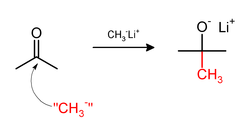
Метилирование иногда связано с использованием нуклеофильный метиловые реагенты. Сильно нуклеофильные метилирующие агенты включают: метиллитий (CH3Ли)[32] или Реактивы Гриньяра такие как метилмагний бромид (CH3MgX).[33] Например, CH3Li добавит метильные группы к карбонил (C = O ) кетонов и альдегидов:
К более мягким метилирующим агентам относятся: тетраметилолово, диметилцинк, и триметилалюминий.[34]
Смотрите также
Темы биологии
- Бисульфитное секвенирование - биохимический метод, используемый для определения наличия или отсутствия метильных групп в последовательности ДНК
- MethDB База данных метилирования ДНК
- Микромасштабный термофорез - биофизический метод определения степени метилизации ДНК[35]
Темы органической химии
- Алкилирование
- Метокси
- Метиленирование титана и цинка
- Реагент Петазис
- Реагент найстеда
- Реакция Виттига
- Реактив Теббе
использованная литература
- ^ Ван Конинберг Р. Возрождение Феникса, 2014
- ^ Тауер, Р. К., «Биохимия метаногенеза: дань уважения Марджори Стивенсон», Microbiology, 1998, том 144, страницы 2377-2406.
- ^ Кларк, Стивен Г. (2018). «Рибосома: горячая точка для идентификации новых типов белковых метилтрансфераз». Журнал биологической химии. 293 (27): 10438–10446. Дои:10.1074 / jbc.AW118.003235. ЧВК 6036201. PMID 29743234.
- ^ Matthews, R.G .; Smith, A.E .; Zhou, Z. S .; Taurog, R.E .; Bandarian, V .; Evans, J.C .; Людвиг, М. (2003). «Кобаламин-зависимые и кобаламин-независимые метиониновые синтазы: есть ли два решения одной и той же химической проблемы?». Helvetica Chimica Acta. 86 (12): 3939–3954. Дои:10.1002 / hlca.200390329.
- ^ Стибло, М .; Del Razo, L.M .; Vega, L .; Germolec, D. R .; LeCluyse, E.L .; Гамильтон, Г. А .; Рид, В .; Wang, C .; Cullen, W. R .; Томас, Д. Дж. (2000). «Сравнительная токсичность трехвалентных и пятивалентных неорганических и метилированных мышьяков в клетках крысы и человека». Архив токсикологии. 74 (6): 289–299. Дои:10.1007 / s002040000134. PMID 11005674. S2CID 1025140.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Тост Дж (2010). «Метилирование ДНК: введение в биологию и связанные с заболеванием изменения многообещающего биомаркера». Мол Биотехнол. 44 (1): 71–81. Дои:10.1007 / s12033-009-9216-2. PMID 19842073. S2CID 20307488.
- ^ Lister R, Pelizzola M, Dowen RH, Hawkins RD, Hon G, Tonti-Filippini J, Nery JR, Lee L, Ye Z, Ngo QM, Edsall L, Antosiewicz-Bourget J, Stewart R, Ruotti V, Millar AH, Thomson JA, Ren B, Ecker JR (ноябрь 2009 г.). «Метиломы ДНК человека при базовом разрешении демонстрируют широко распространенные эпигеномные различия». Природа. 462 (7271): 315–22. Bibcode:2009Натура 462..315л. Дои:10.1038 / природа08514. ЧВК 2857523. PMID 19829295.
- ^ Штадлер М.Б., Мурр Р., Бургер Л., Иванек Р., Линерт Ф., Шелер А., ван Нимвеген Е., Вирбелауэр С., Окли Э. Дж., Гайдацис Д., Тивари В. К., Шюбелер Д. (декабрь 2011 г.). «ДНК-связывающие факторы формируют метилом мыши в дистальных регуляторных областях». Природа. 480 (7378): 490–5. Дои:10.1038 / природа11086. PMID 22170606.
- ^ Rotondo JC, Selvatici R, Di Domenico M, Marci R, Vesce F, Tognon M, Martini F (сентябрь 2013 г.). «Потеря метилирования в импринтированном гене H19 коррелирует с гиперметилированием промотора гена метилентетрагидрофолатредуктазы в образцах спермы от бесплодных мужчин». Эпигенетика. 8 (9): 990–7. Дои:10.4161 / epi.25798. ЧВК 3883776. PMID 23975186.
- ^ Rotondo JC, Bosi S, Bazzan E, Di Domenico M, De Mattei M, Selvatici R, Patella A, Marci R, Tognon M, Martini F (декабрь 2012 г.). «Гиперметилирование промотора гена метилентетрагидрофолатредуктазы в образцах спермы бесплодных пар коррелирует с повторным самопроизвольным абортом». Репродукция человека. 27 (12): 3632–8. Дои:10.1093 / humrep / des319. PMID 23010533.
- ^ Rotondo JC, Borghi A, Selvatici R, Magri E, Bianchini E, Montinari E, Corazza M, Virgili A, Tognon M, Martini F (2016). «Инактивация гена IRF6, индуцированная гиперметилированием, как возможное раннее событие в прогрессировании плоскоклеточного рака вульвы, связанного со склеротическим лишаем». JAMA Дерматология. 152 (8): 928–33. Дои:10.1001 / jamadermatol.2016.1336. PMID 27223861.
- ^ Rotondo JC, Borghi A, Selvatici R, Mazzoni E, Bononi I, Corazza M, Kussini J, Montinari E, Gafà R, Tognon M, Martini F (2018). «Ассоциация гена рецептора ретиноевой кислоты β с началом и прогрессированием плоскоклеточной карциномы вульвы, связанной со склеротическим лишаем». JAMA Дерматология. 154 (7): 819–823. Дои:10.1001 / jamadermatol.2018.1373. ЧВК 6128494. PMID 29898214.
- ^ Рана, Аджай К .; Анкри, Серж (1 января 2016 г.). «Возрождение мира РНК: взгляд на появление метилтрансфераз РНК». Фронт Жене. 7: 99. Дои:10.3389 / fgene.2016.00099. ЧВК 4893491. PMID 27375676.
- ^ Чой, Джунхонг; Йонг, Ка-Вен; Демирчи, Хасан; Чен, Джин; Петров Алексей; Прабхакар, Арджун; О'Лири, Шон Э .; Dominissini, Dan; Рехави, Гидеон (февраль 2016 г.). «N6-метиладенозин в мРНК нарушает отбор тРНК и динамику удлинения трансляции». Структурная и молекулярная биология природы. 23 (2): 110–115. Дои:10.1038 / nsmb.3148. ISSN 1545-9993. ЧВК 4826618. PMID 26751643.
- ^ Стюарт, Кендал (15 сентября 2017 г.). «Тестирование на метилирование (MTHFR) и дефицит фолиевой кислоты». Архивировано из оригинал 12 октября 2017 г.. Получено 11 октября 2017.
- ^ Уолш, Кристофер (2006). «Глава 5 - Метилирование белков» (PDF). Посттрансляционная модификация белков: расширение запасов природы. Робертс и Ко. Издатели. ISBN 978-0-9747077-3-0.[постоянная мертвая ссылка ]
- ^ Grewal, S. I .; Райс, Дж. К. (2004). «Регулирование гетерохроматина с помощью метилирования гистонов и малых РНК». Текущее мнение в области клеточной биологии. 16 (3): 230–238. Дои:10.1016 / j.ceb.2004.04.002. PMID 15145346.
- ^ Nakayama, J. -I .; Rice, J.C .; Strahl, B.D .; Allis, C.D .; Grewal, S. I. (2001). «Роль метилирования гистона H3 лизина 9 в эпигенетическом контроле сборки гетерохроматина». Наука. 292 (5514): 110–113. Bibcode:2001Научный ... 292..110N. Дои:10.1126 / science.1060118. PMID 11283354. S2CID 16975534.
- ^ Kozbial, P.Z .; Мушегян, А. (2005). «Естественная история S-аденозилметионин-связывающих белков». BMC Struct Biol. 5 (19): 19. Дои:10.1186/1472-6807-5-19. ЧВК 1282579. PMID 16225687.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Fustin, J.M .; Ye, S., Rakers, C .; Канеко, К .; Фукумото, К .; Yamano, M .; Versteven, M .; Grünewald, E .; Cargill, S.J .; Tamai, T.K .; Xu, Y .; Jabbur, M.L .; Kojima, R .; Lamberti, M.L .; Йошиока-Кобаяси, К .; Whitmore, D .; Tammam, S .; Howell, P.L .; Kageyama, R .; Matsuo, T .; Станевский, Р .; Голомбек, Д.А.; Johnson, C.H .; Kakeya, H .; van Ooijen, G .; Окамура, Х. (2020). «Дефицит метилирования нарушает биологические ритмы от бактерий к человеку». Биология коммуникации. 3 (211). Дои:10.1038 / с42003-020-0942-0. PMID 32376902.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Марш, Джерри; Смит, Майкл В. (2001). Продвинутая органическая химия марта: реакции, механизмы и структура. Нью-Йорк: Вили. ISBN 978-0-471-58589-3.
- ^ Вяс, Г. Н .; Шах, Н. М. (1951). «Монометиловый эфир кунинацетофенона». Органический синтез. 31: 90. Дои:10.15227 / orgsyn.031.0090.
- ^ Хирс, Г. С. (1929). «Анизол». Органический синтез. 9: 12. Дои:10.15227 / orgsyn.009.0012.
- ^ Icke, Roland N .; Редеманн, Эрнст; Wisegarver, Burnett B .; Аллес, Гордон А. (1949). «м-Метоксибензальдегид». Органический синтез. 29: 63. Дои:10.15227 / orgsyn.029.0063.
- ^ Тундо, Пьетро; Сельва, Маурицио; Бомбен, Андреа (1999). «Моно-C-метилатион арилацетонитрилов и метиларилацетатов с помощью диметилкарбоната: общий метод синтеза чистых 2-арилпропионовых кислот. 2-Фенилпропионовая кислота». Органический синтез. 76: 169. Дои:10.15227 / orgsyn.076.0169.
- ^ Ненад, Мараш; Поланц, Словенко; Кочевар, Мариян (2008). "Микроволновое метилирование фенолов хлоридом тетраметиламмония в присутствии K2CO3 или Cs2CO3". Тетраэдр. 64 (51): 11618–11624. Дои:10.1016 / j.tet.2008.10.024.
- ^ Пун, Кевин В. С.; Альбиниак, Филип А .; Дадли, Грегори Б. (2007). «Защита спиртов с помощью трифторметансульфаноната 2-бензилокси-1-метилпиридиния: метил (R) - (-) - 3-бензилокси-2-метилпропаноат». Органический синтез. 84: 295. Дои:10.15227 / orgsyn.084.0295.
- ^ Neeman, M .; Джонсон, Уильям С. (1961). «Холестанилметиловый эфир». Органический синтез. 41: 9. Дои:10.15227 / orgsyn.041.0009.
- ^ Purdie, T .; Ирвин, Дж. К. (1903). «С.? Алкилирование сахаров». Журнал химического общества, Сделки. 83: 1021–1037. Дои:10.1039 / CT9038301021.
- ^ Icke, Roland N .; Wisegarver, Burnett B .; Аллес, Гордон А. (1945). «β-Фенилэтилдиметиламин». Органический синтез. 25: 89. Дои:10.15227 / orgsyn.025.0089.
- ^ Шиоири, Такаюки; Аояма, Тоёхико; Сноуден, Тимоти (2001). «Триметилсилилдиазометан». Энциклопедия реагентов для органического синтеза. Энциклопедия реагентов для органического синтеза e-EROS. Дои:10.1002 / 047084289X.rt298.pub2. ISBN 978-0471936237.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Lipsky, Sharon D .; Холл, Стэн С. (1976). «Ароматические углеводороды из ароматических кетонов и альдегидов: 1,1-дифенилэтан». Органический синтез. 55: 7. Дои:10.15227 / orgsyn.055.0007.
- ^ Груммитт, Оливер; Беккер, Эрнест I. (1950). «транс-1-фенил-1,3-бутадиен». Органический синтез. 30: 75. Дои:10.15227 / orgsyn.030.0075.
- ^ Негиси, Эй-ичи; Мацусита, Хадзиме (1984). «Катализируемый палладием синтез 1,4-диенов аллилированием алкениалана: α-Фарнезен». Органический синтез. 62: 31. Дои:10.15227 / orgsyn.062.0031.
- ^ Винкен CJ, Baaske P, Duhr S, Braun D (2011). «Кривые термофоретического плавления позволяют количественно оценить конформацию и стабильность РНК и ДНК». Исследования нуклеиновых кислот. 39 (8): e52. Дои:10.1093 / nar / gkr035. ЧВК 3082908. PMID 21297115.
внешние ссылки
- deltaMasses Обнаружение метилирования после масс-спектрометрии