Реактив Теббес - Tebbes reagent
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК μ-Хлор [ди (циклопента-2,4-диен-1-ил)] диметил (μ-метилен) титаналюминий | |
| Другие имена Реагент Теббе | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.157.162 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C13ЧАС18AlClTi | |
| Молярная масса | 284,60 г / моль |
| Растворимость в других растворителях | толуол, бензол, дихлорметан, THF (только низкие температуры) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
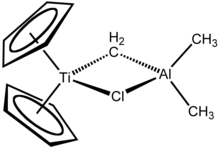
Реактив Теббе это металлоорганическое соединение с формулой (C5ЧАС5)2TiCH2ClAl (CH3)2. Он используется при метиленировании карбонил соединений, то есть он превращает органические соединения, содержащие R2C = O группу в связанную R2C = CH2 производная.[1] Это красное твердое вещество, которое пирофорный в воздухе, и поэтому обычно обрабатывается безвоздушные методы. Первоначально он был синтезирован Фред Теббе в DuPont Central Research.
Реагент Теббе содержит два четырехгранный металлические центры, соединенные парой мостиковые лиганды. У титана два циклопентадиенил ([C
5ЧАС
5]−
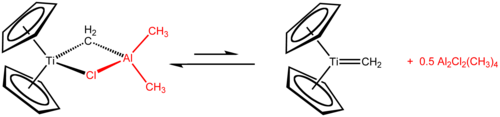
, или Cp) кольца, а алюминий имеет две метильные группы. Атомы титана и алюминия связаны друг с другом метиленовый мостик (-CH2-) и атом хлорида в почти квадратно-плоский (Ti – CH2–Al – Cl) геометрия.[2] Реагент Теббе был первым описанным соединением, в котором метиленовый мостик соединяет переходный металл (Ti) и металл основной группы (Al).[3]
Подготовка
Реагент Теббе синтезируется из дихлорид титаноцена и триметилалюминий в толуол решение.[3][4]
- Cp2TiCl2 + 2 Al (CH3)3 → CH4 + Cp2TiCH2AlCl (CH3)2 + Al (CH3)2Cl
Примерно через 3 дня продукт получается после перекристаллизации для удаления Al (CH3)2Cl.[3] Хотя синтезы с использованием выделенного реагента Теббе дают более чистый продукт, сообщалось об успешных процедурах с использованием реагента «на месте».[5][6] Вместо выделения реагента Теббе раствор просто охлаждают на ледяной бане или бане с сухим льдом перед добавлением исходного материала.
Альтернативный, но менее удобный синтез предполагает использование диметилтитаноцен (Реагент Петазис):[7]
- Cp2Ti (CH3)2 + Al (CH3)2Cl → Cp2TiCH2AlCl (CH3)2 + CH4
Один недостаток этого метода, помимо требования Cp2Ti (CH3)2, - сложность отделения продукта от непрореагировавшего исходного реагента.
Механизм реакции
Сам по себе реагент Теббе не вступает в реакцию с карбонильными соединениями, поэтому его необходимо предварительно обработать мягким База Льюиса, Такие как пиридин, генерирующий активный Шрок карбен.
Также аналогично реактиву Виттига, реакционная способность, по-видимому, обусловлена высоким оксофильность Ti (IV). Карбен Шрока (1) реагирует с карбонильными соединениями (2) с получением постулируемого промежуточного соединения оксатитанациклобутана (3). Этот циклический интермедиат никогда не выделялся напрямую, по-видимому, потому, что он немедленно распадается с получением желаемого продукта. алкен (5).
Объем
Реагент Теббе применяется в органический синтез для карбонильного метиленирования.[8][9][10] Это преобразование также может быть выполнено с помощью Реакция Виттига, хотя реагент Теббе более эффективен, особенно для стерически ограниченных карбонилов. Кроме того, реагент Теббе менее щелочной, чем реагент Виттига, и не дает продуктов β-отщепления.
Реакции метилирования также происходят для альдегиды а также сложные эфиры, лактоны и амиды. Реагент Теббе превращает сложные эфиры и лактоны в простые эфиры енола, а амиды - в енамины. В соединениях, содержащих как кетоновые, так и сложноэфирные группы, кетон селективно реагирует в присутствии одного эквивалента реагента Теббе.
Реагент Теббе метиленат карбонилов без рацемизации хиральный α углерод. По этой причине реагент Теббе нашел применение в реакциях сахаров, где поддержание стереохимия может быть критичным.[11]
Реагент Теббе реагирует с хлорангидриды с образованием енолятов титана путем замены Cl−.
Модификации
Реагент Теббе можно модифицировать, используя различные лиганды. Это может изменить реакционную способность комплекса, что позволяет проводить более широкий спектр реакций. Например, циклопропанирование можно добиться с помощью хлорированного аналога.[12]
Смотрите также
Родственные титаноорганические реагенты и реакции
- Кулинковича реакция
- Реагент Петазис
- Реагент Ломбардо[13]
- Реакция Макмерри
Связанные реакции метиленирования
Рекомендации
- ^ Ф. Н. Теббе, Г. В. Паршалл и Дж. С. Редди (1978). «Омологация олефинов с соединениями метилена титана». Варенье. Chem. Soc. 100 (11): 3611–3613. Дои:10.1021 / ja00479a061.
- ^ Томпсон, Рик; Накамару-Огисо, Эйко; Чен, Чун-Син; Пинк, Марен; Миндиола, Дэниел Дж. (2014). «Структурное выяснение выдающегося реагента Теббе». Металлоорганические соединения. 33 (1): 429–432. Дои:10.1021 / om401108b.
- ^ а б c Херрманн, В.А., "Метиленовый мост" Успехи металлоорганической химии 1982, 20, 195–197.
- ^ Страус, Д. А., «μ-Хлорбис (циклопентадиенил) (диметилалюминий) -μ-метилентитан»: Энциклопедия реагентов для органического синтеза. Джон Вили, Лондон, 2000 г.
- ^ Pine, S. H .; Kim, V .; Ли, В. (1990). «Эфиры енола путем метиленирования сложных эфиров: 1-фенокси-1-фенилэтен и 3,4-дигидро-2-метилен-2.ЧАС-1-бензопиран ». Орг. Синтезатор. 69: 72. Дои:10.15227 / orgsyn.069.0072.
- ^ Л. Ф. Канниццо и Р. Х. Граббс (1985). «Получение in situ (μ-хлор) (μ-метилен) бис (циклопентадиенил) (диметилалюминий) титана (реагент Теббе)». J. Org. Chem. 50 (13): 2386–2387. Дои:10.1021 / jo00213a040.
- ^ Payack, J. F .; Hughes, D. L .; Cai, D .; Cottrell, I.F .; Верховен, Т. Р. (2004). «Диметилтитаноцен». Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 10, п. 355
- ^ Хартли, Ричард С .; Ли, Цзяньфэн; Main, Calver A .; Маккирнан, Гордон Дж. (2007). «Реагенты карбеноидов титана для превращения карбонильных групп в алкены». Тетраэдр. 63 (23): 4825–4864. Дои:10.1016 / j.tet.2007.03.015.
- ^ Пайн, С. Орг. Реагировать. 1993, 43, 1. (Обзор)
- ^ Beadham, I .; Миклфилд, Дж. Curr. Орг. Synth. 2005, 2, 231–250. (Рассмотрение)
- ^ А. Марра, Ж. Эсно, А. Вейриерес и П. Синай (1992). «Изопропенилгликозиды и родственные им соединения как новые классы гликозильных доноров: тема и варианты». Варенье. Chem. Soc. 114 (16): 6354–6360. Дои:10.1021 / ja00042a010.CS1 maint: несколько имен: список авторов (связь)
- ^ Необычный эквивалент амбифильного карбеноида при амидном циклопропанировании Куо-Вэй Линь, Шиуань Янь, И-Линь Се и Ту-Синь Ян Орг. Lett.; 2006; 8 (11), стр. 2265–2267; Абстрактный
- ^ Лучано Ломбардо (1987). «Метилирование карбонильных соединений: (+) - 3-метилен-цис-п-метан ». Органический синтез. 65: 81. Дои:10.15227 / orgsyn.065.0081..