Биосинтез кобаламина - Cobalamin biosynthesis
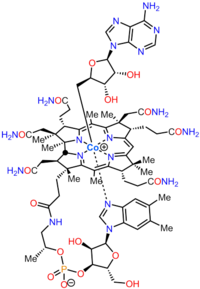

Биосинтез кобаламина это процесс, посредством которого бактерии и архея делать кобаламин, витамин B12. Много этапов преобразования аминолевулиновая кислота через уропорфириноген III и аденозилкобирная кислота до конечных форм, в которых она используется ферменты как у продуцирующих организмов, так и у других видов, включая людей, которые получают его через свой рацион.
Кобаламин
Кобаламин (витамин B12) - самый крупный и структурно сложный витамин. Он состоит из модифицированного тетрапиррол, а Коррин, с центральным хелатный кобальт и обычно содержится в одной из двух биологически активных форм: метилкобаламин и аденозилкобаламин. Наиболее прокариоты, а также у животных есть кобаламин-зависимые ферменты, которые используют его в качестве кофактор, в то время как растения и грибы не используйте это. В бактерии и археи эти ферменты включают метионинсинтаза, рибонуклеотидредуктаза, глутамат и метилмалонил-КоА мутазы, этаноламин аммиак-лиаза, и диол дегидратаза.[1] У некоторых млекопитающих кобаламин получается с пищей и необходим для метионинсинтазы и метилмалонил-КоА мутаза.[2] У людей он играет важную роль в фолиевая кислота метаболизм и синтез цикл лимонной кислоты средний, сукцинил-КоА.[3]
Обзор биосинтеза кобаламина
Существует как минимум два различных пути биосинтеза кобаламина в бактерии:[4]
 Пути биосинтеза витамина B12 из аминолевулиновой кислоты (АЛК) в бактериях и архее | 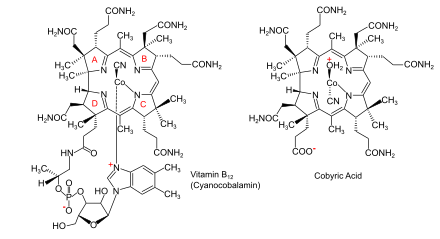 Витамин B12 (как цианокобаламин) и его исходная кобирная кислота |
- Аэробика путь, который требует кислород и в котором кобальт вводится в конце пути;[5][6] нашел в Pseudomonas denitrificans и Rhodobacter capsulatus.
- Анаэробный путь, по которому внедрение кобальта является первым обязательным шагом на пути к синтезу кобаламина;[7][8][9] нашел в Сальмонелла тифимуриум, Bacillus megaterium, и Propionibacterium freudenreichii subsp. Шермании.
Любой путь можно разделить на две части:
- Коррин кольцевой синтез, приводящий к кобириновой кислоте, с семью карбоксилат группы. В анаэробном пути он уже содержит кобальт, но в аэробном пути материал, образующийся на этой стадии, представляет собой гидрогенобириновую кислоту без связанного кобальта.[10][11][12]
- Вставка кобальта там, где его еще нет; формирование амиды на всех карбоксилатных группах, кроме одной, с получением кобировой кислоты; прикрепление аденозил группа как лиганд к кобальту; присоединение боковой цепи аминопропанола к одной свободной карбоксильной группе и сборка нуклеотид петля, которая обеспечит второй лиганд для кобальта.[12][13]
Следующий тип синтеза происходит через путь спасения, где снаружи корриноиды поглощаются, чтобы сделать B12.[12]Виды из следующих роды и следующие отдельные виды, как известно, синтезируют кобаламин: Пропионибактерии шермании, Псевдомонады денитрификаторы, Streptomyces гризей, Ацетобактерии, Аэробактер, Агробактерии, Алкалигены, Азотобактер, Бациллы, Clostridium, Коринебактерии, Флавобактерии, Лактобациллы, Микромоноспора, Микобактерии, Нокардия, Протей,Ризобий, Сальмонелла, Серратия, Стрептококк и Ксантомонады.[14][15]
Детализация шагов до образования уропорфириногена III
На ранних этапах биосинтеза тетрапирролический структурный каркас создается ферментами дезаминаза и косинтетаза которые преобразуют аминолевулиновая кислота через порфобилиноген и гидроксиметилбилан к уропорфириноген III. Последний является первым макроциклический промежуточный общий для гем, хлорофилл, сирохем и сам кобаламин.[6][16][17]
Подробная информация о стадиях от уропорфириногена III до а, с-диамида ириновой кислоты cob (II) в аэробных организмах
Биосинтез кобаламина отличается от биосинтеза гема и хлорофилла при уропорфриногене III: его трансформация включает последовательное добавление метила (CH3) группы для получения промежуточных продуктов, которые были даны банальные имена согласно количеству этих групп, которые были включены. Следовательно, первое промежуточное соединение - прекоррин-1, следующее - прекоррин-2 и так далее. Включение всех восьми дополнительных метильных групп, которые встречаются в кобировой кислоте, было исследовано с использованием 13C меченный метилом S-аденозил метионин. Так было до тех пор, пока ученые Рона-Пуленк Рорер использовал генно-инженерный напряжение Pseudomonas denitrificans, в котором восемь из початок гены, участвующие в биосинтезе витамина, были чрезмерно выраженный, что полная последовательность метилирования и других стадий может быть определена, таким образом полностью устанавливая все промежуточные соединения в пути.[18][19]
От уропорфириногена III до прекоррина-2
Фермент CobA катализирует два химические реакции EC 2.1.1.107[20]

- (1а) уропорфириноген III + S-аденозил метионин прекоррин-1 + S-аденозил-L-гомоцистеин
- (1b) прекоррин-1 + S-аденозилметионин прекоррин-2 + S-аденозил-L-гомоцистеин
От прекоррина-2 до прекоррина-3А
Фермент CobI катализирует реакцию EC 2.1.1.130[18]
- прекоррин-2 + S-аденозилметионин прекоррин-3A + S-аденозил-L-гомоцистеин
От прекоррина-3A до прекоррина-3B
Фермент CobG катализирует реакцию EC 1.14.13.83[18]
- прекоррин-3A + НАДН + H+ + O2 прекоррин-3B + НАД+ + H2О
Этот фермент является оксидоредуктаза для этого требуется кислород, и, следовательно, реакция может протекать только в аэробных условиях. Обозначение этих прекорринов как 3A и 3B отражает тот факт, что каждая из них содержит на три метильных группы больше, чем уропорфириноген III, но с другой структурой: в частности, прекоррин-3B имеет внутреннюю гамма-лактон кольцо, образованное из кольца Боковая цепь уксусной кислоты, замыкающаяся обратно на макроцикл.
От прекоррина-3B до прекоррина-4
Фермент CobJ продолжает тему внедрения метильной группы, катализируя реакцию EC 2.1.1.131[18]
- прекоррин-3B + S-аденозилметионин прекоррин-4 + S-аденозил-L-гомоцистеин

Важно отметить, что на этом этапе макроцикл кольцевые контракты так что продукт впервые содержит Коррин ядро, которое характеризует кобаламин.
От прекоррина-4 до прекоррина-5
Вставки метильных групп продолжаются, когда фермент CobM катализирует реакцию EC 2.1.1.133[21]
- прекоррин-4 + S-аденозилметионин прекоррин-5 + S-аденозил-L-гомоцистеин
Вновь вставленная метильная группа добавляется к кольцу C у углерода, присоединенного к метилену (CH2) мостик к кольцу B. Это не его окончательное расположение на кобаламине, поскольку на более поздней стадии происходит его перегруппировка в соседний углерод кольца.
От прекоррина-5 до прекоррина-6А
Фермент CobF катализирует реакцию EC 2.1.1.152[21]
- прекоррин-5 + S-аденозилметионин + H2О прекоррин-6A + S-аденозил-L-гомоцистеин + ацетат

Это преобразование удаляет ацетильную группу, расположенную в положении 1 кольцевой системы в прекоррине-4, и заменяет ее вновь введенной метильной группой. Название продукта, прекоррин-6A, отражает тот факт, что к этому моменту к уропорфириногену III было добавлено всего шесть метильных групп. Однако, поскольку один из них был экструдирован с ацетатной группой, структура прекоррина-6A содержит только оставшиеся пять.
От прекоррина-6А до прекоррина-6В
Фермент CobK теперь восстанавливает двойную связь в кольце D, катализируя реакцию EC 1.3.1.54[21]
- прекоррин-6A + НАДФН + H+ прекоррин-6B + НАДФ+
Таким образом, прекоррин-6B отличается по структуре от прекоррина-6A только наличием дополнительных двух атомов водорода.
От прекоррина-6B до прекоррина-8
Фермент CobL имеет два активных центра, один катализирует присоединение двух метильных групп, а другой - декарбоксилирование CH2Группа COOH на кольце D, так что этот заместитель становится простой метильной группой EC 2.1.1.132[21]
- прекоррин-6B + 2 S-аденозилметионин прекоррин-8X + 2 S-аденозил-L-гомоцистеин + CO2

От прекоррина-8 до гидрогенобириновой кислоты
Фермент CobH катализирует реакцию перегруппировки EC 5.4.99.61[22]
- прекоррин-8X гидрогенобиринат
В результате метильная группа, которая была добавлена к кольцу C, изомеризуется в свое окончательное положение, пример внутримолекулярный перенос.
От гидробириновой кислоты до a, c-диамида гидробириновой кислоты
Следующий фермент в пути, CobB, превращает две из восьми групп карбоновых кислот в их первичные амиды в реакции EC 6.3.5.9[23]
- гидрогенобириновая кислота + 2 АТФ + 2 глутамин + 2 часа2О гидробириновая кислота a, c-диамид + 2 ADP + 2 фосфата + 2 глютаминовая кислота
От a, c-диамида гидробириновой кислоты до a, c-диамида ириновой кислоты cob (II)
Кобальт (II) вставка в макроцикл катализируется ферментом Кобальтовая хелатаза (CobNST) в реакции EC 6.6.1.2[24]
- гидробириновая кислота a, c-диамид + Co2+ + АТФ + H2О cob (II) ириновая кислота a, c-диамид + АДФ + фосфат + H+
Именно на этом этапе аэробный путь и анаэробный путь сливаются, а более поздние этапы химически идентичны.
Подробная информация о стадиях от уропорфириногена III до а, с-диамида ириновой кислоты cob (II) в анаэробных организмах
Многие шаги, выходящие за рамки уропорфириногена III у анаэробных организмов, таких как Bacillus megaterium включают химически сходные, но генетически отличные от трансформаций аэробного пути.[9][25]
От прекоррина-2 до кобальт-сирогидрохлорина
Ключевое различие в этих путях состоит в том, что кобальт на ранней стадии внедряется в анаэробные организмы, сначала окисляя прекоррин-2 до его полного ароматизированная форма сирогидрохлорин а затем к этому соединению комплекс кобальта (II).[26] Реакции катализируются CysG EC 1.3.1.76 и Сирогидрохлорин кобальтохелатаза EC 4.99.1.3.[27]
От кобальт-сирогидрохлорина до кобальта-фактора III
Как и в аэробном пути, третья метильная группа вводится ферментом метилтрансферазой, CbiL в реакции EC 2.1.1.151[26]
- кобальт-сирогидрохлорин + S-аденозилметионин кобальт-фактор III + S-аденозил-L-гомоцистеин
От кобальт-фактора III до кобальт-прекоррина-4
Затем происходит метилирование и сжатие кольца с образованием макроцикла коррина. EC 2.1.1.272, катализируемая ферментом метилтрансферазой фактора кобальта III (CbiH)[28]
- кобальт-фактор III + S-аденозилметионин кобальт-прекоррин-4 + S-аденозил-L-гомоцистеин

На этом пути полученный материал содержит δ-лактон, шестичленное кольцо, а не γ-лактон (пятичленное кольцо) прекоррина-3B.
От кобальт-прекоррина-4 до кобальт-прекоррина-5А
Введение метильной группы в C-11 на следующей стадии катализируется кобальт-прекоррин-4-метилтрансферазой (CbiF) в реакции EC 2.1.1.271[29]
- кобальт-прекоррин-4 + S-аденозилметионин кобальт-прекоррин-5 + S-аденозил-L-гомоцистеин
От кобальт-прекоррина-5A до кобальт-прекоррина-5B
Теперь все готово для экструзии двухуглеродного фрагмента, соответствующего ацетату, высвобождающемуся при образовании прекоррина-6А в аэробных путях. В этом случае освобожденный фрагмент ацетальдегид и это катализируется CbiG в реакции EC 3.7.1.12[29]
- кобальт-прекоррин-5A + H2О кобальт-прекоррин-5B + ацетальдегид + 2 H+
От кобальт-прекоррина-5B до a, c-диамида cob (II) ириновой кислоты
Стадии от кобальт-прекоррина-5B до a, c-диамида cob (II) ириновой кислоты в анаэробном пути по существу химически идентичны этапам в аэробной последовательности. Промежуточные продукты называются кобальт-прекоррин-6A, кобальт-прекоррин-6B, кобальт-прекоррин-8 и кобириновая кислота, а участвующие ферменты / реакции: Кобальт-прекоррин-5B (C1) -метилтрансфераза (CbiD / EC 2.1.1.195 );[30] Кобальт-прекоррин-6А редуктаза (CbiJ / EC 1.3.1.106 );[31] Кобальт-прекоррин-7 (C15) -метилтрансфераза (декарбоксилирование) (CbiET / EC 2.1.1.196 ), Кобальт-прекоррин-8-метилмутаза (CbiC / EC 5.4.99.60 ) и CbiA / EC 6.3.5.11. Конечный фермент образует a, c-диамид cob (II) ириновой кислоты, поскольку оба пути сходятся.[12]
Подробная информация о стадиях от a, c-диамида ириновой кислоты cob (II) до аденозилкобаламина
Аэробные и анаэробные организмы разделяют тот же химический путь, что и a, c-диамид cob (II) ириновой кислоты, и это показано на примере початок генные продукты.
От a, c-диамида ириновой кислоты cob (II) до аденозилкобировой кислоты
Кобальт (II) восстанавливается до кобальта (I) ферментом Cob (II) ириновая кислота a, c-диамидредуктаза (CobR, реакция EC 1.16.8.1 ), а затем фермент Cob (I) ириновая кислота a, c-диамид аденозилтрансфераза (CobO) присоединяет аденозильный лиганд к металлу в реакции EC 2.5.1.17. Далее фермент CobQ (реакция EC 6.3.5.10 ) превращает все карбоновые кислоты, кроме пропионовая кислота на кольце D к их первичным амидам.[6][21]
От аденозилкобирной кислоты до фосфата аденозилкобинамида
У аэробных организмов фермент CobCD (реакция EC 6.3.1.10 ) теперь прикрепляет (R) -1-амино-2-пропанол (происходит от треонин ) к пропионовой кислоте, образуя аденозилкобинамид и фермент CobU (реакция EC 2.7.1.156 ) фосфорилаты концевую гидроксигруппу с образованием аденозилкобинамидфосфата.[21] Тот же конечный продукт образуется в анаэробных организмах в результате прямой реакции аденозилкобировой кислоты с (R) -1-амино-2-пропанол-O-2-фосфатом (полученным из треонин-O-фосфата ферментом CobD в ответ EC 4.1.1.81 ) катализируется ферментом CbiB.[12]
От фосфата аденозилкобинамида до аденозилкобаламина
В отдельной ветке пути, 5,6-диметилбензимидазол биосинтезируется из флавинмононуклеотид ферментом 5,6-диметилбензимидазолсинтаза (реакция EC 1.13.11.79 ) и преобразован CobT в ответ EC 2.4.2.21 в альфа-рибазол 5 'фосфат. Тогда фермент CobU (реакция EC 2.7.7.62 ) активирует аденозилкобинамидфосфат за счет образования аденозилкобинамида-GDP и CobV (реакция EC 2.7.8.26 ) связывает два субстрата с образованием аденозилкобаламин-5'-фосфата. На последнем этапе образования кофермента CobC удаляет 5 'фосфатную группу в реакции EC 3.1.3.73[32][33]
- Аденозилкобаламин-5'-фосфат + H2О аденозилкобаламин + фосфат
Полный путь биосинтеза включает длинный линейный путь, который требует около 25 участвующих ферментов.
Другие пути метаболизма кобаламина
Пути спасения прокариот
Много прокариотические виды не может биосинтезировать аденозилкобаламин, но может производить его из кобаламина. Эти организмы способны транспортировать кобаламин в клетку и превращать его в необходимую форму кофермента.[34] Даже такие организмы, как Сальмонелла тифимуриум которые могут производить кобаламин, также усваивают его из внешних источников, если таковые имеются.[12][35][36][37] Поглощению в клетки способствует Автовозы ABC которые поглощают кобаламин через клеточную мембрану.[38]
Метаболизм кобаламина у человека
У людей пищевые источники кобаламина связываются после приема внутрь как транскобаламины.[39] Затем они превращаются в формы кофермента, в которых они используются. Метилмалоновая ацидурия и гомоцистинурия белка типа C это фермент, который катализирует децианация из цианокобаламин так же хорошо как деалкилирование алкилкобаламинов, включая метилкобаламин и аденозилкобаламин.[40][41][42]
Рекомендации
- ^ Родионов, Дмитрий А .; Витрещак, Алексей Г .; Миронов Андрей А .; Гельфанд, Михаил С. (2003). «Сравнительная геномика метаболизма и регуляции витамина B12 у прокариот». Журнал биологической химии. 278 (42): 41148–41159. Дои:10.1074 / jbc.M305837200. PMID 12869542.
- ^ Банерджи, Рума (2006). «Торговля B12 млекопитающими: случай для службы сопровождения коферментов». ACS Химическая биология. 1 (3): 149–159. Дои:10.1021 / cb6001174. PMID 17163662.
- ^ «Витамин В12». Информационный центр по микронутриентам, Институт Линуса Полинга, Университет штата Орегон, Корваллис, Орегон. 4 июня 2015 г.. Получено 20 апреля 2020.
- ^ Ресснер, Чарльз А .; Сантандер, Патрисио Дж .; Скотт, А. Ян (2001). «Множественные биосинтетические пути витамина B12: вариации на центральную тему». Кофактор биосинтеза. Витамины и гормоны. 61. С. 267–297. Дои:10.1016 / s0083-6729 (01) 61009-4. ISBN 9780127098616. PMID 11153269.
- ^ Heldt, D .; Лоуренс, AD; Lindenmeyer, M .; Deery, E .; Heathcote, P .; Rigby, S.E .; Уоррен, М.Дж. (2005). «Аэробный синтез витамина B12: сжатие кольца и хелатирование кобальта». Сделки Биохимического Общества. 33 (4): 815–819. Дои:10.1042 / BST0330815. PMID 16042605. S2CID 37362827.
- ^ а б c Р. Каспи (25 сентября 2013 г.). «Путь: биосинтез аденозилкобаламина II (аэробный)». База данных метаболических путей MetaCyc. Получено 2020-04-24.
- ^ Ресснер CA, Хуанг KX, Уоррен MJ, Raux E, Scott AI (июнь 2002 г.). «Выделение и характеристика 14 дополнительных генов, определяющих анаэробный биосинтез кобаламина (витамин B12) в Propionibacterium freudenreichii (P. shermanii)». Микробиология. 148 (Pt 6): 1845–53. Дои:10.1099/00221287-148-6-1845. PMID 12055304.
- ^ Франк, S .; Brindley, A.A .; Deery, E .; Heathcote, P .; Лоуренс, AD; Пиявка, H.K .; Pickersgill, R.W .; Уоррен, М.Дж. (2005). «Анаэробный синтез витамина B12: характеристика первых этапов пути». Сделки Биохимического Общества. 33 (4): 811–814. Дои:10.1042 / BST0330811. PMID 16042604.
- ^ а б Р. Каспи (25 сентября 2013 г.). «Путь: биосинтез аденозилкобаламина I (анаэробный)». База данных метаболических путей MetaCyc. Получено 2020-04-24.
- ^ Баттерсби, А. Р. (1993). «Как природа создает пигменты жизни» (PDF). Чистая и прикладная химия. 65 (6): 1113–1122. Дои:10.1351 / pac199365061113. S2CID 83942303.
- ^ Баттерсби, А. Р. (2000). «Тетрапирролы: пигменты жизни. Обзор тысячелетия». Nat. Prod. Представитель. 17 (6): 507–526. Дои:10.1039 / B002635M. PMID 11152419.
- ^ а б c d е ж Фанг, H; Канг, Дж; Чжан, Д. (30 января 2017 г.). «Микробное производство витамина B12: обзор и перспективы ». Фабрики микробных клеток. 16 (1): 15. Дои:10.1186 / s12934-017-0631-у. ЧВК 5282855. PMID 28137297.
- ^ Raux E, Schubert HL, Warren MJ (декабрь 2000 г.). «Биосинтез кобаламина (витамин B12): бактериальная головоломка». Клетка. Мол. Life Sci. 57 (13–14): 1880–93. Дои:10.1007 / PL00000670. PMID 11215515. S2CID 583311.
- ^ Перлман Д. (1959). «Микробный синтез кобамидов». Успехи прикладной микробиологии. 1: 87–122. Дои:10.1016 / S0065-2164 (08) 70476-3. ISBN 9780120026012. PMID 13854292.
- ^ Мартенс Дж. Х., Барг Х., Уоррен М. Дж., Ян Д. (март 2002 г.). «Микробное производство витамина B12». Прикладная микробиология и биотехнология. 58 (3): 275–85. Дои:10.1007 / s00253-001-0902-7. PMID 11935176. S2CID 22232461.
- ^ Баттерсби А.Р., Фукс С.Дж., Мэтчем Г.В., Макдональд Э. (май 1980). «Биосинтез пигментов жизни: формирование макроцикла». Природа. 285 (5759): 17–21. Bibcode:1980Натура 285 ... 17Б. Дои:10.1038 / 285017a0. PMID 6769048. S2CID 9070849.
- ^ Фрэнк С., Бриндли А.А., Дери Э., Хиткот П., Лоуренс А.Д., Пиявка Г.К. и др. (Август 2005 г.). «Анаэробный синтез витамина B12: характеристика ранних стадий пути». Сделки Биохимического Общества. 33 (Пт 4): 811–4. Дои:10.1042 / BST0330811. PMID 16042604.
- ^ а б c d Debussche, L .; Thibaut, D .; Cameron, B .; Crouzet, J .; Бланш, Ф. (1993). «Биосинтез макроцикла коррина кофермента B12 у Pseudomonas denitrificans». Журнал бактериологии. 175 (22): 7430–7440. Дои:10.1128 / jb.175.22.7430-7440.1993. ЧВК 206888. PMID 8226690.
- ^ Баттерсби А (2005). «Глава 11: Открытие чуда того, как Природа строит свои молекулы». В Archer MD, Haley CD (ред.). Кафедра химии в Кембридже 1702 года: трансформация и изменение. Издательство Кембриджского университета. С. xvi, 257–82. ISBN 0521828732.
- ^ Уоррен, М. Дж .; Roessner, C.A .; Сантандер, П. Дж .; Скотт, А. И. (1990). «Ген cysG Escherichia coli кодирует S-аденозилметионин-зависимую метилазу уропорфириноген III». Биохимический журнал. 265 (3): 725–729. Дои:10.1042 / bj2650725. ЧВК 1133693. PMID 2407234.
- ^ а б c d е ж Уоррен, Мартин Дж .; Раукс, Эвелин; Schubert, Heidi L .; Эскаланте-Семерена, Хорхе К. (2002). «Биосинтез аденозилкобаламина (витамина B12)». Отчеты о натуральных продуктах. 19 (4): 390–412. Дои:10.1039 / b108967f. PMID 12195810.
- ^ Thibaut, D .; Couder, M .; Famechon, A .; Debussche, L .; Cameron, B .; Crouzet, J .; Бланш, Ф. (1992). «Последняя стадия биосинтеза гидробириновой кислоты катализируется продуктом гена cobH с прекоррином-8x в качестве субстрата». Журнал бактериологии. 174 (3): 1043–1049. Дои:10.1128 / jb.174.3.1043-1049.1992. ЧВК 206186. PMID 1732194.
- ^ Debussche, L .; Thibaut, D .; Cameron, B .; Crouzet, J .; Бланш, Ф. (1990). «Очистка и характеристика a, c-диамидсинтазы кобириновой кислоты из Pseudomonas denitrificans». Журнал бактериологии. 172 (11): 6239–6244. Дои:10.1128 / jb.172.11.6239-6244.1990. ЧВК 526805. PMID 2172209.
- ^ Debussche, L .; Couder, M .; Thibaut, D .; Cameron, B .; Crouzet, J .; Бланш, Ф. (1992). «Анализ, очистка и характеристика кобальтохелатазы, уникального сложного фермента, катализирующего включение кобальта в a, c-диамид гидробириновой кислоты во время биосинтеза кофермента B12 у Pseudomonas denitrificans». Журнал бактериологии. 174 (22): 7445–7451. Дои:10.1128 / JB.174.22.7445-7451.1992. ЧВК 207441. PMID 1429466.
- ^ Ресснер, Чарльз А .; Скотт, А. Ян (2006). «Точная настройка наших знаний об анаэробном пути к кобаламину (витамину B12)». Журнал бактериологии. 188 (21): 7331–7334. Дои:10.1128 / JB.00918-06. ЧВК 1636268. PMID 16936030.
- ^ а б Мур, Саймон Дж .; Уоррен, Мартин Дж. (2012). «Анаэробный биосинтез витамина B12». Сделки Биохимического Общества. 40 (3): 581–586. Дои:10.1042 / BST20120066. PMID 22616870.
- ^ Инь, Цзян; Сюй, Линда Х .; Черный, Майя М .; Раук-Дири, Эвелин; Биндли, Аманда А .; Савченко, Алексей; Уокер, Джон Р .; Кафф, Марианна Э .; Уоррен, Мартин Дж .; Джеймс, Майкл Н. Г. (2006). "Кристаллическая структура витамина B12 биосинтетической кобальтохелатазы, CbiXS, из Archaeoglobus Fulgidus". Журнал структурной и функциональной геномики. 7 (1): 37–50. Дои:10.1007 / s10969-006-9008-x. PMID 16835730. S2CID 6613060.
- ^ Мур, Саймон Дж .; Бидендик, Ребекка; Лоуренс, Эндрю Д .; Дири, Эвелин; Ховард, Марк Дж .; Ригби, Стивен Э. Дж .; Уоррен, Мартин Дж. (2013). «Характеристика фермента CbiH60, участвующего в анаэробном сокращении кольца биосинтетического пути кобаламина (витамина B12)». Журнал биологической химии. 288 (1): 297–305. Дои:10.1074 / jbc.M112.422535. ЧВК 3537027. PMID 23155054.
- ^ а б Кадзивара, Ясухиро; Сантандер, Патрисио Дж .; Ресснер, Чарльз А .; Перес, Лиза М .; Скотт, А. Ян (2006). «Генетически модифицированный синтез и структурная характеристика кобальт-прекоррина 5A и -5B, двух новых промежуточных продуктов на анаэробном пути к витамину B12: определение роли ферментов CbiF и CbiG». Журнал Американского химического общества. 128 (30): 9971–9978. Дои:10.1021 / ja062940a. PMID 16866557.
- ^ Ресснер, Чарльз А .; Уильямс, Ховард Дж .; Скотт, А. Ян (2005). «Генно-инженерное производство 1-десметилкобириновой кислоты, 1-десметилкобириновой кислоты, ц-диамида и кобириновой кислоты, ц-диамида в Эшерихия кишечная палочка Подразумевает Роль CbiD в метилировании C-1 в анаэробном пути к кобаламину ». Журнал биологической химии. 280 (17): 16748–16753. Дои:10.1074 / jbc.M501805200. PMID 15741157.
- ^ Ким, Вондак; Майор, Тиффани А .; Уитмен, Уильям Б. (2005). «Роль гена прекоррин 6-Х редуктазы в биосинтезе кобамида в Метанококк Maripaludis ". Археи. 1 (6): 375–384. Дои:10.1155/2005/903614. ЧВК 2685584. PMID 16243778.
- ^ Р. Каспи (2007-04-23). «Путь: биосинтез аденозилкобаламина из аденозилкобинамида-GDP I». База данных метаболических путей MetaCyc. Получено 2020-04-24.
- ^ Zayas, Carmen L .; Эскаланте-Семерена, Хорхе К. (2007). «Переоценка поздних стадий синтеза коэнзима B12 у Salmonella enterica: доказательство того, что дефосфорилирование аденозилкобаламин-5'-фосфата CobC фосфатазой является последним шагом на этом пути». Журнал бактериологии. 189 (6): 2210–2218. Дои:10.1128 / jb.01665-06. ЧВК 1899380. PMID 17209023.
- ^ Р. Каспи (25 сентября 2013 г.). «Путь: выход аденозилкобаламина из кобаламина». База данных метаболических путей MetaCyc. Получено 2020-04-24.
- ^ Escalante-Semerena, J.C .; Suh, S.J .; Рот, Дж. Р. (1990). «Функция CobA необходима как для биосинтеза кобаламина de novo, так и для ассимиляции экзогенных корриноидов в Salmonella typhimurium». Журнал бактериологии. 172 (1): 273–280. Дои:10.1128 / jb.172.1.273-280.1990. ЧВК 208428. PMID 2403541.
- ^ Вудсон, Джесси Д .; Zayas, Carmen L .; Эскаланте-Семерена, Хорхе К. (2003). «Требуется новый путь спасения кобинамида-предшественника коэнзима B12 в архее» Кобинамид-Фосфат-синтаза (CbiB) фермент Мероприятия". Журнал бактериологии. 185 (24): 7193–7201. Дои:10.1128 / jb.185.24.7193-7201.2003. ЧВК 296239. PMID 14645280.
- ^ Woodson, J.D .; Эскаланте-Семерена, Дж. К. (2004). «CbiZ, фермент амидогидролаза, необходимый для спасения предшественника кофермента B12 кобинамида в архее». Труды Национальной академии наук. 101 (10): 3591–3596. Bibcode:2004PNAS..101.3591W. Дои:10.1073 / pnas.0305939101. ЧВК 373507. PMID 14990804.
- ^ Вудсон, Джесси Д .; Рейнольдс, Эйприл; Эскаланте-Семерена, Хорхе К. (2005). "ABC Transporter for Corrinoids in Halobacterium sp. Strain NRC-1". Журнал бактериологии. 187 (17): 5901–5909. Дои:10.1128 / JB.187.17.5901-5909.2005. ЧВК 1196138. PMID 16109931.
- ^ Р. Каспи (25 сентября 2013 г.). «Путь: спасение кобаламина (эукариотический)». База данных метаболических путей MetaCyc. Получено 2020-04-24.
- ^ Ганнибал, Люциана; Ким, Джихо; Brasch, Nicola E .; Ван, Сихэ; Розенблатт, Дэвид С .; Банерджи, Рума; Якобсен, Дональд В. (2009). «Обработка алкилкобаламинов в клетках млекопитающих: роль продукта гена MMACHC (CBLC)». Молекулярная генетика и метаболизм. 97 (4): 260–266. Дои:10.1016 / j.ymgme.2009.04.005. ЧВК 2709701. PMID 19447654.
- ^ Банерджи, Рума; Герасим, Кармен; Падовани, Доминик (2009). «Ремесленник, портной, солдат во внутриклеточной торговле B12». Современное мнение в области химической биологии. 13 (4): 484–491. Дои:10.1016 / j.cbpa.2009.07.007. ЧВК 5750051. PMID 19665918.
- ^ Квадрос, Эдвард В. (2010). «Достижения в понимании ассимиляции и метаболизма кобаламина». Британский журнал гематологии. 148 (2): 195–204. Дои:10.1111 / j.1365-2141.2009.07937.x. ЧВК 2809139. PMID 19832808.
дальнейшее чтение
- Layer, Gunhild; Ян, Дитер; Дири, Эвелин; Лоуренс, Эндрю Д .; Уоррен, Мартин Дж. (2010). «Биосинтез гема и витамина B12». Комплексные натуральные продукты II. С. 445–499. Дои:10.1016 / B978-008045382-8.00144-1. ISBN 9780080453828.
внешняя ссылка
- Профессор сэр Алан Баттерсби: биосинтез витамина B12 Колледж Святой Катарины, Кембридж, видео

