Натриевая вольфрамовая бронза - Sodium tungsten bronze

Натриевая вольфрамовая бронза это форма вставка с формулой NaИксWO3, куда Икс равно или меньше 1. Его электрические свойства, названные так из-за металлического блеска, варьируются от полупроводник до металлического в зависимости от концентрации присутствующих ионов натрия; он также может выставлять сверхпроводимость.
История
Подготовлен в 1823 г. химиком. Фридрих Вёлер натриевая вольфрамовая бронза была первой открытой бронзой из щелочных металлов.[1]Вольфрамовые бронзы обязаны некоторыми своими свойствами относительной стабильности вольфрам (V) катион, который образуется.[2] Подобное семейство молибденовые бронзы возможно, был открыт в 1885 году Альфред Ставенхаген и Э. Энгельс,[3] но они образуются в очень узком диапазоне температур, и о них не сообщалось до 1960-х годов.[4]
Характеристики
Натриевая вольфрамовая бронза, как и другие вольфрамовые бронзы, устойчива к химическим реакциям как в кислых, так и в основных условиях. Цвет зависит от доли натрия в соединении, от золотистого до Икс ≈ 0,9, через красный, оранжевый и темно-фиолетовый, до сине-черного, когда Икс ≈ 0.3.
Удельное электрическое сопротивление бронзы зависит от доли натрия в соединении, при этом для некоторых образцов измеряется удельное сопротивление 1,66 мОм.[5] Было высказано предположение, что электроны, высвобождаемые при ионизации атомов натрия, легко проходят через вольфрам.2 г и π-орбитали кислорода.[2] Это можно наблюдать в XPS[6] и UPS[7] спектры: пик, представляющий вольфрам 5d группа становится более интенсивным, поскольку Икс поднимается.
Для значений Икс ниже 0,3 бронза является полупроводниковой, а не металлической.[2] При достаточном охлаждении натриевая вольфрамовая бронза становится сверхпроводник, с критической температурой (Тc) для Na0.23WO3 примерно 2,2кельвин.[8] Первый рекорд сверхпроводимости в вольфрамовой бронзе был сделан в 1964 г. Тc 0,57 К.[9]
Структура
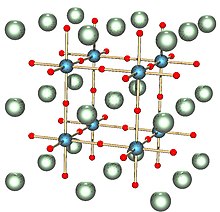
Когда Икс = 1, натриево-вольфрамовая бронза имеет кубическую фазу: перовскит Кристальная структура.[10] В таком виде конструкция состоит из разделительных углов WO6 октаэдры с ионами натрия в межузельных промежутках. За Икс При значениях между 0,9 и 0,3 структура остается аналогичной, но с возрастающим дефицитом ионов натрия и меньшим параметром решетки.[10]
Также можно использовать ряд других типов структур с различными электрическими свойствами: кубическая, тетрагональная I и гексагональная фазы являются металлическими, тогда как орторомбические и тетрагональные II структуры являются полупроводниковыми.[11]
Синтез
Синтез Велера 1823 г. включал уменьшение вольфрамат натрия и триоксид вольфрама с водородный газ при красном нагреве. Более современный подход снижает таять реагентов с электричеством, а не с водородом.[12] Возможен также микроволновый синтез,[13] с использованием вольфрамового порошка в качестве восстановителя. Также возможны гидротермальные (как периодические, так и поточные) синтезы.[14]
Родственные соединения
Натрий в этом соединении может быть заменен другим щелочных металлов для образования вольфрамовой бронзы и других металлов, таких как олово и свинец.[15] Молибденовые бронзы также существуют, но они менее стабильны, чем их вольфрамовые аналоги.[2]
Рекомендации
- ^ Хагенмюллер, П. (1973). «Группа 50: Вольфрамовая бронза, ванадиевая бронза и родственные соединения». Комплексная неорганическая химия. 4. Пергамон. стр.541–605. ISBN 978-0-08-016989-7.
- ^ а б c d Гринвуд, Н. и Эрншоу, А. (1993) [Перепечатка исправленной версии 1986 года, оригинальная версия напечатана в 1984 году]. Химия элементов (1-е изд.). Pergamon Press. С. 1185–6. ISBN 0-08-022057-6.
- ^ А. Ставенхаген, Э. Энгельс (1895) "Ueber Molybdänbronzen" Berichte der deutschen chemischen Gesellschaft, том 28, страницы 2280-2281. Дои:10.1002 / cber.189502802213
- ^ Wold, A .; Kunnmann, W .; Arnott, R.J .; Феррети, А. (1964). «Получение и свойства кристаллов натриевой и калиевой молибденовой бронзы». Неорганическая химия. 3 (4): 545–547. Дои:10.1021 / ic50014a022.
- ^ Straumanis, M.E .; Дравниекс, А. (1949). "Натриево-вольфрамовые бронзы. II. Электропроводность бронз". Журнал Американского химического общества. 71 (2): 683. Дои:10.1021 / ja01170a086.
- ^ Уэст, Энтони (1984). Химия твердого тела и ее приложения. Вайли. п. 96. ISBN 0-471-90874-6.
- ^ Cheetham, A K .; Дэй, П. (1987). Химия твердого тела: методики. Кларендон. п. 110. ISBN 0-19-855286-6.
- ^ Ostenson, J .; Shanks, H .; Финнемор, Д. (1978). «Сверхпроводимость в вольфрамовых бронзах». Журнал менее распространенных металлов. 62: 149. Дои:10.1016/0022-5088(78)90024-3.
- ^ Raub, C .; Sweedler, A .; Jensen, M .; Broadston, S .; Матиас, Б. (1964). «Сверхпроводимость натриево-вольфрамовых бронз». Письма с физическими проверками. 13 (25): 746. Bibcode:1964ПхРвЛ..13..746Р. Дои:10.1103 / PhysRevLett.13.746.
- ^ а б Хэгг, Г. (1935). «Шпинели и кубические натриево-вольфрамовые бронзы как новые примеры структур с пустыми точками решетки». Природа. 135 (3421): 874. Bibcode:1935Натура.135..874H. Дои:10.1038 / 135874b0.
- ^ Ngai, K. L .; Райнеке, Т. Л. (1978). «Структурные нестабильности и сверхпроводимость в щелочно-вольфрамовых бронзах». Журнал физики F: физика металлов. 8: 151. Bibcode:1978JPhF .... 8..151N. Дои:10.1088/0305-4608/8/1/018.
- ^ Конрой, Л. Э. (1977). «Приготовление и характеристика натриевой вольфрамовой бронзы. Неорганический эксперимент». Журнал химического образования. 54: 45. Bibcode:1977JChEd..54 ... 45C. Дои:10.1021 / ed054p45.
- ^ Guo, J .; Dong, C .; Ян, Л .; Фу, Г. (2005). «Зеленый путь микроволнового синтеза натриевых вольфрамовых бронз NaWO (0 << 1)». Журнал химии твердого тела. 178: 58. Bibcode:2005JSSCh.178 ... 58G. Дои:10.1016 / j.jssc.2004.10.017.
- ^ Ло, Цзя Ю; Лю, Цзин Сяо; Ши, Фэй; Сюй, Цян; Цзян, Ян Ян; Лю, Гуй Шань; Ху, Чжи Цян (июнь 2013 г.). «Синтез натриевой вольфрамовой бронзы гидротермальным методом с использованием лимонной кислоты». Расширенные исследования материалов. 712–715: 280–283. Дои:10.4028 / www.scientific.net / AMR.712-715.280.
- ^ Смарт, Лесли Э .; Мур, Элейн А. (2005). Химия твердого тела: введение (3-е изд.). CRC Press. п.227. ISBN 0-7487-7516-1.
