О-6-метилгуанин-ДНК-метилтрансфераза - O-6-methylguanine-DNA methyltransferase
О6-алкилгуанин-ДНК-алкилтрансфераза (также известный как AGT, MGMT или же АГАТ) это белок что у людей кодируется О6-метилгуанин-ДНК-метилтрансфераза (MGMT) ген.[5][6]О6-метилгуанин-ДНК-метилтрансфераза имеет решающее значение для стабильности генома. Восстанавливает естественные мутагенные повреждения ДНК. О6-метилгуанин вернуться к гуанин и предотвращает несоответствия и ошибки во время Репликация ДНК и транскрипция. Соответственно, потеря MGMT увеличивает канцерогенный риск у мышей после воздействия алкилирующие агенты.[7]Два бактериальных изоферменты находятся Ада и Ogt.
Функция и механизм
| 'О6-алкилгуанин-ДНК-алкилтрансфераза ' | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.1.1.63 | ||||||||
| Количество CAS | 77271-19-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Несмотря на то что алкилирование мутагены предпочтительно модифицировать гуаниновое основание в положении N7, О6-алкил-гуанин является основным канцерогенным поражением в ДНК. Этот Аддукт ДНК удаляется восстанавливающим белком О6-алкилгуанин-ДНК-алкилтрансфераза через SN2 механизм. Этот протеин не соответствует действительности фермент поскольку он удаляет алкильную группу из поражения в стехиометрический реакции, и активный фермент не регенерируется после алкилирования (обозначается как суицидальный фермент ). Остаток акцептора метила в белке представляет собой цистеин.[8]
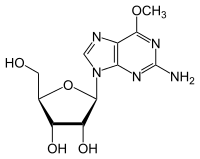
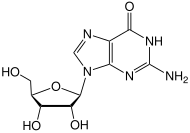
- Деметилирование 6-O-метилгуанозин к Гуанозин
Клиническое значение
Метилирование гена промоутер может сыграть значительную роль в канцерогенез. У пациентов с глиобластома, тяжелый тип опухоли головного мозга, состояние метилирования MGMT ген определяет, будут ли опухолевые клетки реагировать на темозоломид; если промотор был метилирован, темозоломид был более эффективным.[9] На клиническом уровне это означает более длительную выживаемость пациентов с глиобластомой с метилированным MGMT промоутер. Кроме того, MGMT Метилирование можно использовать для прогнозирования выживаемости пациентов в моделях клинического прогнозирования.[10] Для тестирования статуса метилирования промотора MGMT в клинических условиях методы на основе ДНК, такие как специфическая для метилирования полимеразная цепная реакция (MS-PCR) или пиросеквенирование, предпочтительнее иммуногистохимических или основанных на РНК анализах.[11]
MGMT также было показано, что это полезный инструмент, повышающий эффективность генной терапии. Используя двухкомпонентный вектор, состоящий из интересующего трансгена и MGMT, in vivo Отбор лекарств можно использовать для отбора успешно трансдуцированных клеток.[12]
Мутагены в окружающей среде,[13] в табачном дыме,[14] еда,[15] а также эндогенные продукты обмена[16] генерируют реактивные электрофильные частицы, которые алкилировать или конкретно метилат ДНК, генерирующая 6-O-метилгуанин (m6G).
В 1985 году Ярош подвел итоги своей ранней работы, в ходе которой был установлен m6G как алкилированное основание в ДНК, которое было наиболее мутагенным и канцерогенным.[17] В 1994 году Расули-Ниа и др.[18] показал, что примерно одна мутация индуцировалась на каждые восемь неисправленных m6Gs в ДНК. Мутации могут вызвать прогрессирование рака в результате естественного отбора.[нужна цитата ]
Выражение при раке
| Тип рака | Частота дефицита при раке | Частота дефицита соседних дефект поля |
|---|---|---|
| Шейный[19] | 61% | 39% |
| Колоректальный | 40%-90%[20][21][22][23][24] | 11%-34%[20][21] |
| Колоректальный с микроспутниковая нестабильность[25] | 70% | 60% |
| Аденокарцинома пищевода | 71%-79%[26][27] | 89%[27] |
| Плоскоклеточный рак пищевода | 38%-96%[26][28][29] | 65%[29] |
| Глиобластома из-за метилирования промотора | 44%-59%[30][31] | |
| Плоскоклеточный рак головы и шеи | 54%[32] | |
| Гепатоцеллюлярная карцинома (ассоциированная с вирусом гепатита С)[33] | 68% | 65% |
| Гортань | 54%-61%[34][35] | 38%[35] |
| Желудок | 32%-88%[36][37] | 17%-78%[36][37] |
| Щитовидная железа[38] | 87% |
Эпигенетическая репрессия
Только небольшая часть спорадических видов рака с дефицитом репарации ДНК имеет мутацию в гене репарации ДНК. Однако большинство спорадических форм рака с дефицитом репарации ДНК имеют один или несколько эпигенетический изменения, которые снижают или заглушают экспрессию гена репарации ДНК. Например, в исследовании 113 последовательных случаев рака прямой кишки только четыре имели миссенс-мутация в гене репарации ДНК MGMT, в то время как у большинства из них экспрессия MGMT снижена из-за метилирования MGMT промоутерский регион ( эпигенетический внесение изменений).[39]
MGMT может быть репрессирован эпигенетически несколькими способами.[40] Когда экспрессия MGMT подавляется при раке, это часто происходит из-за метилирования его промоторной области.[40] Однако экспрессия также может подавляться диметилированием лизина 9 гистона 3.[41] или за счет сверхэкспрессии ряда микроРНК, включая miR-181d, miR-767-3p и miR-603.[40][42][43]
Дефицит полевых дефектов

А дефект поля представляет собой область или «поле» эпителия, которое было предварительно обусловлено эпигенетическими изменениями и / или мутациями, чтобы предрасполагать его к развитию рака. Дефект поля показан на фотографии и диаграмме сегмента толстой кишки с раком толстой кишки и четырьмя небольшими полипами в той же области. Как отметил Рубин: «Подавляющее большинство исследований рака проводилось на четко определенных опухолях. in vivo, или на дискретных неопластических очагах in vitro.[44] Однако есть свидетельства того, что более 80% соматических мутаций, обнаруживаемых в опухолях толстой кишки человека с мутаторным фенотипом, происходят до начала терминальной клональной экспансии ».[45] Аналогичным образом Vogelstein et al.[46] указывают на то, что более половины соматических мутаций, выявленных в опухолях, произошли в предопухолевой фазе (в области дефекта поля), во время роста явно нормальных клеток.
В таблице выше недостатки MGMT были отмечены в полевых дефектах (гистологически нормальных тканях), окружающих большинство раковых образований. Если MGMT эпигенетически снижен или заглушен, это вряд ли предоставит селективное преимущество стволовым клеткам. Однако сниженная или отсутствующая экспрессия MGMT может вызвать повышенную скорость мутаций, и один или несколько мутировавших генов могут предоставить клетке избирательное преимущество. Недостаток экспрессии MGMT Тогда ген мог бы переноситься как избирательно нейтральный или лишь слегка вредный ген-путешественник (автостопщик), когда мутировавшая стволовая клетка генерирует расширенный клон. Продолжающееся присутствие клона с эпигенетически подавленным MGMT продолжит генерировать новые мутации, некоторые из которых могут вызвать опухоль.
Дефицит с экзогенным повреждением
Одного дефицита MGMT может быть недостаточно, чтобы вызвать прогрессирование рака. Мыши с гомозиготной мутацией в MGMT при выращивании без стресса у них не было больше раковых заболеваний, чем у мышей дикого типа.[47] Однако стрессовое лечение мышей азоксиметаном и декстрансульфатом вызывало более четырех опухолей толстой кишки на одну мышь с мутантом MGMT, но менее одной опухоли на мышь дикого типа.[48]
Репрессия в координации с другими генами репарации ДНК
При раке часто обнаруживается, что одновременно репрессируются несколько генов репарации ДНК.[49] В одном примере с участием MGMT, Цзян и др.[50] провели исследование, в котором оценили экспрессию мРНК 27 генов репарации ДНК в 40 астроцитомах по сравнению с нормальными тканями мозга людей, не страдающих астроцитомой. Среди 27 оцененных генов репарации ДНК 13 генов репарации ДНК, МГМТ, NTHL1, OGG1, SMUG1, ERCC1, ERCC2, ERCC3, ERCC4, MLH1, MLH3, RAD50, XRCC4 и XRCC5 все они были значительно подавлены во всех трех степенях (II, III и IV) астроцитом. Репрессия этих 13 генов в астроцитомах более низкого и более высокого уровня предполагает, что они могут быть важны как на ранних, так и на более поздних стадиях астроцитомы. В другом примере Kitajima et al.[51] обнаружили, что иммунореактивность к MGMT и MLH1 экспрессия тесно коррелировала в 135 образцах рака желудка, и потеря MGMT и hMLH1, по-видимому, синхронно ускорялась во время прогрессирования опухоли.
Недостаточная экспрессия нескольких генов репарации ДНК часто обнаруживается при раке,[49] и может вносить вклад в тысячи мутаций, обычно встречающихся при раке (см. частота мутаций при раке ).
Взаимодействия
О6-метилгуанин-ДНК-метилтрансфераза взаимодействовать с рецептор эстрогена альфа.[52]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000170430 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000054612 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Тано К., Шиота С., Кольер Дж., Фут Р.С., Митра С. (январь 1990 г.). «Выделение и структурная характеристика клона кДНК, кодирующего белок репарации ДНК человека для O6-алкилгуанина». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 87 (2): 686–90. Дои:10.1073 / pnas.87.2.686. ЧВК 53330. PMID 2405387.
- ^ Натараджан А.Т., Вермёлен С., Дарроуди Ф., Валентайн МБ, Брент ТП, Митра С., Тано К. (январь 1992 г.). «Хромосомная локализация человеческого гена O6-метилгуанин-ДНК-метилтрансферазы (MGMT) путем гибридизации in situ». Мутагенез. 7 (1): 83–5. Дои:10.1093 / mutage / 7.1.83. PMID 1635460.
- ^ Сираиси А., Сакуми К., Секигучи М. (октябрь 2000 г.). «Повышенная восприимчивость к химиотерапевтическим алкилирующим агентам мышей с дефицитом метилтрансферазы репарации ДНК». Канцерогенез. 21 (10): 1879–83. Дои:10.1093 / carcin / 21.10.1879. PMID 11023546.
- ^ Каина Б., Кристманн М., Науманн С., Роос В.П. (август 2007 г.). «MGMT: ключевой узел в борьбе с генотоксичностью, канцерогенностью и апоптозом, вызванным алкилирующими агентами». Ремонт ДНК (Amst.). 6 (8): 1079–99. Дои:10.1016 / j.dnarep.2007.03.008. PMID 17485253.
- ^ Hegi ME, Diserens AC, Gorlia T., Hamou MF, de Tribolet N, Weller M, Kros JM, Hainfellner JA, Mason W, Mariani L, Bromberg JE, Hau P, Mirimanoff RO, Cairncross JG, Janzer RC, Stupp R (2005 ). «Подавление гена MGMT и польза от темозоломида при глиобластоме». N. Engl. J. Med. 352 (10): 997–1003. Дои:10.1056 / NEJMoa043331. PMID 15758010.
- ^ Molenaar RJ, Verbaan D, Lamba S, Zanon C, Jeuken JW, Boots-Sprenger SH, Wesseling P, Hulsebos TJ, Troost D, van Tilborg AA, Leenstra S, Vandertop WP, Bardelli A, van Noorden CJ, Bleeker FE (2014 г. ). «Комбинация мутаций IDH1 и статуса метилирования MGMT предсказывает выживаемость при глиобластоме лучше, чем только IDH1 или MGMT». Нейроонкология. 16 (9): 1263–73. Дои:10.1093 / neuonc / nou005. ЧВК 4136888. PMID 24510240.
- ^ Преуссер, М.; Janzer, Charles R .; Felsberg, J .; Reifenberger, G .; Hamou, M. F .; Diserens, A.C .; Stupp, R .; Горлия, Т .; Marosi, C .; Heinzl, H .; Hainfellner, J. A .; Хеги, М. (октябрь 2008 г.). «Иммуногистохимия против O6-метилгуанин-метилтрансферазы (MGMT) при мультиформной глиобластоме: вариабельность наблюдателя и отсутствие связи с выживаемостью пациента препятствуют его использованию в качестве клинического биомаркера». Brain Pathol. 18 (4): 520–532. Дои:10.1111 / j.1750-3639.2008.00153.x. PMID 18400046. S2CID 21167901.
- ^ Чанг А.Х., Стефан М.Т., Лисовски Л., Саделайн М. (2008). «Эритроид-специфическая доставка человеческого фактора IX из отобранных in vivo гемопоэтических стволовых клеток после немиелоаблативного кондиционирования у мышей с гемофилией B». Мол. Ther. 16 (10): 1745–52. Дои:10.1038 / мт.2008.161. ЧВК 2658893. PMID 18682698.
- ^ Бартч Х., Монтесано Р. (1984). «Значение нитрозаминов для рака человека». Канцерогенез. 5 (11): 1381–93. Дои:10.1093 / carcin / 5.11.1381. PMID 6386215.
- ^ Кристманн М., Кайна Б. (2012). «О (6) -метилгуанин-ДНК-метилтрансфераза (MGMT): влияние на риск рака в ответ на табачный дым». Мутат. Res. 736 (1–2): 64–74. Дои:10.1016 / j.mrfmmm.2011.06.004. PMID 21708177.
- ^ Фахрер Дж., Кайна Б. (2013). «О6-метилгуанин-ДНК-метилтрансфераза в защите от N-нитрозосоединений и колоректального рака». Канцерогенез. 34 (11): 2435–42. Дои:10.1093 / carcin / bgt275. PMID 23929436.
- ^ Де Бонт Р., ван Ларебеке Н. (2004). «Эндогенное повреждение ДНК у человека: обзор количественных данных». Мутагенез. 19 (3): 169–85. Дои:10.1093 / mutage / geh025. PMID 15123782.
- ^ Ярош Д.Б. (1985). «Роль O6-метилгуанин-ДНК-метилтрансферазы в выживании клеток, мутагенезе и канцерогенезе». Мутат. Res. 145 (1–2): 1–16. Дои:10.1016/0167-8817(85)90034-3. PMID 3883145.
- ^ Расули-Ниа А., Сибгхат-Уллах, Мирзаянс Р., Патерсон М.С., День RS (1994). «О количественной взаимосвязи между остатками O6-метилгуанина в геномной ДНК и производством обменов сестринских хроматид, мутаций и летальных исходов в линии опухолевых клеток человека». Мутат. Res. 314 (2): 99–113. Дои:10.1016/0921-8777(94)90074-4. PMID 7510369.
- ^ Илиопулос Д., Ойкономоу П., Мессинис I, Цезоу А. (2009). «Корреляция гиперметилирования промоторов в генах hTERT, DAPK и MGMT с прогрессированием шейного онкогенеза». Онкол. Представитель. 22 (1): 199–204. Дои:10.3892 / или_00000425. PMID 19513524.
- ^ а б Шен Л., Кондо Ю., Роснер Г.Л., Сяо Л., Эрнандес Н.С., Вилайтонг Дж., Хулихан П.С., Кроуз Р.С., Прасад А.Р., Эйнспахр Дж. Г., Бакмайер Дж., Альбертс Д.С., Гамильтон С.Р., Исса Дж. П. (2005). «Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке». J. Natl. Институт рака. 97 (18): 1330–8. Дои:10.1093 / jnci / dji275. PMID 16174854.
- ^ а б Ли К. Х., Ли Дж. С., Нам Дж. Х., Чхве С., Ли МС, Пак С. С., Джунг С. В., Ли Дж. Х. (2011). «Статус метилирования промотора генов hMLH1, hMSH2 и MGMT при колоректальном раке, ассоциированном с последовательностью аденома-карцинома». Langenbecks Arch Surg. 396 (7): 1017–26. Дои:10.1007 / s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Псофаки В., Калогера С., Цамбурас Н., Стефану Д., Цианос Е., Сефериадис К., Колиос Г. (2010). «Статус метилирования промотора hMLH1, MGMT и CDKN2A / p16 в колоректальных аденомах». Мир J. Гастроэнтерол. 16 (28): 3553–60. Дои:10.3748 / wjg.v16.i28.3553. ЧВК 2909555. PMID 20653064.
- ^ Амату А., Сарторе-Бьянки А., Моутинью С., Белотти А., Бенкардино К., Кирико Г., Кассингена А., Рускони Ф., Эспозито А., Ничелатти М., Эстеллер М., Сиена С. (2013). «Промотор CpG-островка гиперметилирования фермента репарации ДНК MGMT предсказывает клинический ответ на дакарбазин в исследовании II фазы метастатического колоректального рака». Clin. Рак Res. 19 (8): 2265–72. Дои:10.1158 / 1078-0432.CCR-12-3518. PMID 23422094.
- ^ Мокаррам П., Замани М., Кавусипур С., Нагибалхоссаини Ф., Ираджие С., Моради Сараби М., Хоссейни С.В. (2013). «Различные паттерны метилирования ДНК двух различных областей промотора O6-метилгуанин-ДНК-метилтрансферазы (O6-MGMT) при колоректальном раке». Мол. Биол. Представитель. 40 (5): 3851–7. Дои:10.1007 / s11033-012-2465-3. PMID 23271133. S2CID 18733871.
- ^ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, Lamri A, Hamelin R, Cosnes J, Oliveira C, Seruca R, Gaub MP, Legrain M, Collura A, Lascols O, Tiret E, Fléjou JF , Дюваль А (2010). «Толерантность к метилированию из-за дефекта поля O6-метилгуанин-ДНК-метилтрансферазы (MGMT) в слизистой оболочке толстой кишки: начальный шаг в развитии колоректального рака с дефицитом репарации несоответствия». Кишечник. 59 (11): 1516–26. Дои:10.1136 / gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ а б Хасина Р., Сурати М., Кавада И., Ариф К., Кэри Г.Б., Кантети Р., Хусейн А.Н., Фергюсон М.К., Вокес Э.Е., Виллафлор В.М., Салгия Р. (2013). «Метилирование метилтрансферазы O-6-метилгуанин-дезоксирибонуклеиновой кислоты усиливает ответ на лечение темозоломидом при раке пищевода». J Carcinog. 12: 20. Дои:10.4103/1477-3163.120632. ЧВК 3853796. PMID 24319345.
- ^ а б Kuester D, El-Rifai W, Peng D, Ruemmele P, Kroeckel I, Peters B, Moskaluk CA, Stolte M, Mönkemüller K, Meyer F, Schulz HU, Hartmann A, Roessner A, Schneider-Stock R (2009). «Подавление экспрессии MGMT за счет гиперметилирования промотора в последовательности метаплазия-дисплазия-карцинома пищевода Барретта». Рак Lett. 275 (1): 117–26. Дои:10.1016 / j.canlet.2008.10.009. ЧВК 4028828. PMID 19027227.
- ^ Лин Цу, Ли П, Ге MH, Ху Ф. Дж., Фанг XH, Донг Ц. М., Мао В. М. (2011). «Аберрантное метилирование различных генов репарации ДНК демонстрирует отличную прогностическую ценность для рака пищевода». Копать землю. Dis. Наука. 56 (10): 2992–3004. Дои:10.1007 / s10620-011-1774-z. PMID 21674174. S2CID 22913110.
- ^ а б Су И, Инь Л, Лю Р, Шэн Дж, Ян М, Ван И, Пан Э, Го В, Пу И, Чжан Дж, Лян Джи (2014). «Статус метилирования промотора MGMT, hMSH2 и hMLH1 и его связь с соответствующей экспрессией белка и мутациями TP53 в плоскоклеточной карциноме пищевода человека». Med. Онкол. 31 (2): 784. Дои:10.1007 / s12032-013-0784-4. PMID 24366688. S2CID 22746140.
- ^ Моранди Л., Франчески Э., де Биасе Д., Маруччи Г., Тосони А., Эрмани М., Пессия А, Таллини Г., Брандес А. (2010). «Анализ метилирования промотора O6-метилгуанин-ДНК-метилтрансферазы в глиобластоме: обнаружение количественной ПЦР на основе заблокированной нуклеиновой кислоты с использованием импринтированного гена (SNURF) в качестве эталона». BMC Рак. 10: 48. Дои:10.1186/1471-2407-10-48. ЧВК 2843669. PMID 20167086.
- ^ Quillien V, Lavenu A, Karayan-Tapon L, Carpentier C, Labussière M, Lesimple T, Chinot O, Wager M, Honnorat J, Saikali S, Fina F, Sanson M, Figarella-Branger D (2012). «Сравнительная оценка 5 методов (полимеразная цепная реакция, специфичная для метилирования, MethyLight, пиросеквенирование, чувствительное к метилированию плавление с высоким разрешением и иммуногистохимия) для анализа O6-метилгуанин-ДНК-метилтранферазы у 100 пациентов с глиобластомой». Рак. 118 (17): 4201–11. Дои:10.1002 / cncr.27392. PMID 22294349. S2CID 8145409.
- ^ Куцимпелас Д., Понгсапич В., Генрих Ю., Манн С., Манн В. Дж., Бригер Дж. (2012). «Промоторное метилирование генов-супрессоров опухолей MGMT, MLH1 и RASSF1A при плоскоклеточной карциноме головы и шеи: фармакологическое деметилирование генома снижает пролиферацию клеток плоскоклеточной карциномы головы и шеи». Онкол. Представитель. 27 (4): 1135–41. Дои:10.3892 / или 2012.1624. ЧВК 3583513. PMID 22246327.
- ^ Зекри А.Р., Бахнаси А.А., Shoeab FE, Мохамед В.С., Эль-Дахшан Д.Х., Али FT, Сабри Г.М., Дасгупта Н., Дауд СС (2014). «Метилирование нескольких генов гепатоцеллюлярной карциномы, ассоциированной с вирусом гепатита С». J Adv Res. 5 (1): 27–40. Дои:10.1016 / j.jare.2012.11.002. ЧВК 4294722. PMID 25685469.
- ^ Пиерини С., Жорданов С.Х., Миткова А.В., Чалаков И.Ю., Мельничаров М.Б., Кунев К.В., Митев В.И., Канева Р.П., Горанова Т.Е. (2014). «Промотор гиперметилирования генов CDKN2A, MGMT, MLH1 и DAPK в плоскоклеточной карциноме гортани и их ассоциации с клиническими профилями пациентов». Голова Шея. 36 (8): 1103–8. Дои:10.1002 / хед.23413. PMID 23804521. S2CID 11916790.
- ^ а б Paluszczak J, Misiak P, Wierzbicka M, Woniak A, Baer-Dubowska W (2011). «Частое гиперметилирование DAPK, RARbeta, MGMT, RASSF1A и FHIT при плоскоклеточном раке гортани и прилегающей нормальной слизистой оболочке». Оральный Онкол. 47 (2): 104–7. Дои:10.1016 / j.oraloncology.2010.11.006. PMID 21147548.
- ^ а б Джин Дж, Се Л., Се СН, Чжоу Ю.Ф. (2014). «Аберрантное метилирование ДНК генов MGMT и hMLH1 в прогнозировании рака желудка». Genet. Мол. Res. 13 (2): 4140–5. Дои:10.4238 / 2014. 30.9 мая. PMID 24938706.
- ^ а б Цзоу XP, Чжан Б., Чжан XQ, Чен М., Цао Дж, Лю В.Дж. (2009). «Промотор гиперметилирования нескольких генов в ранней аденокарциноме желудка и предраковых поражениях». Гм. Патол. 40 (11): 1534–42. Дои:10.1016 / j.humpath.2009.01.029. PMID 19695681.
- ^ Мохтар М., Кондо К., Намура Т., Али А.Х., Фудзита Й., Такай С., Такидзава Х., Накагава Й., Тоба Х., Кадзюра К., Йошида М., Каваками Г., Сакияма С., Тангоку А. (2014). «Профили метилирования и экспрессии гена MGMT в эпителиальных опухолях тимуса». Рак легких. 83 (2): 279–87. Дои:10.1016 / j.lungcan.2013.12.004. PMID 24388682.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (июнь 2005 г.). «О (6) -метилгуанинметилтрансфераза при колоректальном раке: обнаружение мутаций, потеря экспрессии и слабая связь с переходами G: C> A: T». Кишечник. 54 (6): 797–802. Дои:10.1136 / гут.2004.059535. ЧВК 1774551. PMID 15888787.
- ^ а б c Кабрини Дж., Фаббри Э, Ло Нигро С., Дечекки М.С., Гамбари Р. (2015). «Регулирование экспрессии O6-метилгуанин-ДНК-метилтрансферазы и лечение глиобластомы (обзор)». Int. Дж. Онкол. 47 (2): 417–28. Дои:10.3892 / ijo.2015.3026. ЧВК 4501657. PMID 26035292.
- ^ Накагавати Т., Соедзима Х, Урано Т., Чжао В., Хигашимото К., Сато Й, Мацукура С., Кудо С., Китадзима Ю., Харада Х, Фурукава К., Мацудзаки Х, Эми М, Накабеппу Й, Миядзаки К., Сэкигучи М, Мукаи (2003). «Эффект подавления гиперметилирования CpG-островков и модификаций гистонов на экспрессию гена O6-метилгуанин-ДНК-метилтрансферазы (MGMT) при раке человека». Онкоген. 22 (55): 8835–44. Дои:10.1038 / sj.onc.1207183. PMID 14647440.
- ^ Кушваха Д., Рамакришнан В., Нг К., Стид Т., Нгуен Т., Футалан Д., Акерс Дж. К., Саркария Дж., Цзян Т., Чоудхури Д., Картер Б.С., Чен С.К. (2014). «Полногеномный скрининг miRNA показал miR-603 как MGMT-регулирующую miRNA в глиобластомах». Oncotarget. 5 (12): 4026–39. Дои:10.18632 / oncotarget.1974. ЧВК 4147303. PMID 24994119.
- ^ Чжан В., Чжан Дж., Хоадли К., Кушваха Д., Рамакришнан В., Ли С., Кан С, Ю Й, Цзян С., Сон С., Цзян Т., Чен СС (2012). «miR-181d: прогнозирующий биомаркер глиобластомы, который подавляет экспрессию MGMT». Нейроонкология. 14 (6): 712–9. Дои:10.1093 / neuonc / nos089. ЧВК 3367855. PMID 22570426.
- ^ Рубин Х (март 2011 г.). «Поля и полевая канцеризация: пренеопластическое происхождение рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отслеживать по плотности насыщения в культуре». BioEssays. 33 (3): 224–31. Дои:10.1002 / bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Цао Дж. Л., Ятабэ Ю., Саловаара Р., Ярвинен Х. Дж., Меклин Дж. П., Аалтонен Л. А., Таваре С., Шибата Д. (февраль 2000 г.). «Генетическая реконструкция истории индивидуальных колоректальных опухолей». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 97 (3): 1236–41. Дои:10.1073 / pnas.97.3.1236. ЧВК 15581. PMID 10655514.
- ^ Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинзлер К.В. (март 2013 г.). «Пейзажи генома рака». Наука. 339 (6127): 1546–58. Дои:10.1126 / наука.1235122. ЧВК 3749880. PMID 23539594.
- ^ Мейра Л. Б., Кальво Дж. А., Шах Д., Клапач Дж., Мороски-Эркул К. А., Бронсон Р. Т., Самсон Л. Д. (2014). «Ремонт эндогенных повреждений оснований ДНК влияет на продолжительность жизни мышей». Ремонт ДНК (Amst.). 21: 78–86. Дои:10.1016 / j.dnarep.2014.05.012. ЧВК 4125484. PMID 24994062.
- ^ Виртц С., Нагель Г., Эшкинд Л., Нейрат М. Ф., Самсон Л. Д., Кайна Б. (2010). «И эксцизионная репарация оснований, и O6-метилгуанин-ДНК-метилтрансфераза защищают от канцерогенеза толстой кишки, вызванного метилированием». Канцерогенез. 31 (12): 2111–7. Дои:10.1093 / carcin / bgq174. ЧВК 2994278. PMID 20732909.
- ^ а б Бернштейн С, Бернштейн Х (2015). «Эпигенетическое снижение репарации ДНК при прогрессировании рака желудочно-кишечного тракта». Ворлд Дж Гастроинтест Онкол. 7 (5): 30–46. Дои:10.4251 / wjgo.v7.i5.30. ЧВК 4434036. PMID 25987950.
- ^ Цзян З, Ху Дж, Ли Х, Цзян И, Чжоу В., Лу Д (2006). «Анализ экспрессии 27 генов репарации ДНК в астроцитоме с помощью набора низкой плотности TaqMan». Neurosci. Латыш. 409 (2): 112–7. Дои:10.1016 / j.neulet.2006.09.038. PMID 17034947.
- ^ Китадзима Ю., Миядзаки К., Мацукура С., Танака М., Секигучи М. (2003). «Потеря экспрессии ферментов репарации ДНК MGMT, hMLH1 и hMSH2 во время прогрессирования опухоли при раке желудка». Рак желудка. 6 (2): 86–95. Дои:10.1007 / s10120-003-0213-z. PMID 12861399.
- ^ Тео АК, О ХК, Али РБ, Ли Б.Ф. (октябрь 2001 г.). «Модифицированный фермент репарации ДНК человека О (6) -метилгуанин-ДНК-метилтрансфераза является негативным регулятором транскрипции, опосредованной рецептором эстрогена, при повреждении ДНК алкилированием». Мол. Клетка. Биол. 21 (20): 7105–14. Дои:10.1128 / MCB.21.20.7105-7114.2001. ЧВК 99886. PMID 11564893.
дальнейшее чтение
- Марджисон Г.П., Повей А.К., Кайна Б., Сантибаньес Кореф М.Ф. (2003). «Вариабельность и регуляция O6-алкилгуанин-ДНК-алкилтрансферазы». Канцерогенез. 24 (4): 625–35. Дои:10.1093 / carcin / bgg005. PMID 12727789.