Цианистый кальций - Calcium cyanide
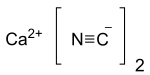 | |
| Имена | |
|---|---|
| Название ИЮПАК дицианид кальция | |
| Систематическое название ИЮПАК дицианид кальция | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.008.856 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| Ca (CN)2 | |
| Молярная масса | 92,1128 г / моль |
| Внешность | белый порошок |
| Запах | цианистый водород |
| Плотность | 1,853 (20 ° С) |
| Температура плавления | 640 ° С (1184 ° F, 913 К) (разлагается) |
| растворимый | |
| Растворимость | растворим в алкоголь, слабые кислоты |
| Структура | |
| ромбоэдрический | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Негорючий | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Цианистый кальций также известный как черный цианид,[2] это кальций соль из цианид, неорганическое соединение с формула Ca (CN)2. В чистом виде - белое твердое вещество, которое наблюдается редко; коммерческие образцы могут быть черно-серыми. Это гидролизует охотно (даже в влажный воздуха ) для выделения цианистого водорода. Как и другие подобные цианиды, он очень токсичный.[3]
Подготовка
Цианид кальция можно получить, обработав порошкообразным оксид кальция с кипячением безводный синильная кислота при наличии ускорителя типа аммиак или вода, чтобы минимизировать потерю синильной кислоты полимеризация. Его также можно получить реакцией жидкой синильной кислоты с карбид кальция. В качестве альтернативы цианид кальция может быть получен реакцией газообразной синильной кислоты с негашеной известью (CaO) при высоких температурах около 400 ° C. При более высоких температурах около 600 ° C кальций цианимид вместо этого формируется.[4] Приготовленный материал часто загрязнен полимерными производными цианистого водорода, отсюда и черный цвет.
Реактивность
Цианистый кальций гидролизует легко образовывать цианистый водород. Наличие кислота ускоренная эволюция цианистый водород газ. Он реагирует на окислители. Цианид кальция также иногда используется для производства цианид аммония реагируя на это с карбонат аммония.
- Ca (CN) 2 + (NH 4)2CO3 → 2 NH 4CN + CaCO3
Использует
Цианид кальция используется почти исключительно в горнодобывающей промышленности. Он служит недорогим источником цианид во многих процессах выщелачивания или чана для получения драгоценных металлов, таких как золото и серебро из их руд.[5] Это достигается путем формирования координационные комплексы с металлами, отделяющими их от руды.[6]Он распространяется либо в виде твердых хлопьев, либо в жидкой форме.[5] Высокая токсичность цианида кальция при прикосновении, вдыхании или проглатывании делает его полезным в качестве родентицид. Например, он использовался при управлении популяцией индийских хохлатых дикобразов (Hystrix indica ).[7] Его токсичность также использовалась как инсектицид.[8] Однако его высокая токсичность во многих случаях делает его неблагоприятным, и вместо него часто используются другие менее вредные химические вещества.[7] Он также используется при изготовлении цианистый водород, цианид аммония, и ферроцианиды.
Безопасность
Как и другие соли цианида, это соединение очень токсично, и его использование строго регулируется.
Рекомендации
- ^ http://cameochemicals.noaa.gov/chemical/2775
- ^ . «Цианид кальция». Словарь Мерриама-Вебстера. 2001. http://www.merriam-webster.com/dictionary/calcium%20cyanide (по состоянию на 22 апреля 2012 г.).
- ^ Эрнст Гейл, Стивен Гос, Руппрехт Кульцер, Юрген Лорёш, Андреас Рубо и Манфред Зауэр «Циано-соединения, неорганические» Энциклопедия промышленной химии Ульманна Wiley-VCH, Вайнхайм, 2004. Дои:10.1002 / 14356007.a08_159.pub2
- ^ . «Производство синильной кислоты» Патентное ведомство США. 1933. (доступ 22 апреля 2012 г.).
- ^ а б «Использование цианида в золотой промышленности» Международный кодекс обращения с цианидами при использовании цианида в золоте. 2011. http://www.cyanidecode.org/cyanide_use.php (по состоянию на 22 апреля 2012 г.).
- ^ . «координационное соединение» Encyclopdia Britannica. Энциклопедия Britannica Online Academic Edition. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.
- ^ а б . "Оценка фумигации фосфидом алюминия для борьбы с индийским хохлатым дикобразом (Hystrix indica) в кустарниках *. 2008.
- ^ . «ЦИАНИД КАЛЬЦИЯ ДЛЯ БОРЬБЫ С ЧИНЧЧИКОМ» УНИВЕРСИТЕТ ИЛЛИНОИССКОЙ сельскохозяйственной опытной станции. 1924.

