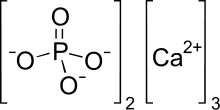
Трикальций фосфат - Tricalcium phosphate
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Трикальций бис (фосфат) | |
| Другие имена Трехосновный фосфат кальция | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.028.946 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| Ca3(PO4)2 | |
| Молярная масса | 310.18 |
| Внешность | Белый аморфный порошок |
| Плотность | 3,14 г / см3 |
| Температура плавления | Разжижается под высоким давлением при 1670 К (1391 ° C) |
| 0,002 г / 100 г | |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -4126 ккал / моль (α-форма)[1] |
| Фармакология | |
| A12AA01 (ВОЗ) | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой анионы | Пирофосфат кальция |
Другой катионы | Тримагнийфосфат Тринатрийфосфат Фосфат калия |
Родственные соединения | Монокальций фосфат Дикальция фосфат |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Трикальций фосфат (иногда сокращенно TCP) это кальций соль из фосфорная кислота с химическая формула Ca3(PO4)2. Он также известен как трехосновной фосфат кальция и костный фосфат извести (BPL). Это белое твердое вещество с низкой растворимостью. Большинство коммерческих образцов «трикальцийфосфата» действительно гидроксиапатит.[2]
Он существует в виде трех кристаллических полиморфов α, α 'и β. Состояния α и α 'стабильны при высоких температурах.
Номенклатура
Фосфат кальция относится к многочисленным материалам, состоящим из ионов кальция (Ca2+) вместе с ортофосфаты (PO43−), метафосфаты или же пирофосфаты (П2О74−) и иногда оксид и гидроксид ионы. Особенно обычный минерал апатит имеет формулу Ca5(PO4)3Икс, куда Икс является F, Cl, ОЙ, или смесь; это гидроксиапатит если дополнительный ион представляет собой в основном гидроксид. Большая часть «трикальцийфосфата» на рынке на самом деле порошкообразная. гидроксиапатит.
Подготовка
Фосфат трикальция производится в промышленных масштабах путем обработки гидроксиапатит с фосфорная кислота и гашеная известь.[2]
Его нельзя осаждать непосредственно из водного раствора. Обычно используются реакции двойного разложения с участием растворимого фосфата и солей кальция, например (NH4)2HPO4 + Ca (НЕТ3)2.[3] выполняется в условиях тщательно контролируемого pH. Осадок будет либо «аморфным трикальцийфосфатом», ATCP, либо гидроксиапатитом с дефицитом кальция, CDHA, Ca9(HPO4) (PO4)5(ОН) (обратите внимание, что CDHA иногда называют апатитовым трифосфатом кальция).[3][4][5] Кристаллический трикальцийфосфат можно получить прокаливанием осадка. β-Ca3(PO4)2 обычно образуется, более высокие температуры требуются для получения α-Ca3(PO4)2.
Альтернатива влажной процедуре предполагает нагревание смеси пирофосфата кальция и карбоната кальция:[4]
- CaCO3 + Ca2п2О7 → Ca3(PO4)2 + CO2
Структура β-, α- и α'- Ca3(PO4)2 полиморфы
Фосфат трикальция имеет три признанных полиморфа, ромбоэдрическую β-форму (показанную выше) и две высокотемпературные формы, моноклинную α- и гексагональную α'-. β-трикальцийфосфат имеет кристаллографическую плотность 3,066 г / см3.−3 в то время как высокотемпературные формы менее плотные, α-трикальцийфосфат имеет плотность 2,866 г / см3.−3 а α'-трикальцийфосфат имеет плотность 2,702 г / см3.−3 Все формы имеют сложную структуру, состоящую из тетраэдрических фосфатных центров, связанных через кислород с ионами кальция.[6] Каждая высокотемпературная форма имеет два типа колонок, одна из которых содержит только ионы кальция, а другая - кальций и фосфат.[7]
Между бета- и альфа-формами существуют различия в химических и биологических свойствах, альфа-форма более растворима и биоразлагаема. Обе формы коммерчески доступны и присутствуют в составах, используемых в медицине и стоматологии.[7]
Вхождение
Фосфат кальция является одним из основных горение продукты кость (видеть костная зола ). Фосфат кальция также обычно получают из неорганический источники, такие как минеральная порода.[8]Фосфат трикальция встречается в природе в нескольких формах, в том числе:
- как камень в Марокко, Израиль, Филиппины, Египет, и Кола (Россия ) и в меньших количествах в некоторых других странах. Естественная форма не является полностью чистой, и есть некоторые другие компоненты, такие как песок и известь, которые могут изменить состав. По P2О5, большинство кальций-фосфатных пород содержат от 30% до 40% P2О5 по весу.
- в скелетах и зубах позвоночное животное животные
- в молоко.
Двухфазный трикальцийфосфат, BCP
Двухфазный трикальцийфосфат, BCP, первоначально описывался как трикальцийфосфат, но методы рентгеновской дифракции показали, что материал представляет собой однородную смесь двух фаз, гидроксиапатита (HA) и β-трикальцийфосфата.[9] Это керамика.[10]Подготовка включает спекание, вызывающее необратимое разложение апатитов с дефицитом кальция.[4] альтернативно называемые нестехиометрическими апатитами или основным фосфатом кальция,[11] пример:[12]
- Ca10 − δ(PO4)6 − δ(HPO4)δ(ОЙ)2 − δ → (1-δ) Са10(PO4)6(ОЙ)2 + 3δCa3(PO4)2
β-TCP может содержать примеси, например пирофосфат кальция, CaP2О7 и апатит. β-TCP является биорезорбируемым. Биоразложение BCP включает более быстрое растворение фазы β-TCP с последующим удалением кристаллов HA. β-TCP не растворяется в жидкостях организма при физиологических уровнях pH, для растворения требуется активность клеток, производящая кислый pH.[4]
Использует
Пищевая добавка
Фосфат трикальция используется в порошкообразных специях как агент против слеживания, например чтобы поваренная соль не слеживалась. Фосфатам кальция присвоен европейский номер пищевой добавки. E341.
Товары для здоровья и красоты
Он также встречается в детская присыпка и зубная паста.[2]
Биомедицинские
Он также используется как пищевая добавка[13] и встречается естественным образом в корова молоко[нужна цитата ], хотя наиболее распространенными и экономичными формами добавок являются карбонат кальция (которые следует принимать во время еды) и цитрат кальция (который можно принимать без еды).[14] Есть некоторые споры о различных биодоступность различных солей кальция.
Его можно использовать в качестве замены ткани для восстановления костных дефектов при автогенный костный трансплантат неосуществимо или невозможно.[15][16][17] Его можно использовать отдельно или в сочетании с биоразлагаемый, рассасывающийся полимер Такие как полигликолевая кислота.[18] Его также можно комбинировать с аутологичными материалами для костного трансплантата.[19][20]
Пористые каркасы из бета-трикальцийфосфата используются в качестве систем-носителей лекарств для локальной доставки лекарств в кости.[21]
Естественное явление
Туит - природный аналог трикальцийортофосфата (V) - является редким компонентом некоторых метеоритов. Его образование связано с ударным метаморфизмом.[22][23]
Рекомендации
- ^ Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A21. ISBN 978-0-618-94690-7.
- ^ а б c Клаус Шредтер; Герхард Беттерманн; Томас Стаффель; Фридрих Валь; Томас Кляйн; Томас Хофманн (2012). «Фосфорная кислота и фосфаты». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_465.pub3.
- ^ а б Дестенвиль А., Чемпион Э., Бернаш-Ассоллант Д., Лаборд Э. (2003). «Синтез, характеристика и термическое поведение апатитового трикальцийфосфата». Химия и физика материалов. 80 (1): 269–277. Дои:10.1016 / S0254-0584 (02) 00466-2.CS1 maint: использует параметр авторов (связь)
- ^ а б c d Rey, C .; Гребни, Ц .; Drouet, C .; Гроссин Д. (2011). «1.111 - Биоактивная керамика: физическая химия». В Ducheyne, Пол (ред.). Комплексные биоматериалы. 1. Эльзевир. С. 187–281. Дои:10.1016 / B978-0-08-055294-1.00178-1. ISBN 978-0-08-055294-1.
- ^ Дорожкин, Сергей В. (декабрь 2012 г.). «Аморфные (орто) фосфаты кальция». Acta Biomaterialia. 6 (12): 4457–4475. Дои:10.1016 / j.actbio.2010.06.031. PMID 20609395.CS1 maint: использует параметр авторов (связь)
- ^ Яшима, М .; Sakai, A .; Kamiyama, T .; Хошикава А. (2003). «Анализ кристаллической структуры бета-трикальцийфосфата Ca3(PO4)2 методом нейтронной порошковой дифракции ». РНК1 химии твердого тела. 175 (2): 272 – p277. Дои:10.1016 / S0022-4596 (03) 00279-2.
- ^ а б Carrodeguas, R.G .; Де Аза, С. (2011). «α-Трикальцийфосфат: синтез, свойства и биомедицинские применения». Acta Biomaterialia. 7 (10): 3536–3546. Дои:10.1016 / j.actbio.2011.06.019. PMID 21712105.CS1 maint: использует параметр авторов (связь)
- ^ Якубов, Жанна, MS. Руководство вегетарианского журнала по пищевым ингредиентам «Путеводитель по пищевым ингредиентам». The Vegetarian Resource Group, n.d. Интернет. 14 сентября 2012 г.
- ^ Daculsi, G .; Легерос, Р. (2008). «17 - Двухфазная керамика трикальцийфосфат / гидроксиапатит». В Кокубо, Тадаши (ред.). Биокерамика и ее клиническое применение. Издательство Вудхед. С. 395–423. Дои:10.1533/9781845694227.2.395. ISBN 978-1-84569-204-9.
- ^ Салинас, Антонио Дж .; Валле-Реджи, Мария (2013). «Биоактивная керамика: от костных трансплантатов до тканевой инженерии». RSC Advances. 3 (28): 11116–11131. Дои:10.1039 / C3RA00166K.
- ^ Эллиотт, Дж. К. (1994). «3 - Гидроксиапатит и нестехиометрические апатиты». Исследования по неорганической химии. 18. Эльзевир. С. 111–189. Дои:10.1016 / B978-0-444-81582-8.50008-0. ISBN 9780444815828.
- ^ Валлет-Реджи, М.; Родригес-Лоренцо, Л.М. (ноябрь 1997 г.). «Синтез и характеристика кальциево-дефицитного апатита». Ионика твердого тела. 101–103, Часть 2: 1279–1285. Дои:10.1016 / S0167-2738 (97) 00213-0.CS1 maint: использует параметр авторов (связь)
- ^ Bonjour JP, Кэрри А.Л., Ferrari S, Клавьен Х., Слосман Д., Тейнц Г., Риццоли Р. (март 1997 г.). «Продукты, обогащенные кальцием, и рост костной массы у девочек препубертатного возраста: рандомизированное двойное слепое плацебо-контролируемое исследование». J. Clin. Вкладывать деньги. 99 (6): 1287–94. Дои:10.1172 / JCI119287. ЧВК 507944. PMID 9077538.
- ^ Штрауб Д.А. (июнь 2007 г.). «Добавки кальция в клинической практике: обзор форм, доз и показаний». Нутр Клин Практ. 22 (3): 286–96. Дои:10.1177/0115426507022003286. PMID 17507729.
- ^ Падерни С., Терци С., Амендола Л. (сентябрь 2009 г.). «Лечение крупных костных дефектов остеокондуктивным заменителем кости». Скелетно-мышечная хирургия. 93 (2): 89–96. Дои:10.1007 / s12306-009-0028-0. PMID 19711008. S2CID 33413039.
- ^ Мур, округ Колумбия, Чепмен М.В., Манске Д. (1987). «Оценка двухфазной кальций-фосфатной керамики для использования при трансплантации диафизарных дефектов длинных костей». Журнал ортопедических исследований. 5 (3): 356–65. Дои:10.1002 / jor.1100050307. PMID 3040949.
- ^ Ланге Т.А., Зервек Дж. Э., Пик Р. Д., Муни В., Харрисон Б. Х. (1986). «Гранулированный трикальцийфосфат в больших дефектах губчатого вещества». Анналы клинической и лабораторной науки. 16 (6): 467–72. PMID 3541772.
- ^ Цао Х., Кубояма Н. (сентябрь 2009 г.). «Биоразлагаемый пористый композитный каркас из PGA / beta-TCP для инженерии костной ткани». Кость. 46 (2): 386–95. Дои:10.1016 / j.bone.2009.09.031. PMID 19800045.
- ^ Эрбе Э.М., Маркс Дж. Г., Клинефф Т. Д., Беллинкампи Л. Д. (октябрь 2001 г.). «Возможности сверхпористого бета-трикальцийфосфата синтетического губчатого наполнителя костных пустот и композитного трансплантата аспирата костного мозга». Европейский журнал позвоночника. 10 Приложение 2: S141–6. Дои:10.1007 / s005860100287. ЧВК 3611552. PMID 11716011.
- ^ Бансал С., Чаухан В., Шарма С., Махешвари Р., Джуял А., Рагхуванши С. (июль 2009 г.). «Оценка гидроксиапатита и бета-трикальцийфосфата, смешанного с аспиратом костного мозга в качестве заменителя костного трансплантата для заднебокового спондилодеза». Индийский журнал ортопедии. 43 (3): 234–9. Дои:10.4103/0019-5413.49387. ЧВК 2762171. PMID 19838344.
- ^ Кунду, Б; Lemos A; Soundrapandian C; Сен PS; Datta S; Феррейра JMF; Басу Д. (2010). «Разработка пористых каркасов HAp и β-TCP путем консолидации крахмала с помощью метода вспенивания и системы доставки лекарств на основе двухслойного каркаса лекарство-хитозан». J. Mater. Sci. Mater. Med. 21 (11): 2955–69. Дои:10.1007 / s10856-010-4127-0. PMID 20644982. S2CID 6483779.
- ^ https://www.mindat.org/min-25637.html
- ^ https://www.ima-mineralogy.org/Minlist.htm

