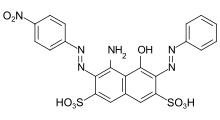
Кислотный краситель - Acid dye

Кислотные красители являются анионными, растворимы в воде и наносятся в основном из кислотной ванны. Эти красители обладают кислотными группами, такими как SO3H и COOH, и наносятся на шерсть, шелк и нейлон, когда между протонированной группой –NH2 волокна и кислотной группой красителя устанавливается ионная связь. Общая стойкость к стирке низкая, хотя светостойкость довольно хорошая. Поскольку краситель и волокно имеют противоположную электрическую природу, скорость попадания и поглощение кислотного красителя этими волокнами происходит быстрее; электролит в более высокой концентрации добавляется, чтобы замедлить поглощение красителя и сформировать ровные оттенки. Кислота образует катионы на волокне, а температура помогает заменить отрицательную часть кислоты молекулами анионного красителя.[1]
An кислотный краситель это краситель это обычно применяется к текстиль при низком pH. В основном они используются для окрашивания шерсти, а не хлопчатобумажных тканей.[2] Некоторые кислотные красители используются как пищевые красители,[3][4] а некоторые из них также можно использовать для окрашивания органелл в области медицины.
Описание
Кислотные красители обычно делятся на три класса в зависимости от их стойкость требования, способность к миграции и pH окрашивания.[5]
Кислотные красители прикрепляются к волокнам водородная связь, Силы Ван-дер-Ваальса[6] и ионная связь. Хотя некоторые кислотные красители работают в воде, многие предпочитают активировать красители в кислотных красильных ваннах. Согласно Кислотно-основная теория Бренстеда – Лоури, кислота - это молекула или ион, способные отдавать протон, и это определяется константа диссоциации кислоты. По сравнению с большинством кислот вода имеет гораздо более высокий pKa значение, что означает, что он диссоциирует, давая H+ с большим трудом. В этом контексте, если вместо воды используется кислота, то ион водорода (H+) легче диссоциирует, чтобы вступить в реакцию с анионом анилинового красителя, позволяя красителю раствориться.
Волокна животного белка и синтетические волокна нейлона содержат много катионный сайты, связывающие анионный краситель. Сила (устойчивость) этой связи отражает силу этого ионного взаимодействия.
Использует
Волокна
В лаборатории, дома или в художественной студии кислота, используемая в красильной ванне, часто представляет собой уксус (уксусная кислота ) или же лимонная кислота. Скорость поглощения красителя контролируется с помощью хлорида натрия. В текстиль, кислотные красители действуют на белок волокна, то есть волокна волос животных, такие как шерсть, альпака, и мохер. Они также эффективны при шелк.[7] Они эффективны при окрашивании синтетическое волокно нейлон, но минимальный интерес к окрашиванию любых других синтетический волокна.


Гистология
При окрашивании во время микроскопического исследования для диагностики или исследования кислотные красители используются для окрашивания основных белков ткани. Напротив, для окрашивания клеток используются базовые красители. ядра и некоторые другие кислотные компоненты тканей.[8] Что касается клеточных структур, кислотные красители будут окрашивать ацидофильный структуры, которые имеют чистый положительный заряд из-за того, что они имеют отрицательный заряд хромофор. Ацидофильные структуры включают цитоплазма, коллаген и митохондрии. У них есть близость друг к другу из-за противоречивых обвинений.[9][10] Примеры кислотных красителей, используемых в медицине, включают:[11]
- Пятно Ли (пятна красновато-розовые).
- Фосфорно-вольфрамовая кислота гематоксилин (PTAH) пятно (пятна синие).
- Эозин пятно (пятна розовато-оранжевые).
Пищевая промышленность
Кислотные красители также могут использоваться в качестве пищевого красителя, помогая повысить привлекательность определенных продуктов и, таким образом, стать более привлекательными для покупателей. Некоторые примеры включают эритрозин, тартразин, желтый закат и аллюра красный, чтобы назвать несколько, многие из которых азокрасители.[12] Эти красители можно использовать для глазури, печенья, хлеба, приправ или напитков. Чтобы предотвратить опасность для здоровья, краситель должен быть одобрен для употребления, прежде чем он будет отмечен как съедобный. Некоторые методы разделения, которые можно использовать для идентификации неутвержденных красителей, включают твердофазная экстракция процесс, избыточное давление тонкослойная хроматография процесс, и использование обращенно-фазовые пластины.[13]
Структуры
Химический состав кислотных красителей сложен и разнообразен. Большинство кислотных красителей по своей основной структуре связаны со следующим:
- Тип антрахинона: Многие кислотные красители синтезируются из химических промежуточных продуктов, которые в конечном состоянии образуют антрахиноноподобные структуры. Многие синие красители имеют эту структуру в качестве основной формы. Структура преобладает в классе выравнивающих кислотных красителей.
- Азокрасители: В состав азокрасителей входит азокраситель (R-N = N-R. Большинство азокрасителей не являются кислотными красителями, но многие кислотные красители являются азокрасителями. Многие кислотные красители азотипа имеют красный цвет.[14]
- Триарилметановый краситель: Они преобладают в классе фрезерных красителей. Есть много желтых и зеленых красителей, которые коммерчески наносятся на волокна, родственные трифенилметану.
C.I. Кислотный черный 1
C.I. Кислотно-желтый 36
C.I. Кислотно-синий 117
C.I. Кислотный апельсин 19
C.I. Кислотно-синий 25
C.I. Кислотный апельсин 3
Классы кислотных красителей
Кислотные красители можно классифицировать по их свойствам окрашивания. Это включает их влагостойкость, способность к миграции и pH окрашивания:[2]
- Выравнивающие кислотные красители: Эти красители имеют относительно низкую молекулярную массу. Следовательно, они легче мигрируют до фиксации и обладают низкой влагостойкостью. Обычно они не подходят для использования в качестве ткани для одежды. Для них требуется кислотная красильная ванна, часто с использованием серная кислота и сульфат натрия смеси (pH2-4),[7] вместе с выравнивающими агентами, такими как этоксилированный жирные амины.
- Фрезерные красители: Эти красители обладают высокой молекулярной массой, в результате чего они медленно мигрируют. Следовательно, они обладают влагостойкостью, что полезно для окрашивания шерстяных материалов. Кислотные красители для измельчения иногда называют «нейтральными кислотными красителями», поскольку они не требуют кислотной красильной ванны. Они обычно применяются с использованием Уксусная кислота (pH 4-7).[7]
- Металлокомплексные кислотные красители: Эти красители состоят из молекул кислотных красителей в комплексе с ионом металла, которым обычно является хром или кобальт. Красители на основе комплексных кислот и металлов обладают высокой молекулярной массой, что обеспечивает им низкую подвижность и высокую влагостойкость. По этой причине они обычно используются на нейлоновых и синтетических полиамидных волокнах. Кислотные красители на основе металлокомплексов экономичны, однако дают относительно тусклые оттенки. Кислотные красители на основе комплексов металлов принимают в красильной ванне более широкий диапазон pH (pH 2-7).[7]
Безопасность
Некоторые красители обладают мутагенным и канцерогенным действием, в том числе метиловый апельсин, кислотный красный 26, и трипановый синий.[15][16]
Рекомендации
- ^ А. К. Рой Чоудхари, «Подготовка и крашение текстиля», Science Publishers, США (2006).
- ^ а б Бут, Джеральд (2000). «Красители, общий обзор». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a09_073. ISBN 3527306730.
- ^ Троубридж Филиппоне, Пегги. «Пищевые красители». Получено 8 сентября, 2016.
- ^ Клаус Хунгер, изд. (2003), Промышленные красители: химия, свойства, применение (на немецком языке), Weinheim: WILEY-VCH Verlag, стр. 276ff, ISBN 978-3-662-01950-4
- ^ «Механизм окрашивания кислотными красителями». Текстильщик. Мажарул Ислам Кирон. Получено 2012-01-08.
- ^ Кларк, Джим (2012). «Межмолекулярная связь - силы Ван-дер-Ваальса». Chemguide.co.uk. Получено 15 июн 2014.
- ^ а б c d «Как действует кислотный краситель». Получено Двадцать первое октября, 2019.
- ^ Брукнер, Моника З. «Базовое клеточное окрашивание». Получено 12 декабря, 2013.
- ^ «Окрашивание и часто используемые пятна». Система обучения гистологии. Бостонский университет. Получено 2019-11-05.
- ^ Гохале, С (2008). Фармацевтическая биология. Махараштра, Индия: Pragati Books Pvt. ООО
- ^ «Окрашивание и часто используемые пятна». Система обучения гистологии. Бостонский университет. Получено 2019-11-05.
- ^ Фрейзер, Р.А. (2007). КАПИЛЛЯРНЫЙ ЭЛЕКТРОФОРЕЗ | Пищевые добавки. Elsevier Ltd.
- ^ Вега, М. (2000). Энциклопедия науки о разделении. Elsevier Ltd.
- ^ Голод, Клаус; Мишке, Питер; Рипер, Вольфганг; Рауэ, Родерих; Кунде, Клаус; Энгель, Алоис (2005). «Азокрасители». Энциклопедия промышленной химии Ульмана. Вайнхайм: Вайли-ВЧ. Дои:10.1002 / 14356007.a03_245. ISBN 3527306730.
- ^ Привал, М. Дж .; Белл, С. Дж .; Mitchell, V.D .; Peiperl, M.D .; Воан, В. Л. (1984). «Мутагенность бензидиновых и родственных бензидин красителей и выбранных моноазокрасителей в модифицированном анализе сальмонеллы». Мутационные исследования. 136 (1): 33–47. Дои:10.1016/0165-1218(84)90132-0. PMID 6371512.
- ^ Бансал, Мегха; Ядав, Раджеш Кумар (2016). «ПРОФЕССИОНАЛЬНЫЕ ОПАСНОСТИ ДЛЯ ЗДОРОВЬЯ И ИНФОРМАЦИЯ О БЕЗОПАСНОСТИ ПРОФЕССИОНАЛА СРЕДИ РАБОТНИКОВ ПРОМЫШЛЕННОСТИ ПОКРАШИВАНИЯ ТЕКСТИЛЯ В ДЖАЙПУРЕ, ИНДИЯ». Международный журнал по окружающей среде, науке и технологиям Университета Суреш Гьян Вихар. 2 (2): 30–38. S2CID 37596329.