Карбиновый комплекс переходных металлов - Transition metal carbyne complex
Карбиновые комплексы переходных металлов находятся металлоорганические соединения с тройная связь между углеродом и переходный металл. Эта тройная связь состоит из σ-связь и два π-связи.[1] В HOMO карбинового лиганда взаимодействует с LUMO металла для создания σ-связи. Две π-связи образуются, когда две ВЗМО-орбитали металла сдавать обратно к LUMO карбина. Их еще называют алкилидинами металлов - углерод представляет собой карбин лиганд. Такие соединения полезны в органический синтез из алкины и нитрилы. Они были в центре внимания многих фундаментальных исследований.[2]
Синтез
Карбиновые комплексы переходных металлов наиболее распространены для ранних переходных металлов, особенно ниобий, тантал, молибден, вольфрам, и рений. Они также могут содержать металлы с низкой валентностью, а также с металлами с высокой валентностью.

Первый образец карбинового комплекса металла был получен Фишер школа по лечению Cr (CO)5(C (OMe) Ph) с трихлорид бора:
- Cr (CO)5(C (OMe) Ph) + BCl3 → ClCr (CO)4(CPh) + CO + BCl2(OMe)
Многие комплексы высокомалентного карбина были с тех пор получены, часто дегидрогалогенирование карбеновых комплексов. Альтернативно, аминозамещенные лиганды карбина иногда образуются на протонирование богатых электронами изонитрил комплексы. По аналогии, О-протонирование μ3-CO лиганды в кластерах дают гидроксикарбиновые комплексы. Винил Было показано, что лиганды перегруппируются в лиганды карбина. Добавление электрофилы к винилиден лиганды также образуют комплексы карбина.[2]
Мостиковые алкилидиновые лиганды в кластерных соединениях
Некоторые металлические карбины димеризовать дать диметаллациклобутадиены. В этих комплексах карбиновый лиганд служит мостиковый лиганд.
Известно много связанных с кластерами карбиновых комплексов, обычно с CO лиганды. Эти соединения не имеют тройных связей MC; вместо этого углерод карбина является тетраэдрическим. Одними из самых известных являются производные трикобальта, которые получают путем обработки карбонил кобальта с галоформы:[3]
- 2 HCBr3 + 9⁄2 Co2(CO)8 → 2 HCCo3(CO)9 + 18 CO + 3 CoBr2
Структура
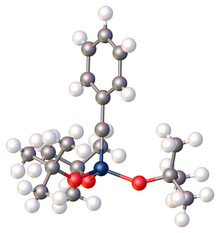
Мономерные металлокарбиновые комплексы обнаруживают довольно линейные связи M – C – R в соответствии с Рентгеновская кристаллография. Расстояния M – C обычно короче, чем связи M – C в карбенах металлов. Угол скрепления обычно составляет от 170 ° до 180 °.[5] По аналогии с Фишером и Шроком карбены; Известны также карбины Фишера и Шрока. Карбины Фишера обычно имеют металлы с более низкой степенью окисления, а лиганды являются π-акцептирующими / электроноакцепторными лигандами. С другой стороны, карбины Шрока обычно имеют металлы с более высокой степенью окисления и электронодонорные / анионные лиганды. В карбине Фишера С-карбин проявляет электрофильное поведение, в то время как карбины Шрока проявляют нуклеофильную реакционную способность на углероде карбина.[6] Комплексы карбина также охарактеризованы многими методами, включая ИК-спектроскопия, Рамановская спектроскопия.[7] Длины связей, углы связи и структуры могут быть выведены с помощью этих и других аналитических методов.
Первый карбин Фишера был выделен в 1973 году.[8] Два года спустя, в 1975 году, было сообщено о первом карбине Шрока.[9]
Карбиновые комплексы металлов также демонстрируют большую транс эффект, где лиганд напротив карбина обычно лабильный.
Реакции и заявки
Металлические алкилидиновые комплексы в основном используются для специализированных реакций в лаборатории, в основном метатезис алкинов. Карбины с тройными мостиками иногда получают конденсацией терминальных комплексов карбина с другими металлами. Карбиновые комплексы переходных металлов обычно реагируют с Кислоты Льюиса у C-карбина. Эта реакция обычно заставляет их превращаться в карбеновые комплексы переходных металлов. В зависимости от заряда карбинового комплекса зависит, насколько хорошо комплекс будет реагировать с нуклеофил. А катионный Карбиновый комплекс будет реагировать с нуклеофилом прямо у С-карбина, в то время как нуклеофил не будет реагировать с С-карбином карбинового комплекса переходного металла, а вместо этого будет реагировать с металлом. Это происходит из-за НСМО комплексов, вызванных электронными орбиталями металла и С-карбина. Кроме того, чем выше энергия d-орбитали принадлежность к богатому электронами металлическому центру, тем выше энергия π-связей металл – углерод.[10] Это улучшает условия сцепления.
Некоторые комплексы карбина реагируют с электрофилы на C-карбин с последующей ассоциацией аниона. Чистая реакция дает карбеновый комплекс переходного металла:
- LпM≡CR + HX → Lп(X) M = CHR
Эти комплексы также могут подвергаться фотохимические реакции.
В некоторых карбиновых комплексах связывание лиганда карбина с карбонил наблюдается. Протонирование углерода карбина и превращение лиганда карбина в π-аллил.[11]
Аналог основной группы
Аналог основной группы карбина на основе серы был получен Зеппальтом с сотрудниками.[12] Соединение, трифтор (2,2,2-трифторэтилидин) -λ6-сульфуран, F3C – C≡SF3, полученный дегидрофторированием F3C – CH = SF4 или F3C – CH2–SF5, представляет собой нестабильный газ, который легко подвергается димеризации с образованием транс- (CF3) (SF3) C = C (CF3) (SF3) при температуре выше –50 ° C.
Рекомендации
- ^ Kim, Heesook P .; Анджеличи, Роберт Дж. (1987). Комплексы переходных металлов с концевыми карбиновыми лигандами. Adv. Органомет. Chem. Успехи металлоорганической химии. 27. С. 51–111. Дои:10.1016 / S0065-3055 (08) 60026-X. ISBN 9780120311279.
- ^ а б Эльшенбройх, К. (2006). Металлоорганические соединения. Вайнхайм: Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ Сейферт, Дитмар; Nestle, Mara O .; Халлгрен, Джон С. (1980). μ3-Алкилидин-Трис (трикарбонилкобальт): кластерные комплексы органокобальта. Неорг. Synth. Неорганические синтезы. 20. стр.224–226. Дои:10.1002 / 9780470132517.ch52. ISBN 9780470132517.
- ^ Коттон, Ф. Альберт; Швотцер, Вилли; Шамшоум, Эдвар С. (1985). «Дальнейшие исследования реакций гекса-трет-бутоксида дивольфрама с ацетиленами. Выделение и характеристика WO (OCMe3)4(THF), Вт3(OCMe3)5(μ-O) (μ-CC3ЧАС7) O2 и W (CPh) (OCMe3)3". Журнал металлоорганической химии. 296: 55–68. Дои:10.1016 / 0022-328X (85) 80338-7.
- ^ Спессард, Гэри О .; Мисслер, Гэри Л. (2015). Металлоорганическая химия (2-е изд.). С. 439–449. ISBN 9780199342679.
- ^ Крэбтри, Р. Х. (2014). Металлоорганическая химия переходных металлов. (6-е изд.). Нью-Йорк, штат Нью-Йорк: Wiley. С. 290–315. ISBN 9781118138076.
- ^ Крайсль, Ф. Р. Карбиновые комплексы переходных металлов. ISBN 9789401047289.
- ^ Фишер, Э. О .; Kreis, G .; Kreiter, C.G .; Muller, J .; Huttner, G .; Лоренц, Х. (1973). "транс-Галогено-алкил (арил) карбин-тетракарбонил-Komplexe von Chrom, Molybdän und Wolfram – Ein neuer Verbindungstyp mit Übergangsmetall-Kohlenstoff-Dreifachbindung "[транс-Галогеноалкил (арил) карбинтетракарбонильные комплексы хрома, молибдена и вольфрама - новый тип соединения с тройной связью переходный металл – углерод]. Энгью. Chem. 85 (14): 618–620. Дои:10.1002 / ange.19730851407.
- ^ Guggenberger, L.J .; Шрок, Р. Р. (1975). «Карбиновый комплекс тантала». Варенье. Chem. Soc. 97 (10): 2935. Дои:10.1021 / ja00843a072.
- ^ Mayr, A .; Бастос, К. М. (1992). Реакции связывания терминальных двусторонних π-лигандов и родственные реакции отщепления. Прог. Неорг. Chem. Прогресс неорганической химии. 40. С. 1–98. Дои:10.1002 / 9780470166413.ch1. ISBN 9780470166413.
- ^ Kingsbury, K. B .; Картер, Дж. Д .; МакЭлви-Уайт, Л. (1990). «Образование циклопентенона при фотоокислении циклопропилового (c-C3ЧАС5) карбиновый комплекс [(η5-C5ЧАС5) {P (OMe)3} (CO) W≡C (c-C3ЧАС5)]". J. Chem. Soc., Chem. Commun. 1990 (8): 624–625. Дои:10.1039 / C39900000624.
- ^ Поэттер, Бриджит; Сеппельт, Конрад; Саймон, Арндт; Петерс, Ева Мария; Хеттих, Бернхард (февраль 1985 г.). «Трифторид трифторэтилидинсеры, CF3C.tplbond.SF3 и его димер». Журнал Американского химического общества. 107 (4): 980–985. Дои:10.1021 / ja00290a038. ISSN 0002-7863.

