Дисульфид кремния - Silicon disulfide
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК сульфид кремния (IV) | |
| Другие имена дисульфид кремния | |
| Идентификаторы | |
3D модель (JSmol ) |
|
| ChemSpider | |
| ECHA InfoCard | 100.033.935 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| SiS2 | |
| Молярная масса | 92,218 г / моль |
| Внешность | Белые (иногда серая или коричневая) хвоя. Запах тухлых яиц во влажном воздухе. |
| Плотность | 1,853 г / см3 |
| Температура плавления | 1090 ° C (1,990 ° F, 1360 K) возгоны |
| Разлагается | |
| Структура | |
| Орторомбический, oI12 | |
| Ибам, №72[1] | |
| Тетраэдр | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другой анионы | диоксид кремния |
Другой катионы | сероуглерод дисульфид германия сульфид олова (IV) сульфид свинца (IV) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
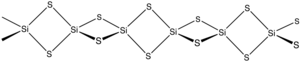
Сульфид кремния это неорганическое соединение с формулой SiS2. Нравиться диоксид кремния, этот материал полимерный, но он принимает одномерную структуру, совершенно отличную от обычной формы SiO2.
Синтез, структура и свойства
Материал образуется при нагревании кремния и серы или в результате реакции обмена между SiO.2 и Al2S3. Материал состоит из цепочек с разделенными кромками тетраэдры, Si (μ-S)2Si (мкСм)2, так далее.[2]
Как и другие соединения серы кремния (например, бис (триметилсилил) сульфид ) SiS2 легко гидролизуется с выделением H2С. в жидкости аммиак сообщается, что образует имид Si (NH)2 и NH4SH,[3] но недавний отчет идентифицировал кристаллический (NH4)2[SiS3(NH3)] · 2NH3 как продукт, содержащий тетраэдрический тиосиликатный анион, SiS3(NH3).[4]
Реакция с этанолом дает алкоксид тетраэтилортосиликат и H2С.[3] С объемным трет-бутанолом алкоголиз дает трис (трет-бутокси) силантиол:[5]
- 3 (CH3)3COH + SiS2 → [(CH3)3CO]3SiSH + H2S
Реакция с сульфид натрия, сульфид магния и сульфид алюминия дайте тиосиликаты.[3]
SiS2 Утверждается, что это происходит в некоторых межзвездных объектах.[6]
Рекомендации
- ^ Weiss, A .; Вайс, А. (1954). "Убер-кремнийхалкогенид. VI. Zur Kenntnis der faserigen Siliciumdioxyd-Modifikation". Zeitschrift für Anorganische und Allgemeine Chemie. 276 (1–2): 95–112. Дои:10.1002 / zaac.19542760110.
- ^ Холлеман, А. Ф .; Виберг, Э. (2001). Неорганическая химия. Сан-Диего: Academic Press. ISBN 0-12-352651-5. Ошибка печати в этой книге гласит, что rSiSi 214 пикометры, когда на самом деле это расстояние описывает rSiS.
- ^ а б c Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press. п. 359. ISBN 978-0-08-022057-4.
- ^ Мейер, Мартин; Корбер, Николаус (2009). «Первый тиосиликат из раствора: синтез и кристаллическая структура (NH4) 2 [SiS3 (NH3)] · 2NH3». Dalton Transactions (9): 1506. Дои:10.1039 / b818856d. ISSN 1477-9226.
- ^ Р. Пенкось, В. Войновски (1962). "Untersuchungen über die Alkoholyse des SiS2. II. Darstellung von Trialkoxysilanthiolen und Tetraalkoxycyclodisilthianen aus den tertiären Alkoholen". Z. anorg. allg. Chem. 318: 212-216. Дои:10.1002 / zaac.19623180310.
- ^ Гебель, Дж. Х. (1993). «SiS2 в околозвездных оболочках " (PDF). Астрономия и астрофизика. 278 (1): 226–230. Bibcode:1993A & A ... 278..226G.
| Этот неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |

