Пентафторид тантала - Tantalum pentafluoride
 | |
| Имена | |
|---|---|
| Другие имена пентафторид тантала | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.029.111 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| TaF5 | |
| Молярная масса | 275,95 г / моль |
| Внешность | белый порошок |
| Плотность | 4,74 г / см3, твердый |
| Температура плавления | 96,8 ° С (206,2 ° F, 369,9 К) |
| Точка кипения | 229,5 ° С (445,1 ° F, 502,6 К) |
| разлагается | |
| +795.0·10−6 см3/ моль | |
| Структура | |
| 0 D | |
| Опасности | |
| Главный опасности | HF источник |
Классификация ЕС (DSD) (устарело) | нет в списке |
| R-фразы (устарело) | 34 |
| S-фразы (устарело) | 26-27-28-36/37/39-45 |
| точка возгорания | Негорючий |
| Родственные соединения | |
Родственные соединения | TaCl5 NbCl5 WF6 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фторид тантала (V) это неорганическое соединение с формулой TaF5. Это одно из основных молекулярных соединений тантал. Это соединение, характерное для некоторых других пентафторидов, является летучим, но существует в виде олигомера в твердом состоянии.
Подготовка и состав
Его получают путем обработки металлического тантала фтор газ.[1] NbF5 готовится аналогично.
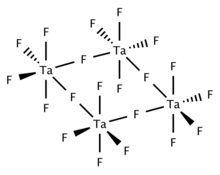
Твердый и расплавленный TaF5 тетрамерный, состоящий из четырех TaF6 центры, связанные через мостиковые центры фтора. Газообразный TaF5 принимает тригонально-пирамидальную структуру с D3ч симметрия.[2]
Реакции и производные
Тенденция TaF5 образование кластеров в твердом состоянии указывает на льюисовскую кислотность мономера. Действительно, TaF5 реагирует с источниками фтора с образованием ионов [TaF
6]−
, [TaF
7]2−
, и [TaF
8]3−
. С нейтральными основаниями Льюиса, такими как диэтиловый эфир TaF5 формы аддукты.
TaF
5 используется в сочетании с HF в качестве катализатора алкилирование из алканы и алкены и для протонирование из ароматный соединения. В TaF
5–HF система устойчива в восстанавливающих средах, в отличие от SbF
5–HF.[3] В присутствии фторида пентафторид тантала образует анионы [TaF
8]3−
, [TaF
7]2−
, или же [TaF
6]−
в зависимости от природы противоиона и концентрации HF. Высокие концентрации HF благоприятствуют гексафториду за счет образования HF−
2:[4]
- [TaF
7]2−
+ ВЧ ⇌ [TaF
6]−
+ HF−
2
Соли M3TaF8 были кристаллизованы. Вилка+ = M+, кристаллы состоят из [TaF
7]2−
анионы вместе с фторидом, который не координируется с Ta (V).[5] Форма+ = M+, кристаллы особенности [TaF
8]3−
.[6]
 Секция Na3TaF8 структура (Ta = бирюзовый, F = зеленый).
Секция Na3TaF8 структура (Ta = бирюзовый, F = зеленый).
Актуальность для разделения Ta и Nb
в Мариньяк процесса, Nb и Ta разделяются фракционной кристаллизацией K2TaF7 из растворов плавиковой кислоты. В этих условиях ниобий образует K2NbOF5, который более растворим, чем K2TaF7. Снижение K2TaF7 с натрием дает металлический Та.[7]
Рекомендации
- ^ Священник, Х. Ф. (1950). "Безводные фториды металлов" Неорганические синтезы ". 3: 171-183. Дои:10.1002 / 9780470132340.ch47. Цитировать журнал требует
| журнал =(помощь) - ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5.
- ^ Арпад Мольнар; Г. К. Сурья Пракаш; Жан Соммер (2009). Суперкислотная химия (2-е изд.). Wiley-Interscience. п. 60. ISBN 978-0-471-59668-4.
- ^ Анатолий Агулянский (2004). Химия фторидных соединений тантала и ниобия. Амстердам: Эльзевир. п.134. ISBN 0-444-51604-2.
- ^ Любомир Смрчок, Радован Черны, Мирослав Боча, Ивета Мацкова, Бланка Кубикова (2010). "K3TaF8 из лабораторных порошковых рентгеновских данных ". Acta Crystallographica C. 66 (2): pi16 – pi18. Дои:10.1107 / S0108270109055140. PMID 20124670.CS1 maint: использует параметр авторов (связь)
- ^ Langer, V .; Smrčok, L .; Боча, М. (2010). "Переопределение Na3TaF8". Acta Crystallographica C. 66 (9): pi85 – pi86. Дои:10.1107 / S0108270110030556. PMID 20814090.CS1 maint: использует параметр авторов (связь)
- ^ Клаус Андерссон, Карлхайнц Райхерт, Рюдигер Вольф «Тантал и соединения тантала» в Энциклопедии промышленной химии Ульманна 2002, Wiley-VCH. Вайнхайм. Дои:10.1002 / 14356007.a26_071

