Микроскопия сверхвысокого разрешения - Super-resolution microscopy
Похоже, что один из основных авторов этой статьи тесная связь со своим предметом. (Май 2020 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Микроскопия сверхвысокого разрешения представляет собой серию методов в оптических микроскопия которые позволяют таким изображениям иметь резолюции выше, чем налагаемые предел дифракции,[1][2] что связано с дифракция света.[3] Методы визуализации сверхвысокого разрешения основаны на ближнее поле (фотонно-туннельная микроскопия[4] а также те, которые используют Pendry Superlens и сканирующая оптическая микроскопия ближнего поля ) или на дальняя зона. Среди методов, которые полагаются на последний, есть те, которые улучшают разрешение лишь незначительно (примерно до двух раз) за дифракционный предел, например конфокальная микроскопия с закрытым отверстием или с помощью вычислительных методов, таких как деконволюция[5] или переназначение пикселей на основе детектора (например, повторная сканирующая микроскопия,[6] переназначение пикселей[7]), 4Pi микроскоп, а также технологии микроскопии со структурированным освещением, такие как SIM и СМИ.
Существует две основные группы методов микроскопии сверхвысокого разрешения в дальней зоне, которые могут улучшить разрешение в гораздо большем количестве:[8]
- Детерминированное сверхразрешение: излучатели, наиболее часто используемые в биологической микроскопии, флуорофоры, показывают нелинейный отклик на возбуждение, который можно использовать для улучшения разрешения. Такие методы включают STED, GSD, RESOLFT и SSIM.
- Стохастическое сверхразрешение: химическая сложность многих молекулярных источников света придает им сложное временное поведение, которое можно использовать для того, чтобы несколько соседних флуорофоров излучали свет в разное время и, таким образом, становились разрешимыми во времени. Эти методы включают Визуализация оптических флуктуаций сверхвысокого разрешения (SOFI) и все методы локализации одиночных молекул (SMLM), такие как SPDM, SPDMphymod, ЛАДОНЬ, FPALM, STORM и dSTORM.
8 октября 2014 г. Нобелевская премия по химии был присужден Эрик Бетциг, МЫ. Moerner и Стефан Ад за "разработку сверхрешенных флуоресцентная микроскопия ", который приносит"оптическая микроскопия в наноразмерность ".[9][10]
История
К 1978 году были разработаны первые теоретические идеи, чтобы сломать Предел Аббе, который требовал использования 4Pi микроскоп как конфокальный лазерно-сканирующий флуоресцентный микроскоп, в котором свет фокусируется со всех сторон в общий фокус, который используется для сканирования объекта посредством возбуждения «точка за точкой» в сочетании с обнаружением «точка за точкой».[11]
Некоторая из следующей информации была собрана (с разрешения) из обзора методов субдифракционной микроскопии в химическом блоге.[12][13]
В 1986 г. Охонин запатентовал оптический микроскоп сверхвысокого разрешения, основанный на вынужденном излучении.[14]
Методы сверхвысокого разрешения
Фотонная туннельная микроскопия (ФТМ)
Этот раздел пуст. Вы можете помочь добавляя к этому. (Май 2020 г.) |
Локальное улучшение / ANSOM / оптические наноантенны
Этот раздел пуст. Вы можете помочь добавляя к этому. (Май 2020 г.) |
Оптическая случайная микроскопия в ближнем поле (NORM)
Оптическая случайная микроскопия ближнего поля (NORM) - это метод получения оптического ближнего поля с помощью микроскопа дальнего поля путем наблюдения броуновского движения наночастиц в иммерсионной жидкости.[15][16]
NORM использует сканирование поверхности объекта стохастически движущимися наночастицами. Под микроскопом наночастицы выглядят как симметричные круглые пятна. Ширина пятна эквивалентна функция разброса точки (~ 250 нм) и определяется разрешением микроскопа. Поперечные координаты данной частицы можно оценить с точностью, намного превышающей разрешение микроскопа. Собирая информацию из множества кадров, можно составить карту распределения интенсивности ближнего поля по всему полю зрения микроскопа. По сравнению с NSOM и ANSOM этот метод не требует специального оборудования для позиционирования наконечника, имеет большое поле зрения и глубину резкости. Благодаря большому количеству сканирующих «сенсоров» можно получить изображение за более короткое время.
4Pi
А 4Pi микроскоп это лазерное сканирование флуоресцентный микроскоп с улучшенным осевой разрешающая способность. Типичное значение 500–700 нм может быть улучшено до 100–150 нм, что соответствует почти сферическому фокусному пятну с объемом в 5–7 раз меньшим, чем у стандартного. конфокальная микроскопия.
Улучшение разрешения достигается за счет использования двух противоположных линз объектива, обе из которых сфокусированы в одном и том же геометрическом месте. Кроме того, разница в длина оптического пути через каждую из двух линз объектива тщательно минимизируется. Благодаря этому молекулы, находящиеся в общей фокальной области обоих объективов, могут когерентно освещаться с обеих сторон, а отраженный или излучаемый свет может собираться когерентно, т.е. возможно когерентное наложение излучаемого света на детектор. В телесный угол который используется для освещения и обнаружения, увеличивается и приближается к идеальному случаю, когда образец освещается и обнаруживается со всех сторон одновременно.[17][18]
До сих пор наилучшее качество в микроскопе 4Pi достигалось в сочетании с STED-микроскопия в фиксированных камерах[19] и RESOLFT микроскопия с переключаемыми белками в живых клетках.[20]
Структурированная световая микроскопия (SIM)

Микроскопия со структурированным освещением (SIM) улучшает пространственное разрешение за счет сбора информации из частотного пространства за пределами наблюдаемой области. Этот процесс выполняется в обратном пространстве: преобразование Фурье (FT) изображения SI содержит наложенную дополнительную информацию из различных областей обратного пространства; с несколькими кадрами, в которых освещение несколько смещено фаза, можно вычислительно разделить и восстановить изображение FT, которое имеет гораздо больше информации о разрешении. Обратный FT возвращает восстановленное изображение в изображение сверхвысокого разрешения.
SIM-микроскопия потенциально может заменить электронная микроскопия как инструмент для некоторых медицинских диагнозов. К ним относятся диагностика заболеваний почек,[21] рак почки,[22] и болезни крови.[23]
Хотя термин «микроскопия со структурированным освещением» был изобретен другими в более поздние годы, Guerra (1995) впервые опубликовал результаты[24] в котором свет, сформированный решеткой с шагом 50 нм, освещает вторую решетку с шагом 50 нм, при этом решетки повернуты друг относительно друга на угол, необходимый для достижения увеличения. Хотя длина волны освещения составляла 650 нм, решетка 50 нм легко разрешалась. Это показало почти 5-кратное улучшение по сравнению с пределом разрешения Аббе 232 нм, который должен был быть наименьшим полученным для используемой числовой апертуры и длины волны. В дальнейшем развитии этой работы Герра показал, что сверхразрешенная боковая топография достигается за счет фазового сдвига исчезающего поля. Несколько патентов США[25] были выданы Герре индивидуально или вместе с коллегами и закреплены за Корпорация Polaroid. Лицензии на эту технологию были приобретены Dyer Energy Systems, Calimetrics Inc. и Nanoptek Corp. для использования этого метода сверхвысокого разрешения в оптическом хранении данных и микроскопии.
- Изображения ядра клеток и митотический этапы записаны с помощью 3D-SIM.

Сравнительная конфокальная микроскопия - 3D-SIM
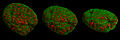
Ядро клетки в профаза с разных ракурсов

Два ядра мышиных клеток в профазе.

клетка мыши в телофаза
Пространственно-модулированное освещение (SMI)

Одна реализация структурированного освещения известна как пространственно-модулированное освещение (SMI). Как и стандартное структурированное освещение, метод SMI изменяет функция разброса точки (PSF) микроскопа подходящим способом. Однако в этом случае «само оптическое разрешение не улучшается»;[26] вместо этого используется структурированная подсветка для максимальной точности расстояние измерения флуоресцентных объектов, чтобы «сделать возможными измерения размеров при размерах молекул в несколько десятков нанометров».[26]
В Вертико СМИ Микроскоп обеспечивает структурированное освещение за счет использования одного или двух встречных мешающих лазерных лучей вдоль оси. Затем отображаемый объект перемещается с высокой точностью шагами через волновое поле или само волновое поле перемещается относительно объекта за счет фазовых сдвигов. Это приводит к улучшенному осевому размеру и разрешению по расстоянию.[26][27][28]
SMI можно комбинировать с другими технологиями сверхвысокого разрешения, например, с 3D LIMON или LSI-TIRF как полное внутреннее отражение интерферометр с латерально структурированным освещением (этот последний инструмент и методика, по сути, представляет собой туннельный микроскоп с фазовым сдвигом фотонов, в котором используется световой микроскоп полного внутреннего отражения со смещенным по фазе затухающим полем (Guerra, 1996)[25]). Этот метод SMI позволяет получать светооптические изображения распределения автофлуорофоров в срезах ткани глаза человека с непревзойденным ранее оптическим разрешением. Использование трех различных длин волн возбуждения (488, 568 и 647 нм) позволяет собирать спектральную информацию о сигнале автофлуоресценции. Это было использовано для исследования тканей глаза человека, пораженных: дегенерация желтого пятна.[29]
Детерминированные функциональные техники
Обратимые насыщаемые оптические флуоресцентные переходы (RESOLFT) микроскопия оптическая микроскопия с очень высоким разрешением, позволяющим отображать детали в образцах, которые невозможно отобразить с помощью обычных или конфокальная микроскопия. В рамках RESOLFT принципы STED-микроскопия[30][31] и GSD микроскопия обобщены. Кроме того, существуют методы с концепциями, отличными от RESOLFT или SSIM. Например, флуоресцентная микроскопия используя оптический И ворота собственностью азотно-вакансионный центр,[32] или сверхразрешение за счет вынужденного излучения теплового излучения (SETR), в котором используются собственные сверхлинейные особенности Излучение черного тела и расширяет понятие сверхвысокого разрешения за пределы микроскопии.[33]
Истощение вынужденных выбросов (STED)

Микроскопия истощения с вынужденным излучением (STED) использует два лазерных импульса, импульс возбуждения для возбуждения флуорофоры в их флуоресцентное состояние и импульс STED для снятия возбуждения флуорофоров с помощью стимулированное излучение.[14][34][35][36][37][38] На практике сначала применяется возбуждающий лазерный импульс, за которым вскоре следует импульс STED (также используется STED без импульсов с использованием лазеров непрерывного действия). Кроме того, импульс STED модифицируется таким образом, что он имеет пятно нулевой интенсивности, которое совпадает с фокусным пятном возбуждения. Из-за нелинейной зависимости скорости стимулированного излучения от интенсивности пучка STED все флуорофоры вокруг фокального пятна возбуждения будут в выключенном состоянии (основное состояние флуорофоров). Сканируя это фокусное пятно, можно получить изображение. В полная ширина на половине максимальной (FWHM) функции рассеяния точки (PSF) фокального пятна возбуждения теоретически можно сжать до произвольной ширины путем увеличения интенсивности STED-импульса в соответствии с уравнением (1).
- (1)
- где ∆r - поперечное разрешение, ∆ - полуширина дифракционно ограниченной PSF, яМаксимум - пиковая интенсивность STED-лазера, а - пороговая интенсивность, необходимая для достижения истощения насыщенных выбросов.
Главный недостаток STED, препятствующий его широкому использованию, состоит в сложности оборудования. С одной стороны, скорость получения изображения относительно низкая для больших полей обзора из-за необходимости сканировать образец, чтобы извлечь изображение. С другой стороны, это может быть очень быстро для меньшего поля зрения: были показаны записи до 80 кадров в секунду.[39][40] Из-за большого яs значение, связанное с STED, существует потребность в импульсе возбуждения высокой интенсивности, который может вызвать повреждение образца.
Истощение основного состояния (GSD)
Микроскопия истощения основного состояния (GSD-микроскопия) использует триплетное состояние флуорофора в выключенном состоянии и синглетном состоянии в активном состоянии, при этом лазер возбуждения используется для возбуждения флуорофоров на периферии синглетное состояние молекула в триплетное состояние. Это очень похоже на STED, где выключенное состояние является основным состоянием флуорофоров, поэтому уравнение (1) также применяется в этом случае. В значение меньше, чем в STED, что делает возможным получение изображений со сверхвысоким разрешением при гораздо меньшей интенсивности лазера. Однако по сравнению с STED флуорофоры, используемые в GSD, обычно менее фотостабильны; и насыщение триплетного состояния может быть труднее реализовать.[41]
Микроскопия с насыщенным структурированным освещением (SSIM)
Микроскопия с насыщенным структурированным освещением (SSIM) использует нелинейную зависимость скорости излучения флуорофоров от интенсивности возбуждающего лазера.[42] Применяя синусоидальный образец освещения[43] с пиковой интенсивностью, близкой к той, которая необходима для насыщения флуорофоров в их флуоресцентном состоянии, восстанавливаются муаровые полосы. Полосы содержат пространственную информацию высокого порядка, которая может быть извлечена вычислительными методами. Как только информация извлечена, извлекается изображение сверхвысокого разрешения.
SSIM требует многократного сдвига образца освещения, что эффективно ограничивает временное разрешение метода. Кроме того, существует потребность в очень фотостабильных флуорофорах из-за условий насыщения, которые вызывают радиационное повреждение образца и ограничивают возможные применения, для которых может использоваться SSIM.
Примеры этой микроскопии показаны в разделе Структурированная световая микроскопия (SIM): изображения ядер клеток и митотических стадий, записанные с помощью 3D-SIM Microscopy.
Стохастические функциональные методы
Локализационная микроскопия
Микроскопия локализации одиночных молекул (SMLM) суммирует все микроскопические методы, которые достигают сверхвысокого разрешения за счет изоляции излучателей и сопоставления их изображений с функцией рассеяния точки (PSF). Обычно ширина функции рассеяния точки (~ 250 нм) ограничивает разрешение. Однако, учитывая изолированный излучатель, можно определить его местоположение с точностью, ограниченной только его интенсивностью, в соответствии с уравнением (2).[44]
- (2)
- где Δloc - точность локализации, Δ - FWHM PSF, а N - количество собранных фотонов.
Этот процесс настройки может быть надежно выполнен только для изолированных эмиттеров (см. Деконволюция ), а интересные биологические образцы настолько плотно помечены эмиттерами, что подгонка невозможна, когда все эмиттеры активны одновременно. Методы SMLM решают эту дилемму, активируя одновременно только разреженное подмножество излучателей, очень точно локализуя эти несколько излучателей, деактивируя их и активируя другое подмножество.
Учитывая пикселизацию фона и камеры, и используя приближение Гаусса для функции рассеяния точки (Диск Эйри ) типичного микроскопа, теоретическое разрешение предложено Thompson et al.[45] и доработано Мортенсеном и др .:[46]
- куда
- * σ гауссовский стандартное отклонение расположения центров одной и той же молекулы при многократном измерении (например, кадры видео). (ед. м)
- * σPSF - стандартное отклонение по Гауссу функции рассеяния точки, FWHM после Эрнст Аббе уравнение d = λ / (2 Н. А.). (ед. м)
- * а - это размер каждого пикселя изображения. (ед. м)
- * Nсиг это количество фотонов в общей PSF по всем интересующим пикселям. (без единицы измерения)
- * Nbg среднее количество фоновых фотонов на пиксель (количество темных фотонов уже удалено), которое приблизительно равно квадрату гауссова стандартное отклонение из распределение Пуассона фоновый шум каждого пикселя с течением времени или стандартное отклонение всех пикселей только с фоновым шумом, σbg2. Чем больше σbg2, тем лучше приближение (например, подходит для σbg2 > 10, отлично подходит для σbg2 > 1000). (без единицы измерения)
- * Разрешение FWHM в ~ 2,355 раза больше гауссовой стандартное отклонение.
Обычно локализационная микроскопия проводится с помощью флуорофоров. Подходящие флуорофоры (например, для STORM) большую часть времени находятся в нефлуоресцентном темном состоянии и активируются стохастически, обычно с помощью возбуждающего лазера низкой интенсивности. Считывающий лазер стимулирует флуоресценцию и обесцвечивает или фотопереключает флуорофоры обратно в темное состояние, обычно в течение 10–100 мс. При накоплении точек для визуализации в наноразмерной топографии (PAINT) флуорофоры не флуоресцируют до связывания и флуоресцируют после. Фотоны, испускаемые во время флуоресцентной фазы, собираются камерой, и полученное изображение флуорофора (которое искажается PSF) может быть подогнано с очень высокой точностью, даже порядка нескольких ангстрем.[47] Повторение процесса несколько тысяч раз гарантирует, что все флуорофоры могут пройти через яркое состояние и будут записаны. Затем компьютер восстанавливает изображение со сверхвысоким разрешением.
Желательными характеристиками флуорофоров, используемых в этих методах, для максимального увеличения разрешения является то, что они должны быть яркими. То есть у них должен быть высокий коэффициент экстинкции и высокий квантовый выход. Они также должны иметь высокий коэффициент контрастности (соотношение между количеством фотонов, испускаемых в светлом состоянии, и количеством фотонов, испускаемых в темном состоянии). Также желателен образец с плотной маркировкой, в соответствии с Критерии Найквиста.
Множество методов локализационной микроскопии в основном различаются типом используемых флуорофоров.
Спектральная прецизионная дистанционная микроскопия (SPDM)

Одиночный крошечный источник света может быть обнаружен намного лучше, чем обычно позволяет разрешение микроскопа: хотя свет будет давать размытое пятно, можно использовать компьютерные алгоритмы для точного расчета центра размытого пятна с учетом функция разброса точки микроскопа, шумовых свойств детектора и т. д. Однако этот подход не работает, когда слишком много источников находится близко друг к другу: тогда все источники размываются вместе.
Спектральная прецизионная дистанционная микроскопия (SPDM) - это семейство методов локализации в флуоресцентная микроскопия который позволяет обойти проблему наличия множества источников, измеряя всего несколько источников за раз, так что каждый источник «оптически изолирован» от других (то есть отделен более чем на разрешение микроскопа, обычно ~ 200-250 нм) ,[48][49][50] если исследуемые частицы имеют разные спектральные сигнатуры, так что можно наблюдать за светом всего нескольких молекул одновременно, используя соответствующие источники света и фильтры. Таким образом достигается эффективное оптическое разрешение в несколько раз лучше, чем обычное оптическое разрешение, которое представлено полушириной основного максимума функции эффективного точечного изображения.[48]
Структурное разрешение, достигаемое с помощью SPDM, может быть выражено через наименьшее измеряемое расстояние между двумя точечными частицами с разными спектральными характеристиками («топологическое разрешение»). Моделирование показало, что при подходящих условиях, касающихся точности локализации, плотности частиц и т. Д., «Топологическое разрешение» соответствует «космическая частота "что, с точки зрения классического определения, эквивалентно значительно улучшенному оптическому разрешению. Молекулы также можно различать еще более тонкими способами на основе флуоресцентное время жизни и другие техники.[48]
Важное применение - исследование генома (изучение функциональной организации геном ). Еще одна важная область применения - это исследование структуры мембран.
SPDMphymod

Микроскопия локализации для многих стандартных флуоресцентных красителей, таких как GFP, Красители Alexa, и флуоресцеин молекул возможно при наличии определенных фотофизических условий. С этим так называемым физически модифицируемые флуорофоры (SPDMphymod) технологии, для создания наноизображений достаточно одной длины волны лазера подходящей интенсивности.[51] в отличие от других технологий локализационной микроскопии, которые требуют двух длин волн лазера, когда используются специальные фотопереключаемые / фотоактивируемые флуоресцентные молекулы. Еще одним примером использования SPDMphymod является анализ Вирус табачной мозаики (TMV) частицы[52] или изучение вирус-клеточное взаимодействие.[53][54]
Основываясь на синглетно-триплетных переходах состояний, для SPDMphymod критически важно, чтобы этот процесс продолжался и приводил к тому, что отдельная молекула сначала переходит в очень долгоживущее обратимое темное состояние (с периодом полураспада до нескольких секунд) от при этом он возвращается в флуоресцентное состояние, излучающее множество фотонов в течение нескольких миллисекунд, прежде чем он возвращается в очень долгоживущее, так называемое необратимое темное состояние. В микроскопии SPDMphymod используются флуоресцентные молекулы, которые излучают одинаковую спектральную частоту света, но с разными спектральными характеристиками, основанными на характеристиках мигания. Комбинируя две тысячи изображений одной и той же клетки, можно, используя прецизионные лазерные оптические измерения, записывать изображения локализации со значительно улучшенным оптическим разрешением.[55]
Стандартные флуоресцентные красители уже успешно используются с SPDMphymod технологии GFP, RFP, YFP, Алекса 488, Алекса 568, Алекса 647, Cy2, Cy3, Atto 488 и флуоресцеин.
Криогенная оптическая локализация в 3D (COLD)

Криогенная оптическая локализация в 3D (COLD) - это метод, который позволяет локализовать несколько флуоресцентных сайтов в пределах одной биомолекулы малого и среднего размера с разрешением по шкале Ангстрема.[47] Точность локализации в этом подходе повышается, поскольку более медленная фотохимия при низких температурах приводит к большему количеству фотонов, которые могут испускаться каждым флуорофором до фотообесцвечивания.[56][57] В результате криогенная микроскопия стохастической локализации достигает субмолекулярного разрешения, необходимого для определения трехмерных положений нескольких флуорофоров, прикрепленных к небольшому белку. Используя алгоритмы, известные из электронной микроскопии, двумерные проекции флуорофоров реконструируются в трехмерную конфигурацию. COLD доводит флуоресцентную микроскопию до своего фундаментального предела, в зависимости от размера этикетки. Этот метод также можно комбинировать с другими методами структурной биологии, такими как рентгеновская кристаллография, магнитно-резонансная спектроскопия и электронная микроскопия, для получения ценной дополнительной информации и специфичности.
Микроскопия локализации, активируемая связыванием (БАЛМ)

Микроскопия локализации, активируемой связыванием (BALM) - это общая концепция микроскопии локализации одной молекулы (SMLM): визуализация ДНК-связывающих красителей с суперразрешением, основанная на изменении свойств ДНК и красителя.[58] Путем тщательной корректировки химической среды, ведущей к локальному обратимому плавлению ДНК и контролю гибридизации над сигналом флуоресценции, могут быть введены молекулы ДНК-связывающего красителя. Интеркалирующие и связывающие малые бороздки ДНК-красители могут использоваться для регистрации и оптического выделения только нескольких сигналов ДНК-связывающих красителей за раз. БАЛЬЗАМ с помощью флуктуаций структуры ДНК (fBALM) был использован для определения различий в наноразмерной архитектуре ядер с ожидаемым структурным разрешением примерно 50 нм. Визуализация наноструктуры хроматина с помощью микроскопии локализации, активируемой связыванием, на основе флуктуаций структуры ДНК.[59] В последнее время наблюдалось значительное увеличение квантового выхода флуоресценции NIAD-4 при связывании с амилоид был использован для БАЛЬЗАМ-визуализации амилоидных фибрилл[60] и олигомеры.[61]
ШТОРМ, ЛАДОНИ и ЛПАЛЬМА
Стохастическая оптическая реконструкционная микроскопия (STORM), микроскопия фотоактивированной локализации (PALM) и флуоресцентная микроскопия локализации фотоактивации (FPALM) - это методы визуализации со сверхвысоким разрешением, которые используют последовательную активацию и локализацию с временным разрешением фотопереключаемых флуорофоров для создания изображений с высоким разрешением. Во время визуализации только оптически разрешимое подмножество флуорофоров активируется до флуоресцентного состояния в любой данный момент, так что положение каждого флуорофора может быть определено с высокой точностью путем нахождения положений центроидов изображений отдельных молекул конкретного флуорофора. Одна подгруппа флуорофоров впоследствии дезактивируется, а другая подгруппа активируется и отображается. Итерация этого процесса позволяет локализовать множество флуорофоров и построить изображение сверхвысокого разрешения на основе данных изображения.
Эти три метода были опубликованы независимо друг от друга за короткий период времени, и их принципы идентичны. STORM был первоначально описан с использованием красителей Cy5 и Cy3, прикрепленных к нуклеиновым кислотам или белкам,[62] тогда как PALM и FPALM были описаны с использованием светопереключаемых флуоресцентных белков.[63][64] В принципе, можно использовать любой светопереключаемый флуорофор, и STORM был продемонстрирован с множеством различных зондов и стратегий мечения. Использование стохастического фотопереключения отдельных флуорофоров, таких как Cy5,[65] ШТОРМ может быть выполнен с помощью одного источника лазерного возбуждения красного цвета. Красный лазер переключает флуорофор Cy5 в темное состояние за счет образования аддукта.[66][67] и впоследствии возвращает молекулу в флуоресцентное состояние. Многие другие красители также использовались со STORM.[68][69][70][71][72][73]
Помимо отдельных флуорофоров, пары красителей, состоящие из флуорофора-активатора (например, Alexa 405, Cy2 или Cy3) и светопереключаемого репортерного красителя (например, Cy5, Alexa 647, Cy5.5 или Cy7), могут использоваться с STORM. .[62][74][75] В этой схеме активаторный флуорофор при возбуждении вблизи его максимума поглощения служит для реактивации фотопереключаемого красителя в флуоресцентное состояние. Многоцветная визуализация была выполнена с использованием различных длин волн активации для различения пар красителей в зависимости от используемого флуорофора-активатора,[74][75][76] или с использованием спектрально различных фотопереключаемых флуорофоров с активаторами флуорофоров или без них.[68][77][78] Также можно использовать светопереключаемые флуоресцентные белки.[63][64][78][79] Высокоспецифичное мечение биологических структур фотопереключаемыми зондами было достигнуто с помощью окрашивания антителами,[74][75][76][80] прямая конъюгация белков,[81] и генетическое кодирование.[63][64][78][79]
STORM также был расширен до трехмерного изображения с использованием оптического астигматизма, в котором эллиптическая форма функции рассеяния точки кодирует положения x, y и z для образцов толщиной до нескольких микрометров,[75][80] и был продемонстрирован в живых клетках.[78] На сегодняшний день пространственное разрешение, достигаемое с помощью этого метода, составляет ~ 20 нм в поперечных размерах и ~ 50 нм в аксиальных размерах; а временное разрешение составляет всего 0,1–0,33 с.[нужна цитата ]
Накопление точек для построения изображений в наноразмерной топографии (PAINT)
Накопление точек для визуализации в наноразмерной топографии (PAINT) - это метод локализации одной молекулы, который обеспечивает стохастическую флуоресценцию одной молекулы за счет молекулярной адсорбции / поглощения и фотообесцвечивания / десорбции.[82][83] Первый использованный краситель был Нильский красный который не флуоресцирует в водном растворе, но флуоресцирует при введении в гидрофобную среду, такую как мицеллы или стенки живых клеток. Таким образом, концентрация красителя сохраняется небольшой на наномолярном уровне, так что молекула сорбция скорость к дифракционно-ограниченной области находится в миллисекундной области. Стохастическое связывание молекул (зондов) одного красителя с иммобилизованной мишенью может быть пространственно и временно разрешено с помощью типичного широкопольного флуоресцентного микроскопа. Каждый краситель подвергается фотообесцвечиванию, чтобы вернуть поле в темное состояние, чтобы следующий краситель мог связываться и наблюдаться. Преимущество этого метода по сравнению с другими стохастическими методами состоит в том, что помимо получения сверхразрешенного изображения фиксированной мишени, он может измерять динамическую кинетику связывания диффундирующих молекул зонда в растворе с мишенью.[84][83]
Сочетание техники трехмерного сверхвысокого разрешения (например, функция рассеяния точки двойной спирали, разработанная в группе Мёрнера), фотоактивированных красителей, активной перемежаемости, зависящей от мощности, и накопления точек для построения изображений в наноразмерной топографии, SPRAIPAINT (SPRAI = сверхразрешение от PoweR- зависимая активная перемежаемость[85]) может суперразрушать стенки живых клеток.[86] PAINT работает, поддерживая баланс между скоростью адсорбции / абсорбции красителя и фотообесцвечивания / десорбции. Этот баланс можно оценить с помощью статистических принципов.[87] В адсорбция или же поглощение скорость попадания разбавленного растворенного вещества на поверхность или границу раздела в газовом или жидком растворе может быть рассчитана с использованием Законы диффузии Фика. Скорость фотообесцвечивания / десорбции может быть измерена для заданных условий раствора и плотности мощности освещения.
DNA-PAINT был дополнительно расширен для использования обычных красителей, где динамическое связывание и расцепление меченого красителем ДНК-зонда с фиксированным ДНК оригами используется для получения стохастических изображений одиночных молекул.[88][89] DNA-PAINT больше не ограничивается красителями, чувствительными к окружающей среде, и может измерять как адсорбцию, так и кинетику десорбции зондов на мишень. В методе используется эффект размытия движущихся красок камеры. Когда обычный краситель рассеивается в растворе, его изображение на типичной ПЗС-камере размывается из-за его относительно высокой скорости и относительно длительного времени экспозиции камеры, что способствует возникновению фона флуоресценции. Однако, когда он связывается с фиксированной целью, краситель перестает двигаться; и может быть получен четкий ввод в функцию рассеяния точки.
Термин для этого метода - mbPAINT («mb» означает Размытость ).[90] Когда флуоресцентный микроскоп полного внутреннего отражения (TIRF) используется для визуализации, глубина возбуждения ограничена ~ 100 нм от подложки, что дополнительно снижает фон флуоресценции от размытых красителей рядом с подложкой и фон в объеме раствора. Для mbPAINT можно использовать очень яркие красители, которые дают типичное однокадровое пространственное разрешение ~ 20 нм и кинетическое временное разрешение для одной молекулы ~ 20 мс при относительно умеренных интенсивностях фотовозбуждения, что полезно при изучении молекулярного разделения отдельных белков.[91]
Временное разрешение было дополнительно улучшено (в 20 раз) с использованием вращающейся фазовой маски, помещенной в плоскость Фурье во время сбора данных, и разрешения искаженной функции рассеяния точки, которая содержит временную информацию. Метод получил название Super Temporal-Resolved Microscopy (STReM).[92]
Локализационная микроскопия без этикеток

Оптическое разрешение клеточных структур в диапазоне около 50 нм может быть достигнуто даже в клетках без меток с помощью локализационной микроскопии. SPDM.
Используя две разные длины волн лазера, SPDM выявляет клеточные объекты, которые не обнаруживаются в обычных условиях флуоресцентной визуализации с широким полем, помимо существенного улучшения разрешения автофлуоресцентных структур.
В качестве контроля положения обнаруженных объектов на изображении локализации совпадают с положениями на изображении в светлом поле.[93]
Микроскопия сверхвысокого разрешения без меток также была продемонстрирована с использованием флуктуаций сигнала комбинационного рассеяния света с усиленной поверхностью на очень однородной плазмонной метаповерхности.[94]
Микроскопия прямой стохастической оптической реконструкции (dSTORM)
dSTORM использует фотопереключение одного флуорофора. В dSTORM флуорофоры встроены в восстанавливающую и окислительную буферную систему (ROXS), и флуоресценция возбуждается. Иногда, стохастически, флуорофор входит в триплет или какое-либо другое темное состояние, чувствительное к степени окисления буфера, из которого они могут флуоресцировать, чтобы можно было регистрировать положения отдельных молекул.[95] Разработка метода dSTORM происходила в 3 независимых лабораториях примерно в одно время и называлась также «микроскопией обратимого фотообесцвечивания» (RPM).[96] «микроскопия истощения основного состояния с последующим возвращением отдельных молекул» (GSDIM),[97] as well as the now generally accepted moniker dSTORM.[98]
Software for localization microscopy
Localization microscopy depends heavily on software that can precisely fit the point spread function (PSF) to millions of images of active fluorophores within a few minutes.[99] Since the classical analysis methods and software suites used in the natural sciences are too slow to computationally solve these problems, often taking hours of computation for processing data measured in minutes, specialised software programs have been developed. Many of these localization software packages are open-source; they are listed at SMLM Software Benchmark.[100] Once molecule positions have been determined, the locations need to be displayed and several algorithms for display have been developed.[101]
Визуализация оптических флуктуаций сверхвысокого разрешения (SOFI)
It is possible to circumvent the need for PSF fitting inherent in single molecule localization microscopy (SMLM) by directly computing the temporal autocorrelation of pixels. This technique is called super-resolution optical fluctuation imaging (SOFI) and has been shown to be more precise than SMLM when the density of concurrently active fluorophores is very high.
Omnipresent Localization Microscopy (OLM)
Omnipresent Localisation Microscopy (OLM) is an extension of Single Molecule Microscopy (SMLM) techniques that allow high-density single molecule imaging with an incoherent light source (such as a mercury-arc lamp) and a conventional epifluorescence microscope setup.[102] A short burst of deep-blue excitation (with a 350-380 nm, instead of a 405 nm, laser) enables a prolonged reactivation of molecules, for a resolution of 90 nm on test specimens. Finally, correlative STED and SMLM imaging can be performed on the same biological sample using a simple imaging medium, which can provide a basis for a further enhanced resolution. These findings can democratize superresolution imaging and help any scientist to generate high-density single-molecule images even with a limited budget.
Combination of techniques
3D light microscopical nanosizing (LIMON) microscopy

Light MicrOscopical Nanosizing microscopy (3D LIMON) images, using the Вертико СМИ microscope, are made possible by the combination of СМИ и SPDM, whereby first the SMI, and then the SPDM, process is applied.
В СМИ process determines the center of particles and their spread in the direction of the microscope axis. While the center of particles/molecules can be determined with a precision of 1–2 nm, the spread around this point can be determined down to an axial diameter of approximately 30–40 nm.
Впоследствии боковой position of the individual particle/molecule is determined using SPDM, achieving a precision of a few nanometers.[103]
As a biological application in the 3D dual color mode, the spatial arrangements of Her2 / neu и Ее3 clusters was achieved. The positions in all three directions of the protein clusters could be determined with an accuracy of about 25 nm.[104]
Integrated correlative light and electron microscopy
Combining a super-resolution microscope with an electron microscope enables the visualization of contextual information, with the labelling provided by fluorescence markers. This overcomes the problem of the black backdrop that the researcher is left with when using only a light microscope. In an integrated system, the sample is measured by both microscopes simultaneously.[105]
Enhancing of techniques using neural networks
Recently, owing to advancements in artificial intelligence computing, deep-learning neural networks have been used for super-resolution enhancing of optical-microscope photographic images,[106] from 40x to 100x,[107] from 20x with an optical microscope to 1500x, comparable to a scanning electron microscope, via a neural lens,[108] and with positron-emission tomography and fluorescence microscopy.[109]
Смотрите также
- Multifocal plane microscopy (MUM)
- Stimulated emission depletion microscope (STED)
- Фотоактивированная локализационная микроскопия (ЛАДОНЬ)
- Stochastic optical reconstruction microscopy (STORM)
- Деконволюция
- Фотоактивируемые датчики
- Correlative Light-Electron Microscopy
Рекомендации
- ^ Neice A (2010). Methods and Limitations of Subwavelength Imaging. Достижения в области визуализации и электронной физики. 163. С. 117–140. Дои:10.1016/S1076-5670(10)63003-0. ISBN 978-0-12-381314-5.
- ^ Stockert JC, Blázquez-Castro A (2017). "Chapter 20 Super-resolution Microscopy". Флуоресцентная микроскопия в науках о жизни. Издательство Bentham Science. pp. 687–711. ISBN 978-1-68108-519-7. Получено 24 декабря 2017.
- ^ Abbe E (1873). "Beitrage zur Theorie des Mikroskops und der mikroskopischen Wahrmehmung" (PDF). Archiv für mikroskopische Anatomie (на немецком). 9: 413–420. Дои:10.1007/BF02956173.
- ^ Guerra JM (September 1990). "Photon tunneling microscopy". Прикладная оптика. 29 (26): 3741–52. Bibcode:1990ApOpt..29.3741G. Дои:10.1364/AO.29.003741. PMID 20567479.
- ^ Agard DA, Sedat JW (April 1983). "Three-dimensional architecture of a polytene nucleus". Природа. 302 (5910): 676–81. Bibcode:1983Natur.302..676A. Дои:10.1038/302676a0. PMID 6403872.
- ^ De Luca GM, Breedijk RM, Brandt RA, Zeelenberg CH, de Jong BE, Timmermans W, et al. (1 November 2013). "Re-scan confocal microscopy: scanning twice for better resolution". Биомедицинская оптика Экспресс. 4 (11): 2644–56. Дои:10.1364/BOE.4.002644. ЧВК 3829557. PMID 24298422.
- ^ Sheppard CJ, Mehta SB, Heintzmann R (August 2013). "Superresolution by image scanning microscopy using pixel reassignment". Письма об оптике. 38 (15): 2889–92. Bibcode:2013OptL...38.2889S. Дои:10.1364/OL.38.002889. HDL:1912/6208. PMID 23903171.
- ^ SPIE (March 2015). "W.E. Moerner plenary presentation: Single-molecule spectroscopy, imaging, and photocontrol -- foundations for super-resolution microscopy". Отдел новостей SPIE. Дои:10.1117/2.3201503.17.
- ^ Ritter K, Rising M (8 October 2014). «2 американца, 1 немец получили Нобелевскую премию по химии». Ассошиэйтед Пресс. Получено 8 октября 2014.
- ^ Chang K (8 October 2014). «2 американца и немец удостоены Нобелевской премии по химии». Нью-Йорк Таймс. Получено 8 октября 2014.
- ^ Cremer C, Cremer T (September 1978). "Considerations on a laser-scanning-microscope with high resolution and depth of field". Microscopica Acta. 81 (1): 31–44. PMID 713859.
- ^ Часть I и Часть II
- ^ Moerner WE (2006). "Single-molecule mountains yield nanoscale cell images". Методы природы. 3 (10): 781–782. Дои:10.1038/nmeth1006-781. ЧВК 2663419. PMID 16990808.
- ^ а б В.А. Okhonin, Method of investigating specimen microstructure, Patent SU 1374922, priority date 10 April 1986, Published on July 30, 1991, Soviet Patents Abstracts, Section EI, Week 9218, Derwent Publications Ltd., London, GB; Class S03, p. 4. Cited by patents US 5394268 A (1993) и US RE38307 E1 (1995). От английский перевод: "The essence of the invention is as follows. Luminescence is excited in a sample placed in the field of several standing light waves, which cause luminescence quenching because of stimulated transitions...".
- ^ US patent 2009/0116,024, priority date 7 April 2006: J. V. Mikliaev, S. A. Asselborn Method for obtaining a high resolution image
- ^ Miklyaev YV, Asselborn SA, Zaytsev KA, Darscht MY (2014). "Superresolution microscopy in far-field by near-field optical random mapping nanoscopy". Appl. Phys. Латыш. 105 (11): 113103(1–4). Bibcode:2014ApPhL.105k3103M. Дои:10.1063/1.4895922.
- ^ Cremer C, Cremer T (1978). «Соображения по поводу лазерного сканирующего микроскопа с высоким разрешением и глубиной резкости» (PDF). M1Croscopica Acta. 81 (1): 31–44. PMID 713859.
- ^ Hell SW, Stelzer EH, Lindek S, Cremer C (February 1994). "Confocal microscopy with an increased detection aperture: type-B 4Pi confocal microscopy". Письма об оптике. 19 (3): 222. Bibcode:1994OptL...19..222H. CiteSeerX 10.1.1.501.598. Дои:10.1364/OL.19.000222. PMID 19829598.
- ^ Schmidt R, Wurm CA, Jakobs S, Engelhardt J, Egner A, Hell SW (June 2008). "Spherical nanosized focal spot unravels the interior of cells". Методы природы. 5 (6): 539–44. Дои:10.1038/nmeth.1214. HDL:11858/00-001M-0000-0012-DBBB-8. PMID 18488034.
- ^ Böhm U, Hell SW, Schmidt R (February 2016). "4Pi-RESOLFT nanoscopy". Nature Communications. 7 (10504): 10504. Bibcode:2016NatCo...710504B. Дои:10.1038/ncomms10504. ЧВК 4740410. PMID 26833381.
- ^ Pullman JM, Nylk J, Campbell EC, Gunn-Moore FJ, Prystowsky MB, Dholakia K (February 2016). "Visualization of podocyte substructure with structured illumination microscopy (SIM): a new approach to nephrotic disease". Биомедицинская оптика Экспресс. 7 (2): 302–11. Дои:10.1364/BOE.7.000302. ЧВК 4771450. PMID 26977341.
- ^ Liu J, Wang M, Tulman D, Mandava SH, Elfer KN, Gabrielson A, et al. (Декабрь 2016 г.). "Nondestructive Diagnosis of Kidney Cancer on 18-gauge Core Needle Renal Biopsy Using Dual-color Fluorescence Structured Illumination Microscopy". Урология. 98: 195–199. Дои:10.1016/j.urology.2016.08.036. ЧВК 5553202. PMID 27597632.
- ^ Westmoreland D, Shaw M, Grimes W, Metcalf DJ, Burden JJ, Gomez K, et al. (Апрель 2016 г.). "Super-resolution microscopy as a potential approach to diagnosis of platelet granule disorders". Журнал тромбоза и гемостаза. 14 (4): 839–49. Дои:10.1111/jth.13269. ЧВК 4982064. PMID 26806224.
- ^ Guerra JM (1995). "Super-resolution through diffraction-born evanescent waves". Appl. Phys. Lett. 66 (26): 3555. Bibcode:1995ApPhL..66.3555G. Дои:10.1063/1.113814.
- ^ а б U.S. Patent Number 5,774,221, Apparatus and methods for providing phase-controlled evanescent illumination (1996); Number 5,666,197, Apparatus and methods employing phase control and analysis of evanescent for imaging and metrology of subwavelength lateral surface topography (1996), и Number 5,715,059, Dark field, photon tunneling systems and methods (1996)
- ^ а б c Reymann J, Baddeley D, Gunkel M, Lemmer P, Stadter W, Jegou T, et al. (2008). "High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy". Хромосомные исследования. 16 (3): 367–82. Дои:10.1007/s10577-008-1238-2. PMID 18461478.
- ^ Heintzmann R, Cremer C (1999). "Lateral modulated excitation microscopy: Improvement of resolution by using a diffraction grating". Proc. SPIE. Optical Biopsies and Microscopic Techniques III. 3568: 185–196. Bibcode:1999SPIE.3568..185H. Дои:10.1117/12.336833.
- ^ US patent 7,342,717, filed 10 July 1997: Christoph Cremer, Michael Hausmann, Joachim Bradl, Bernhard Schneider Wave field microscope with detection point spread function
- ^ Best G, Amberger R, Baddeley D, Ach T, Dithmar S, Heintzmann R, Cremer C (June 2011). "Structured illumination microscopy of autofluorescent aggregations in human tissue". Микрон. 42 (4): 330–5. Дои:10.1016/j.micron.2010.06.016. PMID 20926302.
- ^ Hell SW, Wichmann J (June 1994). "Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy". Письма об оптике. 19 (11): 780–2. Bibcode:1994OptL...19..780H. Дои:10.1364/OL.19.000780. PMID 19844443.
- ^ Klar TA, Hell SW (July 1999). "Subdiffraction resolution in far-field fluorescence microscopy". Письма об оптике. 24 (14): 954–6. Bibcode:1999OptL...24..954K. Дои:10.1364/OL.24.000954. PMID 18073907.
- ^ Kwon J, Lim Y, Jung J, Kim SK (June 2012). "New sub-diffraction-limit microscopy technique: dual-point illumination AND-gate microscopy on nanodiamonds (DIAMOND)". Оптика Экспресс. 20 (12): 13347–56. Bibcode:2012OExpr..2013347K. Дои:10.1364/OE.20.013347. PMID 22714363.
- ^ Graciani G, Amblard F (December 2019). "Super-resolution provided by the arbitrarily strong superlinearity of the blackbody radiation". Nature Communications. 10 (1): 5761. Bibcode:2019NatCo..10.5761G. Дои:10.1038/s41467-019-13780-4. ЧВК 6917796. PMID 31848354.
- ^ Fernández-Suárez M, Ting AY (December 2008). "Fluorescent probes for super-resolution imaging in living cells". Обзоры природы Молекулярная клеточная биология. 9 (12): 929–43. Дои:10.1038/nrm2531. PMID 19002208.
- ^ Hell SW (May 2007). "Far-field optical nanoscopy". Наука. 316 (5828): 1153–8. Bibcode:2007Sci...316.1153H. Дои:10.1126/science.1137395. PMID 17525330.
- ^ Huang B, Bates M, Zhuang X (2009). "Super-resolution fluorescence microscopy". Ежегодный обзор биохимии. 78: 993–1016. Дои:10.1146/annurev.biochem.77.061906.092014. ЧВК 2835776. PMID 19489737.
- ^ Willig KI, Rizzoli SO, Westphal V, Jahn R, Hell SW (April 2006). "STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis". Природа. 440 (7086): 935–9. Bibcode:2006Natur.440..935W. Дои:10.1038/nature04592. PMID 16612384.
- ^ Patterson GH (October 2009). "Fluorescence microscopy below the diffraction limit". Семинары по клеточной биологии и биологии развития. 20 (8): 886–93. Дои:10.1016/j.semcdb.2009.08.006. ЧВК 2784032. PMID 19698798.
- ^ Westphal V, Lauterbach MA, Di Nicola A, Hell SW (2007). "Dynamic far-field nanoscopy". Новый журнал физики. 9 (12): 435. Bibcode:2007NJPh....9..435W. Дои:10.1088/1367-2630/9/12/435.
- ^ Westphal V, Rizzoli SO, Lauterbach MA, Kamin D, Jahn R, Hell SW (April 2008). "Video-rate far-field optical nanoscopy dissects synaptic vesicle movement". Наука. 320 (5873): 246–9. Bibcode:2008Sci...320..246W. Дои:10.1126/science.1154228. PMID 18292304.
- ^ Chmyrov A, Arden-Jacob J, Zilles A, Drexhage KH, Widengren J (November 2008). "Characterization of new fluorescent labels for ultra-high resolution microscopy". Фотохимические и фотобиологические науки. 7 (11): 1378–85. Дои:10.1039/B810991P. PMID 18958325.
- ^ Gustafsson MG (September 2005). "Nonlinear structured-illumination microscopy: wide-field fluorescence imaging with theoretically unlimited resolution". Труды Национальной академии наук Соединенных Штатов Америки. 102 (37): 13081–6. Bibcode:2005PNAS..10213081G. Дои:10.1073/pnas.0406877102. ЧВК 1201569. PMID 16141335.
- ^ Guerra JM (1995). "Super-resolution through diffraction-born evanescent waves". Appl. Phys. Lett. 66 (26): 3555–3557. Bibcode:1995ApPhL..66.3555G. Дои:10.1063/1.113814.
- ^ von Diezmann A, Shechtman Y, Moerner WE (June 2017). "Three-Dimensional Localization of Single Molecules for Super-Resolution Imaging and Single-Particle Tracking". Химические обзоры. 117 (11): 7244–7275. Дои:10.1021/acs.chemrev.6b00629. ЧВК 5471132. PMID 28151646.
- ^ Thompson RE, Larson DR, Webb WW (May 2002). "Precise nanometer localization analysis for individual fluorescent probes". Биофизический журнал. 82 (5): 2775–83. Bibcode:2002BpJ....82.2775T. Дои:10.1016/S0006-3495(02)75618-X. ЧВК 1302065. PMID 11964263.
- ^ Mortensen KI, Churchman LS, Spudich JA, Flyvbjerg H (May 2010). "Optimized localization analysis for single-molecule tracking and super-resolution microscopy". Методы природы. 7 (5): 377–81. Дои:10.1038/nmeth.1447. ЧВК 3127582. PMID 20364147.
- ^ а б Weisenburger S, Boening D, Schomburg B, Giller K, Becker S, Griesinger C, Sandoghdar V (February 2017). "Cryogenic optical localization provides 3D protein structure data with Angstrom resolution". Методы природы. 14 (2): 141–144. Дои:10.1038/nmeth.4141. HDL:11858/00-001M-0000-002C-DE99-3. PMID 28068317.
- ^ а б c Lemmer P, Gunkel M, Baddeley D, Kaufmann R, Urich A, Weiland Y, Reymann J, Müller P, Hausmann M, Cremer C (2008). "SPDM: Light Microscopy with Single Molecule Resolution at the Nanoscale" (PDF). Прикладная физика B. 93 (1): 1–12. Bibcode:2008ApPhB..93....1L. Дои:10.1007/s00340-008-3152-x.
- ^ Van Oijen AM, Köhler J, Schmidt J, Müller M, Brakenhoff GJ (31 July 1998). "3-Dimensional super-resolution by spectrally selective imaging" (PDF). Письма по химической физике. 292 (1–2): 183–187. Bibcode:1998CPL...292..183V. Дои:10.1016/S0009-2614(98)00673-3.
- ^ Sätzler B, Cremer E (1 February 1998). "High-precision distance measurements and volume-conserving segmentation of objects near and below the resolution limit in three-dimensional confocal fluorescence microscopy". Журнал микроскопии. 189 (2): 118–136. Дои:10.1046/j.1365-2818.1998.00276.x.
- ^ Reymann J, Baddeley D, Gunkel M, Lemmer P, Stadter W, Jegou T, et al. (Май 2008 г.). "High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy". Хромосомные исследования. 16 (3): 367–82. Дои:10.1007/s10577-008-1238-2. PMID 18461478.
- ^ Cremer C, Kaufmann R, Gunkel M, Pres S, Weiland Y, Müller P, et al. (Сентябрь 2011 г.). "Superresolution imaging of biological nanostructures by spectral precision distance microscopy". Biotechnology Journal. 6 (9): 1037–51. Дои:10.1002/biot.201100031. PMID 21910256.
- ^ Cremer C, Kaufmann R, Gunkel M, Polanski F, Müller P, Dierkes R, Degenhard S, Wege C, Hausmann M, Birk U (July 2014). "Application perspectives of localization microscopy in virology". Гистохимия и клеточная биология. 142 (1): 43–59. Дои:10.1007/s00418-014-1203-4. PMID 24614971.
- ^ Wang Q, Dierkes R, Kaufmann R, Cremer C (April 2014). "Quantitative analysis of individual hepatocyte growth factor receptor clusters in influenza A virus infected human epithelial cells using localization microscopy". Biochimica et Biophysica Acta (BBA) - Биомембраны. 1838 (4): 1191–8. Дои:10.1016/j.bbamem.2013.12.014. PMID 24374315.
- ^ Gunkel M, Erdel F, Rippe K, Lemmer P, Kaufmann R, Hörmann C, Amberger R, Cremer C (June 2009). "Dual color localization microscopy of cellular nanostructures" (PDF). Biotechnology Journal. 4 (6): 927–38. Дои:10.1002/biot.200900005. PMID 19548231.
- ^ Zondervan R, Kulzer F, Kolchenko M, Orrit M (2004). "Photobleaching of Rhodamine 6G in Poly(vinyl alcohol) at the Ensemble and Single-Molecule Levels". J. Phys. Chem. А. 108 (10): 1657–1665. Bibcode:2004JPCA..108.1657Z. Дои:10.1021/jp037222e.
- ^ Weisenburger S, Jing B, Renn A, Sandoghdar V (2013). Verma P, Egner A (eds.). "Cryogenic localization of single molecules with angstrom precision". Proc. SPIE. Nanoimaging and Nanospectroscopy. 8815: 88150D. Bibcode:2013SPIE.8815E..0DW. Дои:10.1117/12.2025373.
- ^ Schoen I, Ries J, Klotzsch E, Ewers H, Vogel V (September 2011). "Binding-activated localization microscopy of DNA structures" (PDF). Нано буквы. 11 (9): 4008–11. Bibcode:2011NanoL..11.4008S. Дои:10.1021/nl2025954. PMID 21838238.
- ^ Szczurek A, Klewes L, Xing J, Gourram A, Birk U, Knecht H, Dobrucki JW, Mai S, Cremer C (2017). "Imaging chromatin nanostructure with binding-activated localization microscopy based on DNA structure fluctuations". Исследования нуклеиновых кислот. 45 (8): gkw1301. Дои:10.1093/nar/gkw1301. ЧВК 5416826. PMID 28082388.
- ^ Ries J, Udayar V, Soragni A, Hornemann S, Nilsson KP, Riek R, et al. (Июль 2013). "Superresolution imaging of amyloid fibrils with binding-activated probes". ACS Chemical Neuroscience. 4 (7): 1057–61. Дои:10.1021/cn400091m. ЧВК 3715833. PMID 23594172.
- ^ Huh H, Lee J, Kim HJ, Hohng S, Kim SK (2017). "Morphological analysis of oligomeric vs. fibrillar forms of α-synuclein aggregates with super-resolution BALM imaging". Письма по химической физике. 690: 62–67. Bibcode:2017CPL...690...62H. Дои:10.1016/j.cplett.2017.10.034.
- ^ а б Rust MJ, Bates M, Zhuang X (October 2006). "Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)". Методы природы. 3 (10): 793–5. Дои:10.1038/nmeth929. ЧВК 2700296. PMID 16896339.
- ^ а б c Betzig E, Patterson GH, Sougrat R, Lindwasser OW, Olenych S, Bonifacino JS, et al. (Сентябрь 2006 г.). "Imaging intracellular fluorescent proteins at nanometer resolution". Наука. 313 (5793): 1642–5. Bibcode:2006Научный ... 313.1642B. Дои:10.1126 / science.1127344. PMID 16902090.
- ^ а б c Hess ST, Girirajan TP, Mason MD (December 2006). "Ultra-high resolution imaging by fluorescence photoactivation localization microscopy". Биофизический журнал. 91 (11): 4258–72. Bibcode:2006BpJ....91.4258H. Дои:10.1529/biophysj.106.091116. ЧВК 1635685. PMID 16980368.
- ^ Zhuang X (2009). "Nano-imaging with Storm". Природа Фотоника. 3 (7): 365–367. Bibcode:2009NaPho...3..365Z. Дои:10.1038/nphoton.2009.101. ЧВК 2840648. PMID 20300445.
- ^ Bates M, Blosser TR, Zhuang X (March 2005). "Short-range spectroscopic ruler based on a single-molecule optical switch". Письма с физическими проверками. 94 (10): 108101. arXiv:q-bio/0502012. Bibcode:2005PhRvL..94j8101B. Дои:10.1103/physrevlett.94.108101. ЧВК 2652517. PMID 15783528.
- ^ Dempsey GT, Bates M, Kowtoniuk WE, Liu DR, Tsien RY, Zhuang X (December 2009). "Photoswitching mechanism of cyanine dyes". Журнал Американского химического общества. 131 (51): 18192–3. Дои:10.1021/ja904588g. ЧВК 2797371. PMID 19961226.
- ^ а б Bock H, Geisler C, Wurm CA, Von Middendorff C, Jakobs S, Schönle A, et al. (2007). "Two-color far-field fluorescence nanoscopy based on photoswitchable emitters". Прикладная физика B. 88 (2): 161–165. Bibcode:2007ApPhB..88..161B. Дои:10.1007/s00340-007-2729-0.
- ^ Fölling J, Bossi M, Bock H, Medda R, Wurm CA, Hein B, et al. (Ноябрь 2008 г.). "Fluorescence nanoscopy by ground-state depletion and single-molecule return". Методы природы. 5 (11): 943–5. Дои:10.1038/nmeth.1257. HDL:11858/00-001M-0000-0012-DA73-1. PMID 18794861.
- ^ Heilemann M, van de Linde S, Schüttpelz M, Kasper R, Seefeldt B, Mukherjee A, et al. (2008). "Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes". Angewandte Chemie. 47 (33): 6172–6. Дои:10.1002/anie.200802376. PMID 18646237.
- ^ Heilemann M, van de Linde S, Mukherjee A, Sauer M (2009). "Super-resolution imaging with small organic fluorophores". Angewandte Chemie. 48 (37): 6903–8. Дои:10.1002/anie.200902073. PMID 19670280.
- ^ Vogelsang J, Cordes T, Forthmann C, Steinhauer C, Tinnefeld P (May 2009). "Controlling the fluorescence of ordinary oxazine dyes for single-molecule switching and superresolution microscopy". Труды Национальной академии наук Соединенных Штатов Америки. 106 (20): 8107–12. Bibcode:2009PNAS..106.8107V. Дои:10.1073/pnas.0811875106. ЧВК 2688868. PMID 19433792.
- ^ Lee HL, Lord SJ, Iwanaga S, Zhan K, Xie H, Williams JC, et al. (Ноябрь 2010 г.). "Superresolution imaging of targeted proteins in fixed and living cells using photoactivatable organic fluorophores". Журнал Американского химического общества. 132 (43): 15099–101. Дои:10.1021/ja1044192. ЧВК 2972741. PMID 20936809.
- ^ а б c Bates M, Huang B, Dempsey GT, Zhuang X (September 2007). "Multicolor super-resolution imaging with photo-switchable fluorescent probes". Наука. 317 (5845): 1749–53. Bibcode:2007Sci...317.1749B. Дои:10.1126/science.1146598. ЧВК 2633025. PMID 17702910.
- ^ а б c d Huang B, Jones SA, Brandenburg B, Zhuang X (December 2008). "Whole-cell 3D STORM reveals interactions between cellular structures with nanometer-scale resolution". Методы природы. 5 (12): 1047–52. Дои:10.1038/nmeth.1274. ЧВК 2596623. PMID 19029906.
- ^ а б Dani A, Huang B, Bergan J, Dulac C, Zhuang X (December 2010). "Superresolution imaging of chemical synapses in the brain". Нейрон. 68 (5): 843–56. Дои:10.1016/j.neuron.2010.11.021. ЧВК 3057101. PMID 21144999.
- ^ Testa I, Wurm CA, Medda R, Rothermel E, von Middendorf C, Fölling J, et al. (Октябрь 2010 г.). "Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength". Биофизический журнал. 99 (8): 2686–94. Bibcode:2010BpJ....99.2686T. Дои:10.1016/j.bpj.2010.08.012. ЧВК 2956215. PMID 20959110.
- ^ а б c d Jones SA, Shim SH, He J, Zhuang X (June 2011). "Fast, three-dimensional super-resolution imaging of live cells". Методы природы. 8 (6): 499–508. Дои:10.1038/nmeth.1605. ЧВК 3137767. PMID 21552254.
- ^ а б Wang W, Li GW, Chen C, Xie XS, Zhuang X (September 2011). "Chromosome organization by a nucleoid-associated protein in live bacteria". Наука. 333 (6048): 1445–9. Bibcode:2011Sci...333.1445W. Дои:10.1126/science.1204697. ЧВК 3329943. PMID 21903814.
- ^ а б Huang B, Wang W, Bates M, Zhuang X (February 2008). "Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy". Наука. 319 (5864): 810–3. Bibcode:2008Sci ... 319..810H. Дои:10.1126 / science.1153529. ЧВК 2633023. PMID 18174397.
- ^ Wu M, Huang B, Graham M, Raimondi A, Heuser JE, Zhuang X, De Camilli P (September 2010). "Coupling between clathrin-dependent endocytic budding and F-BAR-dependent tubulation in a cell-free system". Природа клеточной биологии. 12 (9): 902–8. Дои:10.1038/ncb2094. ЧВК 3338250. PMID 20729836.
- ^ Sharonov A, Hochstrasser RM (December 2006). "Wide-field subdiffraction imaging by accumulated binding of diffusing probes". Труды Национальной академии наук Соединенных Штатов Америки. 103 (50): 18911–6. Bibcode:2006PNAS..10318911S. Дои:10.1073/pnas.0609643104. ЧВК 1748151. PMID 17142314.
- ^ а б Шах, Шалин; Dubey, Abhishek K.; Reif, John (10 April 2019). "Programming Temporal DNA Barcodes for Single-Molecule Fingerprinting". Нано буквы. 19 (4): 2668–2673. Дои:10.1021/acs.nanolett.9b00590. ISSN 1530-6984.
- ^ Шах, Шалин; Dubey, Abhishek K.; Reif, John (17 May 2019). "Improved Optical Multiplexing with Temporal DNA Barcodes". Синтетическая биология ACS. 8 (5): 1100–1111. Дои:10.1021/acssynbio.9b00010.
- ^ Tinnefeld, Philip; и другие. (2015). Far-Field Optical Nanoscopy. Springer. п. 334. ISBN 978-366245547-0. Получено 6 июля 2020.
- ^ Lew MD, Lee SF, Ptacin JL, Lee MK, Twieg RJ, Shapiro L, Moerner WE (November 2011). "Three-dimensional superresolution colocalization of intracellular protein superstructures and the cell surface in live Caulobacter crescentus". Труды Национальной академии наук Соединенных Штатов Америки. 108 (46): E1102-10. Дои:10.1073/pnas.1114444108. ЧВК 3219151. PMID 22031697.
- ^ Pyle JR, Chen J (2 November 2017). "Photobleaching of YOYO-1 in super-resolution single DNA fluorescence imaging". Журнал нанотехнологий Beilstein. 8: 2296–2306. Дои:10.3762/bjnano.8.229. ЧВК 5687005. PMID 29181286.
- ^ Jungmann R, Steinhauer C, Scheible M, Kuzyk A, Tinnefeld P, Simmel FC (November 2010). "Single-molecule kinetics and super-resolution microscopy by fluorescence imaging of transient binding on DNA origami". Нано буквы. 10 (11): 4756–61. Bibcode:2010NanoL..10.4756J. Дои:10.1021/nl103427w. PMID 20957983.
- ^ Nieves DJ, Gaus K, Baker MA (December 2018). "DNA-Based Super-Resolution Microscopy: DNA-PAINT". Гены. 9 (12): 621. Дои:10.3390/genes9120621. ЧВК 6315775. PMID 30544986.
- ^ Chen J, Bremauntz A, Kisley L, Shuang B, Landes CF (October 2013). "Super-resolution mbPAINT for optical localization of single-stranded DNA". Прикладные материалы и интерфейсы ACS. 5 (19): 9338–43. Дои:10.1021/am403984k. ЧВК 3934010. PMID 24073628.
- ^ Kisley L, Chen J, Mansur AP, Shuang B, Kourentzi K, Poongavanam MV, et al. (Февраль 2014). "Unified superresolution experiments and stochastic theory provide mechanistic insight into protein ion-exchange adsorptive separations". Труды Национальной академии наук Соединенных Штатов Америки. 111 (6): 2075–80. Bibcode:2014PNAS..111.2075K. Дои:10.1073/pnas.1318405111. ЧВК 3926075. PMID 24459184.
- ^ Wang W, Shen H, Shuang B, Hoener BS, Tauzin LJ, Moringo NA, et al. (Ноябрь 2016 г.). "Super Temporal-Resolved Microscopy (STReM)". Письма в Журнал физической химии. 7 (22): 4524–4529. Дои:10.1021/acs.jpclett.6b02098. PMID 27797527.
- ^ Kaufmann R, Müller P, Hausmann M, Cremer C (June 2011). «Визуализация безметки внутриклеточных структур с помощью микроскопии локализации». Микрон. 42 (4): 348–52. Дои:10.1016 / j.micron.2010.03.006. PMID 20538472.
- ^ Ayas S, Cinar G, Ozkan AD, Soran Z, Ekiz O, Kocaay D, et al. (2013). "Label-free nanometer-resolution imaging of biological architectures through surface enhanced Raman scattering". Научные отчеты. 3: 2624. Bibcode:2013NatSR...3E2624A. Дои:10.1038/srep02624. ЧВК 3769681. PMID 24022059.
- ^ Heilemann et al, 2008, Angewandte Chemie and van de Linde et al, 2011, Photochem. Photobiol. Наука
- ^ Baddeley D, Jayasinghe ID, Cremer C, Cannell MB, Soeller C (January 2009). "Light-induced dark states of organic fluochromes enable 30 nm resolution imaging in standard media". Биофизический журнал. 96 (2): L22-4. Bibcode:2009BpJ....96L..22B. Дои:10.1016/j.bpj.2008.11.002. ЧВК 2716455. PMID 19167284.
- ^ Fölling J, Bossi M, Bock H, Medda R, Wurm CA, Hein B, et al. (Ноябрь 2008 г.). "Fluorescence nanoscopy by ground-state depletion and single-molecule return". Методы природы. 5 (11): 943–5. Дои:10.1038/NMETH.1257. HDL:11858/00-001M-0000-0012-DA73-1. PMID 18794861.
- ^ Heilemann M, van de Linde S, Schüttpelz M, Kasper R, Seefeldt B, Mukherjee A, et al. (2008). "Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes". Angewandte Chemie. 47 (33): 6172–6. Дои:10.1002/anie.200802376. PMID 18646237.
- ^ Sage D, Kirshner H, Pengo T, Stuurman N, Min J, Manley S, Unser M (August 2015). "Quantitative evaluation of software packages for single-molecule localization microscopy". Методы природы. 12 (8): 717–24. Дои:10.1038/nmeth.3442. PMID 26076424.
- ^ "Single-Molecule Localization Microscopy – Software Benchmarking". Biomedical Imaging Group, Ecole Polytechnique Fédérale de Lausanne (EPFL). 2018. Получено 7 июля 2020.
- ^ Baddeley D, Cannell MB, Soeller C (February 2010). "Visualization of localization microscopy data". Микроскопия и микроанализ. 16 (1): 64–72. Bibcode:2010MiMic..16...64B. Дои:10.1017/S143192760999122X. PMID 20082730.
- ^ Prakash K (17 May 2017). "High-density superresolution microscopy with an incoherent light source and a conventional epifluorescence microscope setup". bioRxiv 10.1101/121061.
- ^ Baddeley D, Batram C, Weiland Y, Cremer C, Birk UJ.: Nanostructure analysis using Spatially Modulated Illumination microscopy. In: Nature Protocols 2007; 2: 2640–2646
- ^ Kaufmann R, Müller P, Hildenbrand G, Hausmann M, Cremer C (2010). «Анализ кластеров мембранного белка Her2 / neu в различных типах клеток рака груди с использованием микроскопии локализации». Журнал микроскопии. 242 (1): 46–54. Дои:10.1111 / j.1365-2818.2010.03436.x. PMID 21118230.
- ^ Liss V, Barlag B, Nietschke M, Hensel M (December 2015). "Self-labelling enzymes as universal tags for fluorescence microscopy, super-resolution microscopy and electron microscopy". Научные отчеты. 5: 17740. Bibcode:2015NatSR...517740L. Дои:10.1038/srep17740. ЧВК 4672345. PMID 26643905.
- ^ Ledig C, Theis L, Huszar F, Caballero J, Cunningham A, Acosta A, Aitken A, Tejani A, Totz J (July 2017). "Photo-Realistic Single Image Super-Resolution Using a Generative Adversarial Network". 2017 IEEE Conference on Computer Vision and Pattern Recognition (CVPR). Honolulu, HI: IEEE: 105–114. arXiv:1609.04802. Дои:10.1109/CVPR.2017.19. ISBN 9781538604571.
- ^ Rivenson Y, Göröcs Z, Günaydin H, Zhang Y, Wang H, Ozcan A (20 November 2017). "Deep learning microscopy". Optica. 4 (11): 1437. arXiv:1705.04709. Bibcode:2017arXiv170504709R. Дои:10.1364/OPTICA.4.001437. ISSN 2334-2536.
- ^ Grant-Jacob JA, Mackay BS, Baker JA, Xie Y, Heath DJ, Loxham M, Eason RW, Mills B (18 June 2019). "A neural lens for super-resolution biological imaging". Журнал физики: коммуникации. 3 (6): 065004. Bibcode:2019JPhCo...3f5004G. Дои:10.1088/2399-6528/ab267d. ISSN 2399-6528.
- ^ Wang H, Rivenson Y, Jin Y, Wei Z, Gao R, Günaydın H, et al. (Январь 2019). "Deep learning enables cross-modality super-resolution in fluorescence microscopy". Методы природы. 16 (1): 103–110. Дои:10.1038/s41592-018-0239-0. ЧВК 7276094. PMID 30559434.
дальнейшее чтение
- Marx V (December 2013) [26 November 2013]. "Is super-resolution microscopy right for you?". Особенность технологии. Методы природы (Paper "Nature Reprint Collection, Technology Features"). 10 (12): 1157–63. Дои:10.1038/nmeth.2756. PMID 24296472.
- Cremer C, Masters BR (April 2013). "Resolution enhancement techniques in microscopy". Европейский физический журнал H. 38 (3): 281–344. Bibcode:2013EPJH...38..281C. Дои:10.1140/epjh/e2012-20060-1.









