Фотоактивированная локализационная микроскопия - Photoactivated localization microscopy
Фотоактивированная локализационная микроскопия (ЛАДОНЬ или же FPALM)[1][2]и микроскопия стохастической оптической реконструкции (STORM)[3] широкоугольные (в отличие от методов точечного сканирования, таких как лазерная сканирующая конфокальная микроскопия ) флуоресцентная микроскопия методы визуализации, позволяющие получать изображения с разрешением выше предел дифракции. Эти методы были предложены в 2006 году после повсеместного появления оптических микроскопия сверхвысокого разрешения методов, и были признаны Методами года на 2008 г. Методы природы журнал.[4]Развитие PALM как целевого метода биофизической визуализации во многом было вызвано открытием новых видов и созданием мутантов флуоресцентных белков, демонстрирующих контролируемый фотохромизм, например фотоактивируемый GFP. Однако сопутствующее развитие STORM, разделяющее тот же фундаментальный принцип, первоначально использовало парные цианин красители.Одна молекула пары (называемая активатором), когда она возбуждена вблизи своего максимума поглощения, служит для реактивации другой молекулы (называемой репортером) до флуоресцентного состояния.
Растущее количество красителей используется для PALM, STORM и связанных с ними методов, как органических флуорофоров, так и флуоресцентных белков. Некоторые из них совместимы с визуализацией живых клеток, другие позволяют быстрее получать или более плотно маркировать. Выбор конкретного флуорофора в конечном итоге зависит от области применения и от его фотофизических свойств.[5]
Оба метода претерпели значительные технические усовершенствования,[6] в частности, возможность получения многоцветных изображений и расширения до трех измерений с наилучшим текущим осевым разрешением 10 нм в третьем измерении, полученным с использованием интерферометрического подхода с двумя противоположными объективами, собирающими флуоресценцию образца.[7]
Принцип
Общепринятый флуоресцентная микроскопия осуществляется путем выборочного окрашивания образца флуоресцентный молекулы, либо связанные с антителами, как в иммуногистохимия или с использованием флуоресцентных белков, генетически слитых с интересующими генами. Как правило, чем более концентрированы флуорофоры, тем лучше контраст флуоресцентного изображения.
Отдельный флуорофор можно увидеть под микроскопом (или даже невооруженным глазом).[8]), если количество испускаемых фотонов достаточно велико, а фон, напротив, достаточно низкий. Двумерное изображение точечного источника, наблюдаемое под микроскопом, представляет собой протяженное пятно, соответствующее Диск Эйри (раздел функция разброса точки ) системы визуализации. Способность идентифицировать как два отдельных объекта два близко расположенных флуорофора ограничена дифракция света. Это определяется количественно Аббат Критерий, утверждающий, что минимальное расстояние что позволяет разрешить два точечных источника, имеет вид
куда это длина волны флуоресцентного излучения, NA - числовая апертура микроскопа. Теоретический предел разрешения при самой короткой практической длине волны возбуждения составляет около 150 нм в поперечном измерении и приближается к 400 нм в осевом направлении (при использовании объектива с числовой апертурой 1,40 и длиной волны возбуждения 400 нм).
Однако, если излучение двух соседних флуоресцентных молекул сделать различимым, т.е. фотоны, исходящие от каждой из двух, можно идентифицировать, то можно преодолеть дифракционный предел.[9] Как только набор фотонов от конкретной молекулы собран, он образует ограниченное дифракцией пятно в плоскости изображения микроскопа. Центр этого пятна может быть найден путем подгонки наблюдаемого профиля излучения к известной геометрической функции, обычно Гауссовский функционируют в двух измерениях. Ошибка, которая совершается при локализации центра точечного излучателя, масштабируется в первом приближении как обратный квадратный корень из числа излучаемых фотонов, и если собрано достаточно фотонов, легко получить ошибку локализации, намного меньшую, чем исходная точка. функция распространения.

Два этапа идентификации и локализации отдельных флуоресцентных молекул в плотной среде, где многие из них присутствуют, лежат в основе PALM, STORM и их развития.
Хотя существует множество подходов к молекулярной идентификации, индуцированный светом фотохромизм выбранных флуорофоров стал наиболее многообещающим подходом для различения соседних молекул путем разделения их флуоресцентного излучения во времени. Включив стохастически редкие подмножества флуорофоров со светом определенной длины волны, отдельные молекулы затем могут быть возбуждены и отображены в соответствии с их спектрами. Во избежание накопления активных флуорофоров в образце, которое в конечном итоге может вернуться к дифракционно ограниченному изображению, спонтанно возникающее явление фотообесцвечивание используется в PALM, тогда как обратимое переключение между флуоресцентным включенным состоянием и темным выключенным состоянием красителя используется в STORM.
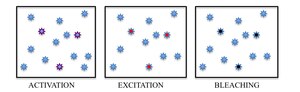
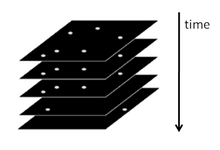
Таким образом, PALM и STORM основаны на сборе под флуоресцентным микроскопом большого количества изображений, каждое из которых содержит всего несколько активных изолированных флуорофоров. Последовательность визуализации позволяет выполнять множество циклов излучения, необходимых для стохастической активации каждого флуорофора из неизлучающего (или менее эмиссионный) в яркое состояние и обратно в неэмиссионное или обесцвеченное состояние. Во время каждого цикла плотность активированных молекул поддерживается на достаточно низком уровне, чтобы молекулярные изображения отдельных флуорофоров обычно не перекрывались.

Локализация отдельных флуорофоров
На каждом изображении последовательности положение флуорофора вычисляется с точностью, обычно превышающей дифракционный предел - в типичном диапазоне от нескольких до десятков нм - и полученная информация о положении центров всех локализованных молекулы используются для создания изображений PALM или STORM сверхвысокого разрешения.
Точность локализации можно рассчитать по формуле:
где N - количество собранных фотонов, a - размер пикселя детектора изображения, - средний фоновый сигнал и - стандартное отклонение функции рассеяния точки.[10]Требование одновременной локализации нескольких флуорофоров одновременно на большой площади определяет причину, по которой эти методы являются широкопольными, поскольку в качестве детектора используется CCD, EMCCD или CMOS камера.
Требование расширенного соотношение сигнал шум Чтобы максимизировать точность локализации, обуславливает частое сочетание этой концепции с широкопольными флуоресцентными микроскопами, позволяющими делать оптические срезы, например флуоресцентные микроскопы полного внутреннего отражения (TIRF) и световые люминесцентные микроскопы.
Изображение сверхвысокого разрешения
Разрешение окончательного изображения ограничено точностью каждой локализации и количеством локализаций, а не дифракцией. Таким образом, изображение со сверхвысоким разрешением является пуантилистический представление координат всех локализованных молекул. Изображение со сверхвысоким разрешением обычно визуализируется путем представления каждой молекулы в плоскости изображения как двумерного гауссова с амплитудой, пропорциональной количеству собранных фотонов, и стандартным отклонением, зависящим от точности локализации.

Приложения
Многоцветный ЛАДОНИ / ШТОРМ

Своеобразные фотофизические свойства флуорофоров, используемых в PALM / STORM визуализации сверхвысокого разрешения, создают как ограничения, так и возможности для многоцветной визуализации. К настоящему времени появились три стратегии: возбуждение спектрально разделенных флуорофоров с помощью эмиссионного светоделителя,[12] использование нескольких активаторов / репортеров в режиме ШТОРМ[13][14] и ратиометрическая визуализация спектрально близких флуорофоров.[15]
3D в PALM и STORM
Первоначально разработанные как методы визуализации 2D (x, y), PALM и STORM быстро превратились в методы, поддерживающие 3D (x, y, z). Для определения осевого положения одиночного флуорофора в образце в настоящее время используются следующие подходы: модификация функции рассеяния точки для введения z-зависимых особенностей в 2D (x, y) изображение (наиболее распространенный подход - ввести астигматизм в PSF); многоплоскостное обнаружение, где осевое положение определяется путем сравнения двух изображений одного и того же PSF, расфокусированных одно относительно другого; интерферометрический определение аксиального положения излучателя с помощью двух противоположных объективов и нескольких детекторов;[7] использование временная фокусировка ограничить возбуждение / активацию; использование световой лист возбуждение / активация ограничивается слоем толщиной несколько сотен нанометров, произвольно расположенным вдоль z-плоскости внутри образца.
Визуализация живых клеток
Требование нескольких циклов активации, возбуждения и деактивации / обесцвечивания обычно подразумевает длительные периоды времени для формирования изображения ЛАДОНА / ШТОРМА и, следовательно, работы с фиксированным образцом. Ряд работ был опубликован еще в 2007 г. [16] выполнение PALM / STORM на живых клетках. Возможность выполнять живую визуализацию сверхвысокого разрешения с использованием этих методов в конечном итоге зависит от технических ограничений сбора достаточного количества фотонов от одного излучателя за очень короткое время. Это зависит как от фотофизических ограничений зонда, так и от чувствительности используемого детектора. Относительно медленные (от секунд до десятков секунд) процессы, такие как модификация в организации очаговые спайки были исследованы с помощью PALM,[17] в то время как STORM позволил визуализировать более быстрые процессы, такие как мембранная диффузия ямок, покрытых клатрином, или процессы митохондриального деления / слияния. Многообещающим применением PALM живых клеток является использование фотоактивации для выполнения высокоплотного отслеживания одиночных частиц (sptPALM [18]), преодолевая традиционное ограничение отслеживание одиночной частицы для работы с системами, отображающими очень низкую концентрацию флуорофоров.
Нанофотонные взаимодействия
Хотя традиционные измерения PALM и STORM используются для определения физической структуры образца, причем интенсивности флуоресцентных событий определяют достоверность локализации, эти интенсивности также могут использоваться для картирования взаимодействий флуорофора с нанофотонный конструкции. Это было выполнено на обоих металлических (плазмонный ) структуры, такие как золотые наностержни,[19][20] а также полупроводниковые структуры, такие как кремниевые нанопроволоки.[21]Эти подходы могут быть использованы либо для флуорофоров, функционализированных на поверхности исследуемого образца (как для упомянутых здесь исследований плазмонных частиц), либо для случайной адсорбции на подложке, окружающей образец, что позволяет полностью 2D-картировать взаимодействия флуорофор-наноструктура во всех положениях. относительно конструкции.[21]
Эти исследования показали, что помимо стандартной неопределенности локализации из-за функция разброса точки подгонка, самоинтерференция света, рассеянного наночастицами, может привести к искажению или смещению отображаемых функций рассеяния точки,[20][21] усложняет анализ таких измерений. Однако их можно ограничить, например, путем включения метаповерхностных масок, которые контролируют угловое распределение света, разрешенного в системе измерения.[22]
Различия между PALM и STORM
PALM и STORM имеют общий фундаментальный принцип, и многочисленные разработки, как правило, сделали эти две техники еще более взаимосвязанными. Тем не менее, они отличаются в нескольких технических деталях и фундаментальном моменте. С технической стороны, PALM выполняется на биологическом образце с использованием флуорофоров, экзогенно экспрессируемых в форме генетических конструкций слияния с фотоактивируемым флуоресцентным белком. Вместо этого STORM использует иммуномаркирование эндогенных молекул в образце антителами, меченными органическими флуорофорами. В обоих случаях флуорофоры переводятся между активным включенным и неактивным состоянием под действием света. В PALM, однако, фотоактивация и фотообесцвечивание ограничивают жизнь флуорофора ограниченным интервалом времени, и желательно непрерывное излучение флуорофора между ними без какой-либо перемежающейся флуоресценции. В стохастике STORM фотомигающий органических флуорофоров (обычно более ярких, чем флуоресцентные белки) первоначально использовались для разделения соседних красителей. В этом отношении, чем сильнее мигание, тем выше вероятность различения двух соседних флуорофоров.
В связи с этим в нескольких исследовательских работах изучали потенциал PALM для количественного определения количества флуорофоров (и, следовательно, представляющих интерес белков), присутствующих в образце, путем подсчета активированных флуорофоров.[11][23][24] Подход, используемый для обработки флуоресцентной динамики флуоресцентной метки, используемой в экспериментах, будет определять окончательный вид изображения сверхвысокого разрешения и возможность определения однозначного соответствия между событием локализации и белком в образце.
Мультимедиа
Иммобилизованные флуоресцентные белки фотоактивируются, возбуждаются и обесцвечиваются
Динамическая визуализация дендритных шипов со сверхвысоким разрешением с использованием фотопреобразованного актина с низким сродством.[25]
Исследование динамики подкожного актина в нейронах гиппокампа крыс с помощью оптической микроскопии сверхвысокого разрешения [26]
Рекомендации
- ^ Э. Бетциг; Г. Х. Паттерсон; Р. Суграт; О. В. Линдвассер; С. Оленич; Дж. С. Бонифачино; М. В. Дэвидсон; Дж. Липпинкотт-Шварц; Х. Ф. Гесс (2006). «Визуализация внутриклеточных флуоресцентных белков с нанометровым разрешением». Наука. 313 (5793): 1642–1645. Bibcode:2006Научный ... 313.1642B. Дои:10.1126 / science.1127344. PMID 16902090.
- ^ С. Т. Гесс; Т. П. Гириаджан; М. Д. Мейсон (2006). «Визуализация сверхвысокого разрешения с помощью флуоресцентной фотоактивационной локальной микроскопии». Биофизический журнал. 91 (11): 4258–4272. Bibcode:2006BpJ .... 91.4258H. Дои:10.1529 / biophysj.106.091116. ЧВК 1635685. PMID 16980368.
- ^ М. Дж. Руст; М. Бейтс; X. Чжуан (2006). «Получение изображений с субдифракционным пределом с помощью микроскопии стохастической оптической реконструкции (STORM)». Методы природы. 3 (20): 793–796. Дои:10.1038 / nmeth929. ЧВК 2700296. PMID 16896339.
- ^ «Метод года 2008». Методы природы. 6 (1): 1–109. 2009. Дои:10.1038 / nmeth.f.244.
- ^ Ха, Таэкджип и Тиннефельд, Филип (2012). "Фотофизика флуоресцентных зондов для биофизики одиночных молекул и визуализации сверхвысокого разрешения". Ежегодный обзор физической химии. 63 (1): 595–617. Bibcode:2012ARPC ... 63..595H. Дои:10.1146 / annurev-physchem-032210-103340. ЧВК 3736144. PMID 22404588.
- ^ Бо Хуанг, Хазен Бэбкок и Сяовей Чжуан (2010). «Преодолевая дифракционный барьер: визуализация клеток со сверхвысоким разрешением». Клетка. 143 (7): 1047–58. Дои:10.1016 / j.cell.2010.12.002. ЧВК 3272504. PMID 21168201.
- ^ а б Штенгель, Глеб и Гэлбрейт, Джеймс А. и Гэлбрейт, Кэтрин Г. и Липпинкотт-Шварц, Дженнифер и Джиллетт, Дженнифер М. и Мэнли, Сулиана и Суграт, Рашид и Уотерман, Клэр М. и Канчанавонг, Пакорн и Дэвидсон, Майкл В. . и Феттер, Ричард Д. и Хесс, Харальд Ф. (2009). «Интерферометрическая флуоресцентная микроскопия сверхвысокого разрешения разрешает трехмерную клеточную ультраструктуру». Труды Национальной академии наук. 106 (9): 3125–3130. Bibcode:2009ПНАС..106.3125С. Дои:10.1073 / pnas.0813131106. ЧВК 2637278. PMID 19202073.CS1 maint: несколько имен: список авторов (связь)
- ^ В. Э. Мёрнер; Д. П. Фромм (2003). «Методы флуоресцентной спектроскопии одиночных молекул и индивидуальные флуоресцентные зонды». Обзор научных инструментов. 74 (8): 3597–3619. Bibcode:2003НИИ ... 74.3597М. Дои:10.1063/1.1589587.
- ^ Э. Бетциг (1995). «Предлагаемый метод молекулярно-оптической визуализации». Письма об оптике. 20 (3): 237–239. Bibcode:1995OptL ... 20..237B. Дои:10.1364 / OL.20.000237. PMID 19859146.
- ^ К. И. Мортенсен; Л. С. Черчман; Дж. А. Спудич; Х. Фливбьерг (2010). «Оптимизированный анализ локализации для трекинга одиночных молекул и микроскопии сверхвысокого разрешения». Методы природы. 7 (5): 377–381. Дои:10.1038 / nmeth.1447. ЧВК 3127582. PMID 20364147.
- ^ а б Гринфилд Д., Макэвой А.Л., Шрофф Х., Крукс Г.Е., Вингрин Н.С. и др. (2009). "Самоорганизация сети хемотаксиса Escherichia coli, полученная с помощью световой микроскопии сверхвысокого разрешения". PLOS Биология. 7 (6): e1000137. Дои:10.1371 / journal.pbio.1000137. ЧВК 2691949. PMID 19547746.
- ^ Шрофф H, Гэлбрейт CG, Гэлбрейт JA, White H, Gillette J, Olenych S, Davidson MW, Betzig E (2007). «Двухцветная визуализация сверхвысокого разрешения генетически экспрессируемых зондов в индивидуальных адгезионных комплексах». Труды Национальной академии наук. 104 (51): 20308–20313. Bibcode:2007ПНАС..10420308С. Дои:10.1073 / pnas.0710517105. ЧВК 2154427. PMID 18077327.
- ^ М. Бейтс; Б Хуанг; Г.Т. Демпси; Х Чжуан (2007). «Многоцветное изображение сверхвысокого разрешения с фото-переключаемыми флуоресцентными датчиками». Наука. 317 (5845): 1749–1753. Bibcode:2007Sci ... 317.1749B. Дои:10.1126 / science.1146598. ЧВК 2633025. PMID 17702910.
- ^ Bock, H .; и другие. (2007). «Двухцветная флуоресцентная наноскопия в дальней зоне на основе фотопереключаемых излучателей». Прикладная физика B. 88 (2): 161–165. Bibcode:2007АпФБ..88..161Б. Дои:10.1007 / s00340-007-2729-0.
- ^ Testa I, Wurm CA, Medda R, Rothermel E, von Middendorf C, Folling J, Jakobs S, Schonle A, Hell SW, Eggeling C (2010). «Многоцветная флуоресцентная наноскопия в фиксированных и живых клетках путем возбуждения обычных флуорофоров с помощью одной длины волны». Биофизический журнал. 99 (8): 2686–2694. Bibcode:2010BpJ .... 99.2686T. Дои:10.1016 / j.bpj.2010.08.012. ЧВК 2956215. PMID 20959110.
- ^ Хесс, Сэмюэл Т. и Гулд, Трэвис Дж. И Гудети, Манаса В. и Маас, Сара А. и Миллс, Кевин Д. и Циммерберг, Джошуа (2007). «Динамическое кластерное распределение гемагглютинина, разрешенного при 40 нм в мембранах живых клеток, различает теории рафта». Труды Национальной академии наук. 104 (44): 17370–17375. Bibcode:2007PNAS..10417370H. Дои:10.1073 / pnas.0708066104. ЧВК 2077263. PMID 17959773.CS1 maint: несколько имен: список авторов (связь)
- ^ Шрофф, Х., К. Г. Гэлбрейт, Дж. А. Гэлбрейт и Э. Бетциг (2008). "Фотоактивированная локализационная микроскопия живых клеток наноразмерной динамики адгезии". Методы природы. 5 (44): 417–423. Дои:10.1038 / nmeth.1202. ЧВК 5225950. PMID 18408726.CS1 maint: несколько имен: список авторов (связь)
- ^ S Manley; JM Gillette; Г. Х. Паттерсон; H Shroff; H F Hess; E Betzig; Дж. Липпинкотт-Шварц (2008). «Картирование траекторий одиночных молекул с высокой плотностью при помощи фотоактивированной микроскопии локализации». Методы природы. 5 (2): 155–157. Дои:10.1038 / nmeth.1176. PMID 18193054.
- ^ Чжоу, Сяочунь; Андой, Неша Мэй; Лю, Гуокун; Чоудхари, Эрик; Хан, Кю-Сун; Шэнь, Хао; Чен, Пэн (2012). «Количественная визуализация сверхвысокого разрешения раскрывает картины реакционной способности отдельных нанокатализаторов». Природа Нанотехнологии. 7 (4): 237–241. Bibcode:2012НатНа ... 7..237Z. Дои:10.1038 / nnano.2012.18. ISSN 1748-3387. PMID 22343380.
- ^ а б Линь, Хунчжэнь; Centeno, Silvia P .; Су, Лян; Кененс, Барт; Роча, Сусана; Слива, Мишель; Хофкенс, Йохан; Удзи-и, Хироши (2012). «Картирование поверхностно-усиленной флуоресценции на металлических наночастицах с использованием локализационной микроскопии фотоактивации сверхвысокого разрешения». ХимФисХим. 13 (4): 973–981. Дои:10.1002 / cphc.201100743. ISSN 1439-4235. PMID 22183928.
- ^ а б c Джолин, Эрик; Солари, Якопо; Mann, Sander A .; Ван, Цзя; Shimizu, Thomas S .; Гарнетт, Эрик К. (2016). «Визуализация со сверхвысоким разрешением взаимодействия света и вещества вблизи одиночных полупроводниковых нанопроволок». Nature Communications. 7: 13950. Bibcode:2016НатКо ... 713950J. Дои:10.1038 / ncomms13950. ISSN 2041-1723. ЧВК 5187462. PMID 27996010.
- ^ Backlund, Mikael P .; Арбаби, Амир; Петров, Петар Н .; Арбаби, Эхсан; Саураб, Саумья; Фараон, Андрей; Моернер, В. Э. (2016). «Устранение смещений локализации, вызванных ориентацией, в микроскопии одиночных молекул с использованием широкополосной метаповерхностной маски» (PDF). Природа Фотоника. 10 (7): 459–462. Bibcode:2016НаФо..10..459Б. Дои:10.1038 / nphoton.2016.93. ISSN 1749-4885. ЧВК 5001689. PMID 27574529.
- ^ П. Аннибале; S Vanni; М. Скарселли; У Ротлисбергера; Раденович (2011). "Количественная фотоактивированная локализационная микроскопия: раскрытие эффектов фотомигания". PLOS ONE. 6 (7): p.e22678, 07. Bibcode:2011PLoSO ... 622678A. Дои:10.1371 / journal.pone.0022678. ЧВК 3144238. PMID 21818365.
- ^ Ли, Сан-Хёк и Шин, Чже Йен и Ли, Антони и Бустаманте, Карлос (2012). «Подсчет отдельных фотоактивируемых флуоресцентных молекул с помощью фотоактивированной локализационной микроскопии (PALM)». Труды Национальной академии наук. 109 (43): 17436–17441. Bibcode:2012PNAS..10917436L. Дои:10.1073 / pnas.1215175109. ЧВК 3491528. PMID 23045631.CS1 maint: несколько имен: список авторов (связь)
- ^ Изеддин I, Шпехт К.Г., Лелек М., Дарзак Х, Триллер А. и др. (2011). «Динамическая визуализация дендритных шипов сверхвысокого разрешения с использованием низкоаффинного фотопреобразователя актина». PLOS ONE. 6 (1): e15611. Bibcode:2011PLoSO ... 615611I. Дои:10.1371 / journal.pone.0015611. ЧВК 3022016. PMID 21264214.
- ^ Татаварты В, Ким Э, Родионов В, Ю Дж (2009). «Изучение динамики подкожного актина в нейронах гиппокампа крыс с помощью оптических изображений сверхвысокого разрешения». PLOS ONE. 4 (11): e7724. Дои:10.1371 / journal.pone.0007724. ЧВК 2771285. PMID 19898630.
внешняя ссылка
- Микроскопия сверхвысокого разрешения на образовательной странице Zeiss в области микроскопии и цифровой обработки изображений
- Фундаментальные концепции сверхвысокого разрешения в образовательных ресурсах Nikon для обучения микроскопии
- Эрик Бетциг и Харальд Хесс обсуждают: Развитие ЛАДОННОЙ микроскопии
- Выступление Сяовей Чжуана: микроскопия сверхвысокого разрешения
- Световая микроскопия: продолжающаяся современная революция (вводный обзор)












