Остеобласт - Osteoblast
| Остеобласт | |
|---|---|
 Остеобласты (фиолетовый) окаймляет костную спикулу (розовый - по диагонали изображения). В этой обычно фиксированной и декальцинированной (удаленной костным минералом) ткани остеобласты втянуты и отделены друг от друга и от подлежащего матрикса. В живой кости клетки связаны между собой узкие стыки и щелевые соединения и интегрирован с остеоцитами и матрицей. H&E пятно. | |
 Иллюстрация, показывающая одиночный остеобласт | |
| Подробности | |
| Место расположения | Кость |
| Функция | Формирование костная ткань |
| Идентификаторы | |
| Греческий | остеобласт |
| MeSH | D010006 |
| TH | H2.00.03.7.00002 |
| FMA | 66780 |
| Анатомические термины микроанатомии | |
Остеобласты (от Греческий комбинирование форм для "кость ", ὀστέο-, остео- и βλαστάνω, Blastanō "прорасти") клетки с одним ядро которые синтезируют кость. Однако в процессе формирование кости, остеобласты функционируют группами связанных клеток. Отдельные клетки не могут образовывать кость. Группа организованных остеобластов вместе с костью, образованной единицей клеток, обычно называется остеон.
Остеобласты - это специализированные, терминально дифференцированные продукты мезенхимальные стволовые клетки.[1] Они синтезируют плотные, сшитые коллаген и специализированные белки в гораздо меньших количествах, в том числе остеокальцин и остеопонтин, которые составляют органический матрикс кости.
В организованных группах связанных клеток остеобласты производят гидроксилапатит - в костный минерал, который строго регулируется, откладывается в органическую матрицу, образуя прочную и плотную минерализованная ткань - минерализованная матрица. Минерализованный скелет является главной опорой органов дыхания воздухом позвоночные. Это важный запас минералов для физиологических гомеостаз включая оба кислотно-щелочной баланс и кальций или же фосфат поддержание.[2][3]
Костная структура
В скелет это большой орган, который сформированный и деградированный на протяжении всей жизни у дышащих воздухом позвоночных. Скелет, часто называемый скелетной системой, важен как в качестве поддерживающей структуры, так и для поддержания кальция, фосфатов и кислотно-щелочной статус во всем организме.[4] Функциональная часть кости, костный матрикс, полностью внеклеточный. Костный матрикс состоит из белок и минеральная. Белок образует органическая матрица. Он синтезируется, а затем добавляется минерал. Подавляющее большинство органической матрицы коллаген, который обеспечивает предел прочности. Матрица минерализована отложением гидроксиапатита (альтернативное название гидроксилапатит). Этот минерал твердый и обеспечивает прочность на сжатие. Таким образом, коллаген и минерал вместе составляют композитный материал с отличной прочностью на растяжение и сжатие, которая может сгибаться под действием напряжения и восстанавливать свою форму без повреждений. Это называется упругая деформация. Силы, превышающие способность кости вести себя эластично, могут вызвать отказ, обычно переломы костей.
Ремоделирование костей
Кость - это динамическая ткань, которая постоянно изменена остеобластами, которые производят и секретируют матричные белки и транспортируют минералы в матрицу, и остеокласты, которые разрушают ткани.
Остеобласты
Остеобласты являются основным клеточным компонентом кости. Остеобласты возникают из мезенхимальные стволовые клетки (МСК). МСК дают начало остеобластам, адипоциты, и миоциты среди других типов клеток. Подразумевается, что количество остеобластов обратно пропорционально количеству адипоцитов костного мозга, которые включают жировая ткань костного мозга (ЖТК). Остеобласты в большом количестве встречаются в надкостница, тонкий слой соединительной ткани на внешней поверхности костей, а в эндост.
В норме почти весь костный матрикс при дыхании воздухом позвоночные, минерализуется остеобластами. Прежде чем органическая матрица минерализована, ее называют остеоид. Остеобласты, погребенные в матриксе, называются остеоциты. Во время формирования кости поверхностный слой остеобластов состоит из кубовидных клеток, называемых активные остеобласты. Когда костеобразующий элемент не синтезирует кость активно, поверхностные остеобласты уплощаются и называются неактивные остеобласты. Остеоциты остаются живыми и связаны клеточными отростками с поверхностным слоем остеобластов. Остеоциты играют важную роль в поддержании скелета.
Остеокласты
Остеокласты - это многоядерные клетки, которые происходят из гемопоэтических предшественников в костном мозге, которые также дают начало моноцитам в периферической крови.[5] Остеокласты разрушают костную ткань и вместе с остеобластами и остеоцитами образуют структурные компоненты кости. В полости внутри костей находятся многие другие типы клеток Костный мозг. Компоненты, которые необходимы для образования костной ткани остеобластов, включают мезенхимальные стволовые клетки (предшественник остеобластов) и кровеносный сосуд которые поставляют кислород и питательные вещества для формирования костей. Кость - это ткань с большим количеством сосудов, и активное образование клеток кровеносных сосудов, в том числе из мезенхимальных стволовых клеток, необходимо для поддержания метаболической активности кости. Баланс костеобразования и резорбция кости имеет тенденцию быть отрицательным с возрастом, особенно у женщин в постменопаузе,[6] часто приводит к потере кости, достаточно серьезной, чтобы вызвать переломы, что называется остеопороз.
Остеогенез
Кость образуется в результате одного из двух процессов: эндохондральная оссификация или же внутримембранозная оссификация. Эндохондральная оссификация - это процесс образования кости из хряща, и это обычный метод. Эта форма развитие костей является более сложной формой: она следует за формированием первого скелета хрящ сделан хондроциты, который затем удаляется и заменяется костью, образованной остеобластами. Внутримембранозное окостенение - это прямое окостенение мезенхима как это происходит при формировании мембранные кости черепа и другие.[7]
Во время остеобласта дифференциация, развивающиеся клетки-предшественники выразить нормативные фактор транскрипции Cbfa1 / Runx2. Второй необходимый фактор транскрипции - это Фактор транскрипции Sp7.[8] Остеохондропрогениторные клетки дифференцировать под влиянием факторы роста, хотя изолированные мезенхимальные стволовые клетки в культуре ткани могут также образовывать остеобласты в допустимых условиях, которые включают Витамин С и подложки для щелочная фосфатаза, ключ фермент что обеспечивает высокие концентрации фосфатов в месте отложения минералов.[1]
Костные морфогенетические белки
Ключевые факторы роста в дифференцировке эндохондрального скелета включают: костные морфогенетические белки (BMP), которые в значительной степени определяют, где происходит дифференцировка хондроцитов и где остаются промежутки между костями. Система замещения хряща костью имеет сложную регуляторную систему. BMP2 также регулирует раннюю структуру скелета. трансформирующий фактор роста бета (TGF-β), является частью суперсемейства белков, которые включают BMP, которые обладают общими сигнальными элементами в Путь передачи сигналов бета TGF. TGF-β особенно важен в хрящ дифференцировка, которая обычно предшествует образованию кости для эндохондральной оссификации. Дополнительным семейством важных регуляторных факторов является факторы роста фибробластов (FGF), которые определяют расположение элементов скелета по отношению к коже.
Стероидные и белковые гормоны
Многие другие регуляторные системы участвуют в переходе от хряща к кости и поддержании костей. Особенно важным гормональным регулятором, нацеленным на кости, является паратироидный гормон (ПТГ). Гормон паращитовидной железы - это белок, производимый паращитовидная железа железы под контролем сывороточной активности кальция.[3] ПТГ также выполняет важные системные функции, в том числе поддерживает почти постоянную концентрацию кальция в сыворотке крови независимо от потребления кальция. Повышение содержания кальция в рационе приводит к незначительному увеличению кальция в крови. Однако это не значительный механизм, поддерживающий образование костной ткани остеобластов, за исключением состояния с низким содержанием кальция в пище; кроме того, аномально высокий уровень кальция в рационе повышает риск серьезных последствий для здоровья, не связанных напрямую с костной массой, включая острое сердечно-сосудистое заболевание и Инсульт.[9] Прерывистая стимуляция ПТГ увеличивает активность остеобластов, хотя ПТГ является бифункциональным и опосредует деградацию костного матрикса при более высоких концентрациях.
Скелет также модифицируется для воспроизводства и в ответ на питание и другие гормон стрессы; он отвечает на стероиды, включая эстроген и глюкокортикоиды, которые важны для репродукции и регуляции энергетического обмена. Обмен костной ткани включает в себя большие затраты энергии на синтез и разложение, включая множество дополнительных сигналов, включая гипофиз гормоны. Два из них адренокортикотропный гормон (АКТГ)[10] и фолликулостимулирующего гормона.[11] Физиологическая роль ответов на эти и некоторые другие гликопротеин гормоны, до конца не изучен, хотя вполне вероятно, что АКТГ является бифункциональным, как ПТГ, поддерживая формирование кости с периодическими выбросами АКТГ, но вызывая разрушение кости в больших концентрациях. У мышей мутации, снижающие эффективность индуцированной АКТГ продукции глюкокортикоидов в надпочечниках, приводят к тому, что скелет становится плотным (остеосклеротический кость).[12][13]
Организация и ультраструктура
В хорошо сохранившейся кости, изученной при большом увеличении с помощью электронная микроскопия, отдельные остеобласты связаны между собой узкие стыки, которые предотвращают внеклеточной жидкости проход и таким образом создают костный компартмент, отдельный от общей внеклеточной жидкости.[14] Остеобласты также связаны между собой щелевые соединения, небольшие поры, которые соединяют остеобласты, позволяя клеткам одной когорты функционировать как единое целое.[15] Щелевые соединения также соединяют более глубокие слои ячеек с поверхностным слоем (остеоциты при окружении костью). Это было непосредственно продемонстрировано введением низкого молекулярный вес флуоресцентные красители в остеобласты и показывает, что краситель диффундирует в окружающие и более глубокие клетки костеобразующего элемента.[16] Кость состоит из многих таких единиц, которые разделены непроницаемыми зонами без клеточных связей, называемыми цементными линиями.
Коллаген и вспомогательные белки
Почти весь органический (неминеральный) компонент кости плотный. коллаген тип I,[17] который образует плотные сшитые веревки, придающие кости прочность на разрыв. По механизмам, до сих пор неясным, остеобласты секретируют слои ориентированного коллагена, причем слои, параллельные длинной оси кости, чередуются со слоями, расположенными под прямым углом к длинной оси кости каждые несколько секунд. микрометры. Дефекты коллагена I типа вызывают наиболее частое наследственное заболевание костей, называемое несовершенный остеогенез.[18]
Незначительное, но важное количество мелких белков, в том числе остеокальцин и остеопонтин, секретируются в органическом матриксе кости.[19] Остеокальцин не экспрессируется в значительных концентрациях, за исключением кости, и, таким образом, остеокальцин является специфическим маркером синтеза костного матрикса.[20] Эти белки связывают органический и минеральный компоненты костного матрикса.[21] Белки необходимы для максимальной прочности матрикса из-за их промежуточной локализации между минералом и коллагеном.
Однако у мышей, у которых экспрессия остеокальцина или остеопонтина была устранена путем целенаправленного нарушения соответствующих генов (нокаутные мыши ) накопление минерала не было заметно затронуто, что указывает на то, что организация матрицы не имеет существенного отношения к транспорту минерала.[22][23]
Кость против хряща
Примитивный скелет хрящ, твердая бессосудистая (без кровеносных сосудов) ткань, в которой отдельные клетки, секретирующие хрящевой матрикс, или хондроциты, происходить. Хондроциты не имеют межклеточных связей и не скоординированы в единицах. Хрящ состоит из сети коллаген тип II удерживается в напряжении за счет водопоглощающих белков, гидрофильных протеогликаны.[24] Это взрослый скелет в хрящевые рыбы Такие как акулы. Он развивается как начальный скелет в более продвинутых классы животных.
У дышащих воздухом позвоночных хрящ заменяется клетчатой костью. Переходная ткань минерализована хрящ. Хрящ минерализуется за счет массовой экспрессии ферментов, продуцирующих фосфаты, которые вызывают высокие локальные концентрации кальция и фосфата, которые выпадают в осадок.[24] Этот минерализованный хрящ не является плотным или прочным. У дышащих воздухом позвоночных он используется в качестве основы для образования клеточной кости, образованной остеобластами, а затем удаляется. остеокласты, которые специализируются на разложении минерализованных тканей.
Остеобласты образуют костный матрикс усовершенствованного типа, состоящий из плотных кристаллов неправильной формы. гидроксиапатит, упакованные вокруг коллагеновых веревок.[25] Это прочный композитный материал, позволяющий формировать каркас в основном в виде полых труб. Превращение длинных костей в трубы снижает вес, сохраняя при этом силу.
Минерализация кости
Механизмы минерализации до конца не изучены. Флуоресцентные низкомолекулярные соединения, такие как тетрациклин или же кальцеин при кратковременном применении прочно связывается с минералами костей. Затем они накапливаются узкими полосками в новой кости.[26] Эти полосы проходят через смежную группу остеобластов, образующих кость. Они возникают на узкой (суб-микрометр ) фронт минерализации. На большинстве поверхностей костей не происходит образования новой кости, поглощения тетрациклина и образования минералов. Это настоятельно предполагает, что облегченный или активный транспорт, координированная в группе, формирующей кость, участвует в формировании кости, и происходит только клеточно-опосредованное образование минералов. То есть диетический кальций не создает минералы массовым действием.
Механизм образования минералов в кости четко отличается от филогенетически более старый процесс минерализации хряща: тетрациклин не маркирует минерализованный хрящ в узких полосах или в определенных местах, а диффузно, в соответствии с механизмом пассивной минерализации.[25]
Остеобласты отделяют кость от внеклеточной жидкости плотными соединениями [14] регулируемым транспортом. В отличие от хряща, фосфат и кальций не может входить или выходить путем пассивной диффузии, потому что плотные соединения остеобластов изолировать пространство для образования кости. Кальций переносится через остеобласты облегченный транспорт (то есть пассивными переносчиками, которые не перекачивают кальций против градиента).[25] Напротив, фосфат активно продуцируется комбинацией секреции фосфатсодержащих соединений, включая АТФ, и по фосфатазы которые расщепляют фосфат, создавая высокую концентрацию фосфата на фронте минерализации. Щелочная фосфатаза представляет собой заякоренный в мембране белок, который является характерным маркером, экспрессирующимся в больших количествах на апикальной (секреторной) поверхности активных остеобластов.

Речь идет как минимум об еще одном регулируемом транспортном процессе. В стехиометрия костного минерала в основном состоит из гидроксиапатит осаждение из фосфата, кальция и воды в слабощелочной pH:[27]
6 HPO42− + 2 часа2O + 10 Ca2+ ⇌ Ca10(PO4)6(ОЙ)2 + 8 часов+В замкнутой системе по мере осаждения минералов кислота накапливается, быстро понижая pH и прекращение дальнейшего выпадения осадков. Хрящ не представляет собой барьера для диффузии, поэтому кислота диффундирует прочь, позволяя продолжаться осаждению. В остеоне, где матрикс отделен от внеклеточной жидкости плотными контактами, этого не может произойти. В контролируемом герметичном отсеке удаление H+ вызывает преципитацию в самых разных внеклеточных условиях, пока кальций и фосфат доступны в отсеке матрикса.[28] Механизм прохождения кислоты через барьерный слой остается неясным. Остеобласты обладают способностью к Na+/ЧАС+ обмен через резервные обменники Na / H, NHE1 и NHE6.[29] Это H+ обмен является основным элементом удаления кислоты, хотя механизм, с помощью которого H+ транспортируется из матричного пространства в барьерный остеобласт, неизвестно.
При удалении кости обратный транспортный механизм использует кислоту, доставляемую в минерализованный матрикс, для перевода гидроксиапатита в раствор.[30]
Обратная связь остеоцитов
Обратная связь от физической активности поддерживает костную массу, в то время как обратная связь от остеоцитов ограничивает размер костеобразующей единицы.[31] Важным дополнительным механизмом является секреция похороненными в матриксе остеоцитами склеростин, белок, который ингибирует метаболизм, поддерживающий активность остеобластов. Таким образом, когда остеон достигает предельного размера, он деактивирует синтез кости.[32]
Морфология и гистологическое окрашивание
Гематоксилин и эозин окрашивание (H&E) показывает, что цитоплазма активных остеобластов незначительно базофильный из-за значительного присутствия шероховатой эндоплазматической сети. Активный остеобласт производит значительное количество коллагена типа I. Около 10% костного матрикса составляет коллаген с остаточным минералом.[27] Ядро остеобласта округлое и крупное. Активный остеобласт морфологически характеризуется выраженным аппарат Гольджи который гистологически выглядит как прозрачная зона, прилегающая к ядру. Продукты клетки в основном предназначены для транспортировки в остеоид, неминерализованный матрикс. Активные остеобласты могут быть помечены антителами к Коллаген I типа, или используя нафтолфосфат и диазоний краситель быстро синий для демонстрации щелочной фосфатазы фермент деятельность напрямую.
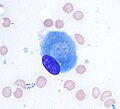
Остеобласт (окраска Райта Гимзы, 100x)

Световая микрофотография из декальцинированный губчатая кость, демонстрирующая остеобласты, активно синтезирующие остеоид, содержащий два остеоцита.
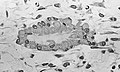
Световая микрофотография некальцинированной ткани, демонстрирующей остеобласты, активно синтезирующие остеоид (в центре).
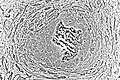
Световая микрофотография некальцинированной ткани, демонстрирующей остеобласты, активно синтезирующие рудиментарную костную ткань (в центре).
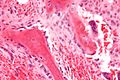
Остеобласты, выстилающие кость (окраска H&E).
Выделение остеобластов
- Первый метод выделения методом микродиссекции был первоначально описан Fell et al.[33] с использованием костей конечностей цыпленка, которые были разделены на надкостницу и оставшиеся части. Она получила клетки, обладающие остеогенными характеристиками, из культивированной ткани с использованием костей конечностей цыпленка, которые были разделены на надкостницу и оставшиеся части. Она получила клетки, которые обладали остеогенными характеристиками из культивированной ткани.
- Ферментативное расщепление - один из самых передовых методов выделения популяций костных клеток и получения остеобластов. Peck et al. (1964)[34] описал оригинальный метод, который сейчас часто используют многие исследователи.
- В 1974 г. Джонс и др.[35] обнаружили, что остеобласты перемещаются латерально in vivo и in vitro в различных экспериментальных условиях, и подробно описали метод миграции. Однако остеобласты были загрязнены клетками, мигрирующими из сосудистых отверстий, которые могли включать эндотелиальные клетки и фибробласты.
Смотрите также
Рекомендации
- ^ а б Питтенгер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Д.Д., Мурман М.А., Симонетти Д.В., Крейг С., Маршак Д.Р. (апрель 1999 г.). «Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека». Наука. 284 (5411): 143–7. Bibcode:1999Научный ... 284..143П. Дои:10.1126 / science.284.5411.143. PMID 10102814.
- ^ Арнетт Т (2003). «Регулирование функции костных клеток за счет кислотно-щелочного баланса». Proc Nutr Soc. 62: 511–20. Дои:10,1079 / пнс2003268. PMID 14506899.
- ^ а б Блэр ХК, Заиди М., Хуанг Х.Л., Сун Л. (ноябрь 2008 г.). «Онтогенетическая основа дифференциации скелетных клеток и молекулярная основа основных дефектов скелета». Биол Рев Камб Филос Соц. 83 (4): 401–15. Дои:10.1111 / j.1469-185X.2008.00048.x. PMID 18710437.
- ^ Блэр ХК, Сан Л., Кохански Р.А. (ноябрь 2007 г.). «Сбалансированное регулирование пролиферации, роста, дифференциации и деградации в скелетных клетках». Анна. Акад. Наука. 1116 (1): 165–73. Bibcode:2007НЯСА1116..165Б. Дои:10.1196 / летопись.1402.029. PMID 17646258.
- ^ Loutit, J.F .; Nisbet, N.W. (Январь 1982 г.). «Происхождение остеокластов». Иммунобиология. 161 (3–4): 193–203. Дои:10.1016 / S0171-2985 (82) 80074-0. PMID 7047369.
- ^ Никс К.М., Фаулер Т.В., Гэдди Д. (июнь 2010 г.). «Репродуктивные гормоны и кость». Curr Osteoporos Rep. 8 (2): 60–7. Дои:10.1007 / s11914-010-0014-3. PMID 20425612.
- ^ Ларсен, Уильям Дж. (2001). Эмбриология человека (3-е изд.). Филадельфия, Пенсильвания: Черчилль Ливингстон. стр.355 –357. ISBN 0-443-06583-7.
- ^ Карсенти Г (2008). «Транскрипционный контроль скелетогенеза». Анну Рев Геном Хум Генет. 9: 183–96. Дои:10.1146 / annurev.genom.9.081307.164437. PMID 18767962.
- ^ Рейд И. Р., Бристоу С. М., Болланд М. Дж. (Апрель 2015 г.). «Сердечно-сосудистые осложнения от приема препаратов кальция». J. Cell. Биохим. 116 (4): 494–501. Дои:10.1002 / jcb.25028. PMID 25491763.
- ^ Заиди М., Сун Л., Робинсон Л.Дж., Туркова И.Л., Лю Л., Ван Й., Чжу Л.Л., Лю Х, Ли Дж., Пэн Й., Ян Г, Ши Х, Левин А., Икбал Дж., Ярославский Б.Б., Исалес С., Блэр ХК (Май 2010 г.). «АКТГ защищает от вызванного глюкокортикоидами остеонекроза костей». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 107 (19): 8782–7. Bibcode:2010PNAS..107.8782Z. Дои:10.1073 / pnas.0912176107. ЧВК 2889316. PMID 20421485.
- ^ Sun L, Peng Y, Sharrow AC, Iqbal J, Zhang Z, Papachristou DJ, Zaidi S, Zhu LL, Yaroslavskiy BB, Zhou H, Zallone A, Sairam MR, Kumar TR, Bo W, Braun J, Cardoso-Landa L, Шаффлер МБ, Мунга Б.С., Блэр Х.С., Заиди М. (апрель 2006 г.). «ФСГ напрямую регулирует костную массу». Клетка. 125 (2): 247–60. Дои:10.1016 / j.cell.2006.01.051. PMID 16630814.
- ^ Хукстра М., Меурс И., Кендерс М., Аут Р., Хильдебранд РБ, Круйт Дж. К., Ван Эк М, Ван Беркель Т. Дж. (Апрель 2008 г.). «Отсутствие захвата холестерилового эфира ЛПВП у мышей посредством SR-BI нарушает адекватную реакцию на стресс, опосредованную глюкокортикоидами надпочечников, на голодание». J. Lipid Res. 49 (4): 738–45. Дои:10.1194 / мл. M700475-JLR200. PMID 18204096.
- ^ Мартино С., Мартин-Фальстралт Л., Бриссет Л., Моро Р. (январь 2014 г.). «Модель атерогенных мышей с нулевым Scarb1 показывает фенотип с высокой костной массой». Являюсь. J. Physiol. Эндокринол. Метаб. 306 (1): E48–57. Дои:10.1152 / ajpendo.00421.2013. ЧВК 3920004. PMID 24253048.
- ^ а б Арана-Чавес В.Э., Соарес А.М., Катчбуриан Э. (август 1995 г.). «Соединения между рано развивающимися остеобластами свода черепа крысы, выявленные с помощью замораживания-перелома и электронной микроскопии ультратонких срезов». Arch. Histol. Цитол. 58 (3): 285–92. Дои:10.1679 / aohc.58.285. PMID 8527235.
- ^ Доти С.Б. (1981). «Морфологические свидетельства щелевых контактов между костными клетками». Calcif. Tissue Int. 33 (5): 509–12. Дои:10.1007 / BF02409482. PMID 6797704.
- ^ Yellowley CE, Li Z, Zhou Z, Jacobs CR, Donahue HJ (февраль 2000 г.). «Функциональные щелевые соединения между остеоцитарными и остеобластическими клетками». J. Bone Miner. Res. 15 (2): 209–17. Дои:10.1359 / jbmr.2000.15.2.209. PMID 10703922.
- ^ Редди А.Х., Гей Р., Гей С., Миллер Э.Д. (декабрь 1977 г.). «Переходы в типах коллагена во время индуцированного матрицей образования хряща, кости и костного мозга». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 74 (12): 5589–92. Bibcode:1977ПНАС ... 74.5589R. Дои:10.1073 / пнас.74.12.5589. ЧВК 431820. PMID 271986.
- ^ Kuivaniemi H, Tromp G, Prockop DJ (апрель 1991). «Мутации в генах коллагена: причины редких и некоторых распространенных заболеваний человека». FASEB J. 5 (7): 2052–60. Дои:10.1096 / fasebj.5.7.2010058. PMID 2010058.
- ^ Обен Дж. Э., Лю Ф., Малавал Л., Гупта А. К. (август 1995 г.). «Дифференциация остеобластов и хондробластов». Кость. 17 (2 Прил.): 77S – 83S. Дои:10.1016 / 8756-3282 (95) 00183-Е. PMID 8579903.
- ^ Дельмас П.Д., Демио Б., Малавал Л., Шапуи М.С., Менье П.Дж. (апрель 1986 г.). «[Остеокальцин (или костный gla-белок), новый биологический маркер для изучения костной патологии]». Пресс Мед (На французском). 15 (14): 643–6. PMID 2939433.
- ^ Roach HI (июнь 1994 г.). «Почему костный матрикс содержит неколлагеновые белки? Возможная роль остеокальцина, остеонектина, остеопонтина и костного сиалопротеина в минерализации и резорбции кости». Cell Biol. Int. 18 (6): 617–28. Дои:10.1006 / cbir.1994.1088. PMID 8075622.
- ^ Боски А.Л., Гадалета С., Гундберг С., Доти С.Б., Дуси П., Карсенти Г. (сентябрь 1998 г.). «Инфракрасный микроскопический спектроскопический анализ с преобразованием Фурье костей мышей с дефицитом остеокальцина дает представление о функции остеокальцина». Кость. 23 (3): 187–96. Дои:10.1016 / с8756-3282 (98) 00092-1. PMID 9737340.
- ^ Тернер П.Дж., Чен К.Г., Ионова-Мартин С., Сан Л., Харман А., Портер А., Агер Дж. В., Ричи Р. О., Аллистон Т. (июнь 2010 г.). «Дефицит остеопонтина увеличивает хрупкость костей, но сохраняет костную массу». Кость. 46 (6): 1564–73. Дои:10.1016 / j.bone.2010.02.014. ЧВК 2875278. PMID 20171304.
- ^ а б Блэр ХК, Заиди М., Шлезингер PH (июнь 2002 г.). «Механизмы, уравновешивающие синтез и деградацию скелетного матрикса». Biochem. J. 364 (Pt 2): 329–41. Дои:10.1042 / BJ20020165. ЧВК 1222578. PMID 12023876.
- ^ а б c Блэр ХК, Робинсон Л.Дж., Хуанг Х.Л., Сан Л., Фридман П.А., Шлезингер Ф.Х., Заиди М. (2011). «Кальций и болезни костей». БиоФакторы. 37 (3): 159–67. Дои:10.1002 / биоф.143. ЧВК 3608212. PMID 21674636.
- ^ Фрост HM (1969). «Гистологический анализ ремоделирования кости на основе тетрациклинов». Calcif Tissue Res. 3 (1): 211–37. Дои:10.1007 / BF02058664. PMID 4894738.
- ^ а б Нойман В.Ф., Нойман М.В. (1958-01-01). Химическая динамика костного минерала. Издательство Чикагского университета. ISBN 0-226-57512-8.[страница нужна ]
- ^ Schartum S, Николс G (май 1962 г.). «Относительно градиентов pH между внеклеточным компартментом и жидкостями, омывающими минеральную поверхность кости, и их связи с распределением ионов кальция». J. Clin. Вкладывать деньги. 41 (5): 1163–8. Дои:10.1172 / JCI104569. ЧВК 291024. PMID 14498063.
- ^ Лю Л., Шлезингер PH, Slack NM, Friedman PA, Blair HC (июнь 2011 г.). «Высокая активность обмена Na + / H + в минерализующих остеобластах». J. Cell. Физиол. 226 (6): 1702–12. Дои:10.1002 / jcp.22501. ЧВК 4458346. PMID 21413028.
- ^ Блэр Х.С., Тейтельбаум С.Л., Гизелли Р., Глюк С. (август 1989 г.). «Остеокластическая резорбция кости с помощью поляризованного вакуолярного протонного насоса». Наука. 245 (4920): 855–7. Bibcode:1989Научный ... 245..855B. Дои:10.1126 / science.2528207. PMID 2528207.
- ^ Klein-Nulend J, Nijweide PJ, Burger EH (июнь 2003 г.). «Остеоцит и костная структура». Curr Osteoporos Rep. 1 (1): 5–10. Дои:10.1007 / s11914-003-0002-у. PMID 16036059.
- ^ Барон, Роланд; Равади, Жорж; Роман-Роман, Серджио (2006). «Сигнализация WNT: ключевой регулятор костной массы». Актуальные темы биологии развития. 76. С. 103–127. Дои:10.1016 / S0070-2153 (06) 76004-5. ISBN 978-0-12-153176-8. PMID 17118265.
- ^ Упал, HB (январь 1932 г.). «Остеогенная способность in vitro надкостницы и эндоста, выделенных из скелета конечностей эмбрионов птиц и молодых цыплят». Журнал анатомии. 66 (Pt 2): 157–180.11. ЧВК 1248877. PMID 17104365.
- ^ Peck, W. A .; Birge, S.J .; Федак, С. А. (11 декабря 1964 г.). «Костные клетки: биохимические и биологические исследования после выделения ферментов». Наука. 146 (3650): 1476–1477. Bibcode:1964Научный ... 146.1476П. Дои:10.1126 / science.146.3650.1476. PMID 14208576.
- ^ Джонс, С.Дж .; Бойд, А. (декабрь 1977 г.). «Некоторые морфологические наблюдения за остеокластами». Исследования клеток и тканей. 185 (3): 387–97. Дои:10.1007 / bf00220298. PMID 597853.
дальнейшее чтение
- Уильям Ф. Нойман и Маргарет В. Нойман. (1958). Химическая динамика костного минерала. Чикаго: Издательство Чикагского университета. ISBN 0-226-57512-8.
- Неттер, Фрэнк Х. (1987). Костно-мышечная система: анатомия, физиология и нарушения обмена веществ. Саммит, Нью-Джерси: Ciba-Geigy Corporation ISBN 0-914168-88-6.





