Магнитно-резонансная спектроскопия in vivo - In vivo magnetic resonance spectroscopy
Эта статья нужны дополнительные цитаты для проверка. (Май 2010 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Магнитно-резонансная спектроскопия in vivo (Г-ЖА) - это специализированный метод, связанный с магнитно-резонансная томография (МРТ).[1][2]
Магнитно-резонансная спектроскопия (MRS), также известная как спектроскопия ядерного магнитного резонанса (ЯМР), представляет собой неинвазивный аналитический метод без ионизирующего излучения, который использовался для изучения метаболических изменений в опухоли головного мозга, удары, захват расстройства, Болезнь Альцгеймера, депрессия, и другие заболевания, поражающие мозг. Он также использовался для изучения метаболизма других органов, таких как мышцы. В случае мышц ЯМР используется для измерения внутримиоцеллюлярные липиды контент (IMCL).[3]
Магнитно-резонансная спектроскопия - это аналитический метод, который можно использовать в дополнение к более распространенной магнитно-резонансной томографии (МРТ) при характеристике ткани. Оба метода обычно получают сигнал от протонов водорода (также используются другие эндогенные ядра, такие как ядра углерода, азота и фосфора), но МРТ получает сигнал в основном от протонов, которые находятся в воде и жире, которых примерно в тысячу раз больше, чем молекулы, обнаруженные с помощью MRS. В результате MRI часто использует больший доступный сигнал для получения очень чистых 2D-изображений, тогда как MRS очень часто получает сигнал только из одной локализованной области, называемой «вокселем». MRS можно использовать для определения относительных концентраций и физических свойств различных биохимических веществ, часто называемых «метаболитами» из-за их роли в метаболизм.
Получение данных
Получение сканирования MRS очень похоже на сканирование MRI с несколькими дополнительными шагами, предшествующими получению данных. Эти шаги включают:
- Шиммирование магнитного поля: этот шаг предпринимается для коррекции неоднородности магнитного поля путем настройки различных импульсов в направлениях x, y и z. Этот шаг обычно автоматизирован, но его можно выполнить вручную.
- Подавление сигнала воды: поскольку молекулы воды содержат водород, а относительная концентрация воды по отношению к метаболитам составляет около 10 000: 1, сигнал воды часто подавляется или пики метаболитов не будут различимы в спектрах. Это достигается за счет добавления импульсов подавления воды. Последние достижения позволяют протонному MRS без подавления воды.[4]
- Выбор спектроскопической техники: тщательное планирование измерений важно в контексте конкретного эксперимента.
- Спектроскопия одного вокселя (SVS): имеет минимальное пространственное разрешение примерно 1 см3, и имеет самый чистый спектр, свободный от нежелательных артефактов из-за небольшого приобретенного объема, что приводит к легкой регулировке и меньшему количеству нежелательных сигналов извне вокселя.
- Магнитно-резонансная спектроскопическая визуализация (MRSI): 2-мерный (или 3-мерный) метод MRS, который использует направления двух / трех фазового кодирования для создания двух / трехмерной карты спектров. Недостатки этого метода заключаются в том, что для двух / трех направлений фазового кодирования требуется длительное время сканирования, а больший объем сбора с большей вероятностью приведет к появлению артефактов из-за более слабого шиммирования, неподавленной воды, а также присущих грех функция распределения точки из-за конечной выборки k-пространства, которая приводит к просачиванию сигнала от одного вокселя во все остальные.
Количественная оценка данных
Во время сбора данных сканирование получает необработанные данные в виде спектров. Эти необработанные данные должны быть количественно определены для достижения значимого понимания спектра. Эта количественная оценка достигается с помощью линейной комбинации.[5] Линейная комбинация - это метод, в котором используются базовые наборы. Базовые наборы представляют собой преобразованные спектральные формы (т.е. смещенные, расширенные, фазированные), полученные с помощью численного моделирования или экспериментально измеренные в фантомах. С базовыми наборами исходные данные теперь можно количественно оценить как измеренные концентрации различных химических веществ. Для этого используется программное обеспечение. LCModel, коммерческое программное обеспечение, на протяжении большей части своей истории было стандартным пакетом количественной оценки программного обеспечения. Однако сейчас существует множество бесплатных пакетов для количественной оценки: AMARES, AQSES, Gannet, INSPECTOR, jMRUI, TARQUIN и другие.[5]
Перед линейной комбинацией для количественной оценки данных использовалось извлечение пиков. Однако это больше не популярно и не рекомендуется.[5] Извлечение пиков - это метод, который объединяет область под сигналом. Несмотря на кажущуюся простоту, у этой техники есть несколько недостатков. В основном, индивидуальные используемые лоренцевы формы не масштабируются для соответствия сложности спектральных форм J-связанных метаболитов и слишком просты, чтобы различить перекрывающиеся пики.[5]
Последовательности импульсов
Подобно МРТ, MRS использует последовательности импульсов для получения сигнала от нескольких разных молекул, чтобы генерировать спектры вместо изображения. В MRS используются два основных метода последовательности импульсов - STEAM (метод захвата стимулированного эхо) и PRESS (точечная спектроскопия). С точки зрения преимуществ STEAM лучше всего подходит для визуализации метаболитов с более коротким T2 и более низким SAR, в то время как PRESS имеет более высокий SNR, чем STEAM. Помимо ПАРА и ПРЕССЫ как основных последовательностей, используемых в in vivo магнитно-резонансная спектроскопия, наблюдаются адиабатические импульсы. Адиабатические импульсы производят равномерные углы переворота при экстремальном B1 неоднородность. Таким образом, эти последовательности позволяют добиться возбуждения, которое достигает искомого B1 нечувствительность и нерезонансность РЧ катушки и объекта выборки. В частности, адиабатические импульсы решают проблему пропадания сигнала, исходящего от различных B1 диаграммы направленности, возникающие в результате использования поверхностных передающих катушек и использования обычных импульсов.[6] Адиабатические импульсы также полезны для ограничения пиковой мощности РЧ для возбуждения и снижения нагрева ткани.
Последовательности пространственной локализации
В PRESS двумя основными недостатками являются длительное время эхо-сигнала (TE) и артефакты химического сдвига (CSD).[7] Длительное время эха возникает из-за того, что PRESS использует два импульса 180 °, в отличие от STEAM, который использует только импульсы 90 °. Длительность 180-градусных импульсов обычно больше, чем 90-градусных, потому что для полного изменения вектора суммарной намагниченности требуется больше энергии, чем только 90-градусная. Артефакты смещения химического сдвига частично возникают из-за менее оптимальных профилей выбора срезов. Множественные импульсы 180 ° не позволяют получить очень короткий TE, что приводит к менее оптимальному профилю выбора срезов. Кроме того, несколько импульсов 180 ° означают меньшую ширину полосы и, следовательно, большее смещение химического сдвига. В частности, артефакты смещения химического сдвига возникают из-за того, что сигналы с разными химическими сдвигами подвергаются различным выборкам срезов с кодированием частоты и, таким образом, не происходят из одного и того же объема. Кроме того, этот эффект усиливается при более высокой напряженности магнитного поля.
SPECIAL состоит из пространственно-селективного импульса инверсии предварительного возбуждения (обычно AFP), за которым следуют пространственно-селективные импульсы возбуждения и перефокусировки, оба из которых обычно являются SLR или усеченными синк-импульсами.[5]
SPECIAL - это гибрид PRESS и Image-Selected In vivo Spectroscopy (ISIS). ISIS обеспечивает пространственную локализацию в трех пространственных измерениях с помощью серии из восьми избирательных срезов прединверсионных импульсов, которые могут быть соответствующим образом расположены так, чтобы сумма восьми циклов удаляла весь сигнал за пределами желаемой трехмерной области.[5] SPECIAL получает пространственную локализацию только из одного измерения с помощью импульсов инверсии перед возбуждением (циклически включаются и выключаются через каждое второе время повторения [TR]), что делает его двухцикловой последовательностью.
Использование преинверсионного импульса для удаления одного импульса перефокусировки (по сравнению с PRESS) - это то, что позволяет SPECIAL достичь короткого TE, достигающего минимум 2,2 мс на доклиническом сканере в мозге крысы, при этом имея возможность восстановить полный сигнал и низкий, как 6 мсек на клиническом сканере 3T.[5]
Самый большой недостаток SPECIAL и SPECIAL-sLASER заключается в том, что они представляют собой двухцикловые схемы, и систематические изменения между циклами будут проявляться в их различном спектре. Загрязнение липидов является особенно большой проблемой для SPECIAL и решается тремя разными способами.
Первый - через OVS, который уменьшит загрязнение липидными сигналами, исходящими извне воксела, хотя это происходит за счет увеличения SAR. Во-вторых, не устанавливать амплитуду импульса инверсии предварительного возбуждения равной нулю для каждого другого TR, а вместо этого сдвигать положение этой плоскости ISIS так, чтобы возбужденный объем для состояния выключения находился вне объекта. Было показано, что это значительно снижает липидное загрязнение, предположительно возникающее из-за взаимодействия между RF-импульсом и липидными компартментами из-за неполной релаксации, переноса намагниченности или гомоядерного эффекта Оверхаузера, хотя точный механизм остается неизвестным.[5] Третий - использовать эхо-планарный считыватель, который сбрасывает фазу намагниченности извне вокселя, что также существенно снижает липидные артефакты. Все три метода можно комбинировать для преодоления липидного загрязнения.[5]
Использует
MRS позволяет врачам и исследователям получать биохимический информация о ткани из тело человека неинвазивным способом (без необходимости биопсия ), тогда как МРТ дает им информацию только о структуре тела (распределении воды и жира).[8]
Например, тогда как МРТ может использоваться для помощи в диагностике рак, MRS потенциально может быть использован для получения информации об агрессивности опухоли.[9] Кроме того, поскольку многие патологии кажутся похожими на диагностической визуализации (например, радиационно-индуцированный некроз и рецидив опухоли после лучевой терапии), в будущем MRS может использоваться для помощи в различении похожих прогнозов.
Оборудование MRS можно настраивать (как радио приемник) для приема сигналов от разных химические ядра внутри тела. Наиболее распространенные ядра, подлежащие изучению: протоны (водород ), фосфор, углерод, натрий и фтор.
Типы биохимических веществ (метаболиты ), которые можно изучить, включают холин -содержащие соединения (которые используются для получения клетка мембраны), креатин (химическое вещество, участвующее в энергетике метаболизм ), инозитол и глюкоза (обе сахара ), N-ацетиласпартат, и аланин и лактат которые повышены в некоторых опухолях.
В настоящее время MRS в основном используется как инструмент ученые (например. медицинские физики и биохимики ) за медицинские исследования проектов, но становится ясно, что он также может дать врачи полезный клинический информации, особенно с открытием того, что ее можно использовать для исследования концентрации альфа-гидроксиглутаровая кислота, который присутствует только в IDH1 и IDH2 мутировавший глиомы, что изменяет назначенную схему лечения.
MRS в настоящее время используется для расследования ряда болезни в тело человека, в первую очередь рак (в мозг, грудь и предстательная железа ), эпилепсия, Болезнь Альцгеймера, болезнь Паркинсона, и Хорея Хантингтона. MRS использовался для диагностики туберкулеза гипофиза.[10]
Рак простаты: В сочетании с магнитно-резонансной томографией (МРТ) и с одинаковыми результатами трехмерная МРС может прогнозировать распространенность злокачественного перерождения ткани простаты примерно на 90%. Комбинация обоих методов может быть полезной при планировании биопсии и лечения простаты, а также для контроля успешности лечения.[11]
Пример
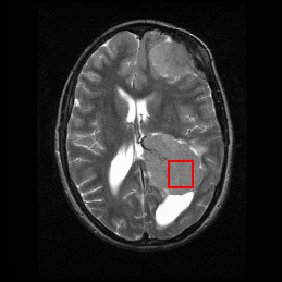
Ниже показано МРТ-сканирование мозга (в осевой плоскость, которая разрезает спереди назад и из стороны в сторону через голова ) с опухолью головного мозга (менингиома ) в правом нижнем углу. Красный прямоугольник показывает интересующий объем, из которого химическая информация была получена с помощью MRS (куб со сторонами 2 см, который образует квадрат при пересечении среза толщиной 5 мм на снимке MRI).
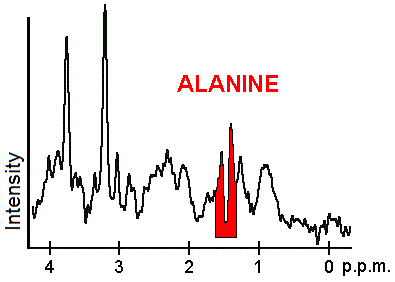
У каждого биохимического вещества или метаболита есть свой пик в спектре, который появляется на известной частоте. Пики, соответствующие аминокислоте аланин, выделены красным (1,4 ppm). Это пример той биохимической информации, которая может помочь врачам диагноз. Другие отмеченные метаболиты: холин (3,2 частей на миллион) и креатин (3,0 частей на миллион).
Приложения MRS
| Метаболит | Главный химический сдвиг (ppm) | Функция | Приложения in vivo MRS | Клинические применения |
|---|---|---|---|---|
| N-ацетил аспартат (NAA)[12] | 2.01 |
| Маркер нейрональной плотности Маркер концентрации |
|
| N-ацетил аспартилглутамат (NAAG)[13] | 2.04 |
| Сумма NAA и NAAG обеспечивает надежную оценку молекул, содержащих NAA. |
|
| Аденозинтрифосфат (АТФ)[14] | 4.20 - 4.80, 6.13, 8.22 |
| Обычно обнаруживается с помощью 31P ЯМР спектроскопия, более трудная для обнаружения 1H ЯМР спектроскопия |
|
| Аланин (Ала)[15] | 1.40 |
| Никто |
|
| γ-аминомасляная кислота (ГАМК)[16] | 3.00 |
| Никто |
|
| Аскорбиновая кислота (Asc - витамин C)[17] | 4.49 |
| Мишень для гиперполяризованных 13Приложения C для изображения окислительно-восстановительного статуса in vivo |
|
| Аспарагиновая кислота (Asc)[18] | 3.89 |
| Никто |
|
| Карнитин[19] | 3.21 |
| Никто |
|
| Карнозин[20] | 7.09 |
| Неинвазивный метод измерения внутриклеточного pH с помощью 1H ЯМР in vivo |
|
| Холинсодержащие соединения (tCho)[21] | 3.20 |
| Никто |
|
| Лимонная кислота | 2.57, 2.72 |
| Никто |
|
| Креатин (Cr) и фосфокреатин (PCr)[22] | 3.03 |
| Никто |
|
| Дезоксимиоглобин (DMb)[23] | 79.00 |
| Никто |
|
| Глюкоза (Glc)[24] | 5.22 |
| Общая цель в 13Приложения C для изучения метаболических путей |
|
| Глутамат (Glu)[25] | 2.20 - 2.40 |
| Разделение глутамата и глутамина становится ненадежным, хотя сумма (Glx) может быть определена количественно с высокой точностью. |
|
| Глютамин (Gln)[26] | 2.20 - 2.40 |
| Разделение глутамата и глутамина становится ненадежным, хотя сумма (Glx) может быть определена количественно с высокой точностью. |
|
| Глутатион (GSH)[27] | 3.77 |
| Никто |
|
| Глицерин[28] | 3.55, 3.64, 3.77 |
| Трудно наблюдать в 1Спектры ЯМР 1Н из-за уширения линий |
|
| Глицин[29] | 3.55 |
| Никто |
|
| Гликоген[30] | 3.83 |
| Обычно наблюдается в 13C ЯМР, но остается неуловимым в 1H ЯМР |
|
| Гистидин[31] | 7.10, 7.80 |
| Установите внутриклеточный pH в 1H ЯМР |
|
| Гомокарнозин[32] | 7.10, 8.10, 3.00 - 4.50 |
| Хороший выбор для мониторинга pH in vivo Из-за перекрытия между резонансами ГАМК и гомокарнозина, резонанс ГАМК H-4 при 3,01 м.д. представляет собой «общую ГАМК», представляющую сумму ГАМК и гомокарнозина. |
|
| β-гидроксибутират (BHB)[33] | 1.19 |
| Никто |
|
| 2-гидроксиглутарат (2HG)[34] | 1.90 |
| Никто |
|
| мио-Инозитол (mI)[35] | 3.52 |
| Никто |
|
| Scyllo-Инозитол (sI)[36] | 3.34 |
| Никто |
|
| Лактат (Lac)[37] | 1.31 |
| Никто |
|
| Липиды[38] | 0.9 - 1.5 |
| Высокое содержание липидов - одна из основных причин 1H ЯМР за пределами мозга нашел ограниченное применение |
|
| Макромолекулы[39] | 0,93 (MM1), 1,24 (MM2), 1,43 (MM3), 1,72 (MM4), 2,05 (MM5), 2,29 (MM6), 3,00 (MM7), 3,20 (MM8), 3,8 - 4,0 (MM9), 4,3 (MM10) ) |
| Значительная часть наблюдаемого сигнала - это макромолекулярные резонансы, лежащие в основе остальных метаболитов. Короткий T2 постоянные времени релаксации эффективно устраняют макромолекулярные резонансы из-за длительного эхо-времени 1Спектры ЯМР 1Н Разница в T1 релаксация между метаболитами и макромолекулами используется для уменьшения вклада экстракраниального липидного сигнала |
|
| Никотинамид аденин динуклеотид (НАД+)[40] | 9.00 |
| 31P ЯМР позволяет обнаруживать как НАД+ и НАДН, а 1H ЯМР не позволяет обнаружить НАДН |
|
| Фенилаланин[41] | 7.30 - 7.45 |
| Никто |
|
| Пируват[42] | 2.36 |
| Только соединение, одобренное FDA для гиперполяризованных 13C ЯМР |
|
| Серин[43] | 3.80 - 4.00 |
| Никто |
|
| Таурин (тау)[44] | 3.25, 3.42 |
| Никто |
|
| Треонин (Thr)[45] | 1.32 |
| Никто |
|
| Триптофан (Trp)[46] | 7.20, 7.28 |
| Никто |
|
| Тирозин (Тир)[47] | 6.89 - 7.19 |
| Никто |
|
| Вода[48] | 4.80 |
| Ссылка на внутреннюю концентрацию Химический сдвиг воды, используемый для неинвазивного обнаружения изменений температуры in vivo |
|
В 1H Магнитно-резонансная спектроскопия. Каждый протон можно визуализировать с определенным химическим сдвигом (положение пика вдоль оси x) в зависимости от его химического окружения. Этот химический сдвиг продиктован соседними протонами внутри молекулы. Таким образом, метаболиты можно охарактеризовать своим уникальным набором 1H химические сдвиги. Метаболиты, которые исследует MRS, известны (1H) химические сдвиги, которые ранее были идентифицированы в спектрах ЯМР. Эти метаболиты включают:
- N-ацетил аспартат (NAA): с его основным резонансным пиком 2,02 ppm, снижение уровней NAA указывает на потерю или повреждение нейрональной ткани, что является результатом многих типов повреждений мозга. Его присутствие в нормальных условиях указывает на целостность нейронов и аксонов.
- Холин: известно, что холин, с его основным пиком в 3,2 частей на миллион, связан с обновлением мембран или увеличением деления клеток. Повышенный холин указывает на увеличение производства клеток или разрушение мембран, что может указывать на демиелинизацию или наличие злокачественных опухолей.
- Креатин и фосфокреатин: креатин с пиком в 3,0 промилле отмечает метаболизм энергии мозга. Постепенная потеря креатина в сочетании с другими основными метаболитами указывает на гибель тканей или основных клеток в результате болезни, травмы или отсутствия кровоснабжения. Повышение концентрации креатина может быть реакцией на черепно-мозговую травму. Отсутствие креатина может указывать на редкое врожденное заболевание.
- Липиды: с их основными алифатическими пиками, расположенными в диапазоне 0,9–1,5 ppm, наблюдается увеличение липидов, что также указывает на некроз. Эти спектры легко загрязняются, поскольку липиды присутствуют не только в головном мозге, но и в других биологических тканях, таких как жир в коже черепа и области между скальпом и черепом.
- Лактат: Представляет собой систему AX3, которая дает дублет (два симметричных пика) с центром около 1,31 ppm и квартет (четыре пика с относительной высотой пика 1: 2: 2: 1) с центром около 4,10 ppm. Дублет при 1,31 ч. / Млн обычно определяется количественно, поскольку квартет может быть подавлен за счет водонасыщения или скрыт остаточной водой. У здоровых людей лактат не виден, так как его концентрация ниже предела обнаружения MRS; однако наличие этого пика указывает на гликолиз был инициирован в среде с дефицитом кислорода. Несколько причин этого включают: ишемия, гипоксия, митохондриальные нарушения, и некоторые виды опухолей.
- Мио-инозитол: с его основным пиком на уровне 3,56 частей на миллион, повышение уровня мио-инозита нарушается у пациентов с болезнью Альцгеймера, деменцией и ВИЧ.
- Глутамат и глутамин: эти аминокислоты отмечены серией резонансных пиков от 2,2 до 2,4 частей на миллион. Гипераммониемия, печеночная энцефалопатия - это два основных состояния, которые приводят к повышению уровня глутамина и глутамата. MRS, используемый в сочетании с MRI или другими методами визуализации, может использоваться для обнаружения изменений в концентрациях этих метаболитов или значительно аномальных концентраций этих метаболитов.
- ГАМК может быть обнаружен в первую очередь по его пикам при примерно 3,0 ppm, однако, поскольку креатин имеет сильный синглет при 3,0 ppm с примерно 20-кратной амплитудой, метод, который использует J-муфта необходимо использовать для точного количественного определения ГАМК. Наиболее распространенными методами для этого являются редактирование J-разницы (MEGA) или J-разрешение (как используется в JPRESS).
- Глутатион также может быть обнаружен по его пику при пике 3,0 частей на миллион, однако, как и ГАМК, он также должен использовать метод, который использует J-муфта чтобы удалить наложенный сигнал креатина.
Ограничения MRS
Основным ограничением MRS является его низкий доступный сигнал из-за низкой концентрации метаболитов по сравнению с водой. По сути, он имеет плохое временное и пространственное разрешение. Тем не менее, ни один альтернативный метод не может количественно оценить метаболизм in vivo неинвазивно, и поэтому MRS остается ценным инструментом для исследований и ученых-клиницистов.
Непротонный (1H) МИССИС
31Магнитно-резонансная спектроскопия фосфора
1Клинический успех H MRS может соперничать только с 31П. МИССИС. Это в значительной степени из-за относительно высокой чувствительности ЯМР фосфора (7% протонов) в сочетании со 100% естественным содержанием.[49]Следовательно, высококачественные спектры снимаются за считанные минуты. Даже при низкой напряженности поля достигается большое разрешение спектров из-за относительно большой (~ 30 ppm) дисперсии химического сдвига для фосфатов in vivo. Клинически фосфорный ЯМР превосходен, поскольку он обнаруживает все метаболиты, играющие ключевую роль в энергетическом метаболизме тканей, и может косвенно определять внутриклеточный pH. Тем не менее, ЯМР фосфора в основном затруднен из-за ограниченного числа метаболитов, которые он может обнаружить.[50]
13Углеродная магнитно-резонансная спектроскопия
В отличие от фосфорного ЯМР, углеродный ЯМР является нечувствительным методом. Это связано с тем, что 1313 C ЯМР имеет низкое содержание (1,1%) и низкое гиромагнитное отношение углерода.[51] Эта низкая численность объясняется тем, что 12C не имеет магнитного момента, что делает его неактивным для ЯМР, что приводит к 13Использование C. для целей спектроскопии. Однако эту низкую чувствительность можно улучшить за счет развязки, усреднения, передачи поляризации и увеличения объемов.[52] Несмотря на низкую природную численность и чувствительность 13C, 13C MRS использовался для изучения нескольких метаболитов, особенно гликогена и триглицеридов.[53] Он оказался особенно полезным для получения информации о метаболических потоках от 13С-меченные прекурсоры.[54] Есть большое совпадение в том, что 1H MRS и 13C MRS может получать спектральные и большие причины в сочетании с 1Высокая чувствительность H MRS, почему 13C MRS никогда не видел такого широкого применения, как 1H MRS. Смотрите также МРТ с гиперполяризованным углеродом-13.
23Магнитно-резонансная спектроскопия натрия
ЯМР натрия печально известен своей низкой чувствительностью (9,2% относительно чувствительности к протонам) и низким отношением сигнал / шум из-за низкой концентрации натрия (30–100 мМ), особенно по сравнению с протонами (40–50 М).[55] Тем не менее, интерес к натриевому ЯМР был вновь вдохновлен недавним значительным увеличением отношения сигнал / шум в сильных магнитных полях, а также улучшенными конструкциями катушек и оптимизированными последовательностями импульсов. Есть большие надежды на клинический потенциал ЯМР натрия, потому что обнаружение аномального внутриклеточного натрия in vivo может иметь значительный диагностический потенциал и открыть новое понимание гомеостаза электролиза тканей.[56]
19Магнитно-резонансная спектроскопия фтора
ЯМР фтора имеет высокую чувствительность (82% относительно чувствительности к протонам) и 100% естественное содержание.[57] Однако важно отметить, что эндогенные 19F-содержащие соединения обнаруживаются в биологических тканях, и поэтому сигнал фтора исходит от внешнего эталонного соединения. Потому что19F не содержится в биологических тканях, 19F не должен иметь дело с помехами от фоновых сигналов, как in vivo. 1H MRS работает с водой, что делает его особенно эффективным для фармакокинетических исследований. 1H МРТ обеспечивает анатомические ориентиры, а 19F MRI / MRS позволяет нам отслеживать и отображать конкретные взаимодействия определенных соединений.[58] in vivo 19F MRS может использоваться для мониторинга поглощения и метаболизма лекарств, изучения метаболизма анестетика, определения мозгового кровотока и измерения с помощью фторированных соединений («зонды») различных параметров, таких как pH, уровень кислорода и концентрация металлов.[59]
Смотрите также
- Функциональная магнитно-резонансная спектроскопия головного мозга
- Магнитно-резонансная томография
- Передача намагниченности
- ЯМР
- ЯМР-спектроскопия
Рекомендации
- ^ Дапперт А., Гюнтер Р.С., Пейрард С., ред. (1992). Магнитно-резонансная спектроскопия in vivo. Берлин: Springer-Verlag. ISBN 978-3-540-55029-7.
- ^ Янсен Дж. Ф., Бэкес WH, Николай К., Коой МЭ (август 2006 г.). «1H МР-спектроскопия головного мозга: абсолютное количественное определение метаболитов». Радиология. 240 (2): 318–32. Дои:10.1148 / радиол.2402050314. PMID 16864664.
- ^ Preul MC, Caramanos Z, Collins DL, Villemure JG, Leblanc R, Olivier A, Pokrupa R, Arnold DL (март 1996). «Точная неинвазивная диагностика опухолей головного мозга человека с помощью протонной магнитно-резонансной спектроскопии». Природа Медицина. 2 (3): 323–5. Дои:10,1038 / нм0396-323. PMID 8612232.
- ^ Донг З (апрель 2015 г.). «Протонный MRS и MRSI мозга без подавления воды». Прогресс в спектроскопии ядерного магнитного резонанса. 86-87: 65–79. Дои:10.1016 / j.pnmrs.2014.12.001. PMID 25919199.
- ^ а б c d е ж грамм час я Ландхер, Карл; Schulte, Rolf F .; Treacy, Michael S .; Swanberg, Kelley M .; Чучем, Кристоф (2019). «Теоретическое описание современных 1H in Vivo магнитно-резонансных спектроскопических импульсных последовательностей». Журнал магнитно-резонансной томографии. 0. Дои:10.1002 / jmri.26846. ISSN 1522-2586. PMID 31273880.
- ^ де Грааф Р.А., Луо Й., Терпстра М., Гарвуд М. (ноябрь 1995 г.). «Спектральный монтаж с адиабатическими импульсами». Журнал магнитного резонанса, серия B. 109 (2): 184–93. Дои:10.1006 / jmrb.1995.0008. PMID 7582600.
- ^ ван дер Грааф М. (март 2010 г.). «Магнитно-резонансная спектроскопия in vivo: базовая методология и клиническое применение». Европейский биофизический журнал. 39 (4): 527–40. Дои:10.1007 / s00249-009-0517-y. ЧВК 2841275. PMID 19680645.
- ^ Гуджар С.К., Махешвари С., Бьоркман-Буртшер И., Сундгрен П.С. (сентябрь 2005 г.). «Магнитно-резонансная спектроскопия». Журнал нейроофтальмологии. 25 (3): 217–26. Дои:10.1097 / 01.wno.0000177307.21081.81. PMID 16148633.
- ^ Фанелли А (2016). «Модели ксенотрансплантатов: В естественных условиях визуализация ". Получено 3 декабря 2017.
- ^ Сайни К.С., Патель А.Л., Шейх В.А., Магар Л.Н., Пунгаонкар С.А. (август 2007 г.). «Магнитно-резонансная спектроскопия при туберкулеме гипофиза». Сингапурский медицинский журнал. 48 (8): 783–6. PMID 17657390.
- ^ Mueller-Lisse UG, Scherr M (июнь 2003 г.). "1H-MR-Spektroskopie der Prostata: Ein Überblick" [магнитно-резонансная спектроскопия простаты 1H]. Der Radiologe (на немецком). 43 (6): 481–8. Дои:10.1007 / s00117-003-0902-y. PMID 12827263.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 52–53. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 53–54. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 54–55. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 55–56. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 56–57. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 57–58. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 58. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 82. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 84. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 59–61. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 61–62. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 87. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 63. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 64–65. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 65–66. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 66–67. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 67–68. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 68. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 68–69. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 69–70. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 70. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 70–71. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 71–72. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 72–73. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 72–73. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 73–74. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 87. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 74–76. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 76. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 76–77. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 77–78. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 78. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 79–80. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 80. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 80. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. п. 81. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 81–82. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 90–93. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 90–93. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 93–96. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 93–96. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 93–96. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 93–96. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 96–102. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 96–102. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 102–104. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 102–104. ISBN 978-1119382546.
- ^ де Грааф, Робин. ЯМР-спектроскопия in vivo: принципы и методы. Вайли. С. 102–104. ISBN 978-1119382546.
