Антиядерное антитело - Anti-nuclear antibody
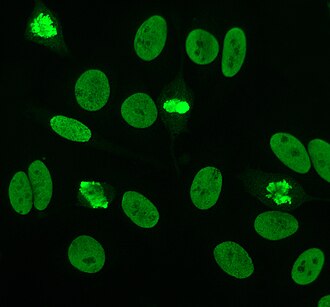
Антинуклеарные антитела (ANA, также известный как антинуклеарный фактор или же ANF)[1] находятся аутоантитела которые привязаны к содержимому ядро клетки. У нормальных людей иммунная система вырабатывает антитела к чужеродным белкам (антигены ) но не к человеческим белкам (аутоантигены ). У некоторых людей вырабатываются антитела к человеческим антигенам.[2]
Есть много подтипов ANA, таких как анти-Ro антитела, анти-La антитела, антитела против Sm, антитела против нРНП, антитела против Scl-70, антитела против дцДНК, антигистоновые антитела, антитела к комплексам ядерных пор, антицентромерные антитела и антитела против sp100. Каждый из этих подтипов антител связывается с различными белками или белковыми комплексами в ядре. Они обнаруживаются при многих заболеваниях, включая аутоиммунитет, рак и инфекционное заболевание, с разной распространенностью антител в зависимости от состояния. Это позволяет использовать ANA для диагностики некоторых аутоиммунных заболеваний, в том числе системная красная волчанка, Синдром Шегрена,[3] склеродермия,[4] смешанное заболевание соединительной ткани,[5] полимиозит, дерматомиозит, аутоиммунный гепатит[6] и лекарственная волчанка.[7]
Тест ANA выявляет аутоантитела, присутствующие в организме человека. сыворотка крови. Общие тесты, используемые для обнаружения и количественной оценки ANA: непрямая иммунофлуоресценция и иммуноферментный анализ (ИФА). При иммунофлуоресценции уровень аутоантител определяется как титр. Это самое высокое разведение сыворотки, при котором аутоантитела еще обнаруживаются. Положительные титры аутоантител при разведении, равном или превышающем 1: 160, обычно считаются клинически значимыми. Положительные титры менее 1: 160 присутствуют у 20% здорового населения, особенно у пожилых людей. Хотя положительные титры 1: 160 или выше сильно связаны с аутоиммунными нарушениями, они также обнаруживаются у 5% здоровых людей.[8][9] Скрининг на аутоантитела полезен при диагностике аутоиммунных нарушений, а мониторинг уровней помогает предсказать прогрессирование заболевания.[7][10][11] Положительный тест ANA редко бывает полезным, если отсутствуют другие клинические или лабораторные данные, подтверждающие диагноз.[12]
Иммунитет и аутоиммунитет
В организме человека есть множество защитных механизмов от патогены, один из которых гуморальный иммунитет. Этот защитный механизм производит антитела (большой гликопротеины ) в ответ на иммунный раздражитель. Для этого процесса необходимы многие клетки иммунной системы, в том числе лимфоциты (Т-клетки и В-клетки ) и антигенпрезентирующие клетки. Эти клетки координируют иммунный ответ при обнаружении чужеродных белков (антигены ), продуцирующие антитела, которые связываются с этими антигенами. В нормальной физиологии лимфоциты, распознающие белки человека (аутоантигены ) либо подвергаются запрограммированной гибели клеток (апоптоз ) или перестать работать. Этот терпимость означает, что лимфоциты не должны вызывать иммунный ответ против клеточных антигенов человека. Однако иногда этот процесс не работает, и антитела вырабатываются против человеческих антигенов, что может привести к аутоиммунному заболеванию.[2]
Подтипы ANA
АНА обнаруживаются при многих заболеваниях, а также у некоторых здоровых людей. Эти расстройства включают: системная красная волчанка (SLE), ревматоидный артрит, Синдром Шегрена, склеродермия, полимиозит, дерматомиозит, первичный билиарный цирроз, лекарственная волчанка, аутоиммунный гепатит, рассеянный склероз, дискоидная волчанка, заболевание щитовидной железы, антифосфолипидный синдром, ювенильный идиопатический артрит, псориатический артрит, ювенильный дерматомиозит, идиопатическая тромбоцитопеническая пурпура, инфекционное заболевание и рак. Эти антитела можно подразделить в соответствии с их специфичностью, и каждая подгруппа имеет разную склонность к конкретным расстройствам.[7][13]
Извлекаемые ядерные антигены
Извлекаемые ядерные антигены (ENA) - это группа аутоантигены которые изначально были определены как мишени для антител у людей с аутоиммунными заболеваниями. Их называют ENA, потому что они могут быть извлечены из ядра клетки с помощью физиологического раствора.[7][14] ENA состоят из рибонуклеопротеины и негистон белки, названные по имени донора, предоставившего прототип сыворотки (Sm, Ro, La, Jo), или по названию болезни, в которой были обнаружены антитела (SS-A, SS-B, Scl-70 ).[15]
Анти-Ро / СС-А и анти-Ла / СС-Б

Анти-Ро и анти-Ла антитела, также известные как SS-A и SS-B, соответственно, обычно встречаются в первичных Синдром Шегрена, аутоиммунное заболевание что влияет на экзокринные железы. Присутствие обоих антител обнаруживается при 30–60% синдрома Шегрена, только анти-Ro антитела обнаруживаются при 50–70% синдрома Шегрена и 30% СКВ с поражением кожи, а антитела против La редко встречаются изолированно. .[10][16] Антитела против La также обнаруживаются при СКВ; однако синдром Шегрена обычно также присутствует.[17] Антитела Anti-Ro также реже обнаруживаются при других заболеваниях, включая аутоиммунные заболевания печени, глютеновая болезнь, аутоиммунные ревматические заболевания, сердечные неонатальные Красная волчанка и полимиозит.[18][19] Во время беременности анти-Ro антитела могут проникать через плацента и причина блокада сердца[20][21] и неонатальная волчанка у младенцев.[22] При синдроме Шегрена анти-Ro и анти-La антитела коррелируют с ранним началом, увеличением продолжительности заболевания, околоушной железы увеличение, заболевание вне желез и инфильтрация лимфоцитов.[11] Антитела Anti-Ro специфичны для компонентов комплекса Ro-RNP, включающего белки 45 кДа, 52 кДа, 54 кДа и 60 кДа и РНК. 60 кДа ДНК / РНК-связывающий белок и 52 кДа Т-клетка регуляторный белок - это наиболее хорошо охарактеризованные антигены анти-Ro антител. В совокупности эти белки являются частью рибонуклеопротеин (RNP) комплекс, который связывается с hyRNA, hY1-hY5. Антиген La - 48 кДа. транскрипция фактор завершения РНК-полимераза III, который ассоциируется с комплексом Ro-RNP.[15][16][23][24]
Механизм выработки антител при синдроме Шегрена до конца не изучен, но апоптоз (запрограммированная гибель клеток) и молекулярная мимикрия может сыграть роль.[11] Антигены Ro и La экспрессируются на поверхности клеток, подвергающихся апоптозу, и могут вызывать воспаление в слюнной железе путем взаимодействия с клетками иммунной системы. Антитела также могут быть получены посредством молекулярной мимикрии, когда перекрестно реактивные антитела связываются как с вирусными, так и с человеческими белками. Это может происходить с одним из антигенов, Ro или La, и впоследствии может продуцировать антитела к другим белкам посредством процесса, известного как распространение эпитопа. Ретровирусный белок gag проявляет сходство с белком La и предлагается в качестве возможного примера молекулярной мимикрии при синдроме Шегрена.[11][19]
Анти-См
Антитела против Смита (Anti-Sm) являются очень специфическим маркером СКВ. Примерно 99% людей без СКВ не имеют антител к Sm, но только 20% людей с СКВ имеют антитела. Они связаны с Центральная нервная система участие заболевание почек, фиброз легких и перикардит при СКВ, но они не связаны с активностью заболевания. Антигены антител против Sm являются основными единицами малые ядерные рибонуклеопротеины (snRNP), называемые от A до G, и будут связываться с snRNP U1, U2, U4, U5 и U6. Чаще всего антитела специфичны для единиц B, B 'и D.[25][26] Молекулярные и эпидемиологические исследования показывают, что антитела против Sm могут быть индуцированы молекулярной мимикрией, потому что белок проявляет некоторое сходство с Вирус Эпштейна-Барра белки.[27][28]
Анти-nRNP / анти-U1-RNP
Антитела против ядерного рибонуклеопротеина (анти-нРНП), также известные как антитела против U1-RNP, обнаруживаются в 30–40% случаев СКВ. Они часто обнаруживаются с антителами против Sm, но могут быть связаны с различными клиническими ассоциациями. Помимо СКВ, эти антитела тесно связаны с смешанное заболевание соединительной ткани. Антитела против nRNP распознают ядерные единицы A и C snRNP и поэтому они в первую очередь связываются с U1-snRNP.[25][29] Иммунный ответ на РНП может быть вызван представлением ядерных компонентов на клеточной мембране в виде апоптотических пузырьков. Молекулярная мимикрия также была предложена в качестве возможного механизма продукции антител к этим белкам из-за сходства полипептидов U1-RNP и полипептидов вируса Эпштейна-Барра.[30]
Анти-Scl-70 / анти-топоизомераза I
Антитела против Scl-70 связаны с склеродермия.[31] Чувствительность антител к склеродермии составляет примерно 34%, но выше для случаев с диффузным поражением кожи (40%) и ниже для ограниченного поражения кожи (10%). Специфичность антител составляет 98% и 99,6% при других ревматических заболеваниях и у здоровых людей соответственно.[7][32] Помимо склеродермии, эти антитела обнаруживаются примерно у 5% людей с СКВ.[33] Антигенная мишень анти-Scl-70 антител - это топоизомераза I.[34]
Анти-Джо-1
Хотя анти-Jo-1 антитела часто входят в состав ANA, на самом деле они являются антителами к цитоплазматическому белку, Гистидил-тРНК синтетаза - аминоацил-тРНК синтетаза, необходимая для синтеза тРНК, нагруженной гистидином.[14] Они тесно связаны с полимиозит и дерматомиозит, и редко встречаются при других заболеваниях соединительной ткани. Около 20–40% случаев полимиозита имеют положительный результат на антитела к Jo-1, и у большинства из них наблюдается интерстициальное заболевание легких, HLA-DR3 и HLA-DRw52. человеческий лейкоцитарный антиген (HLA) маркеры; под общим названием синдром Джо-1.[25][35]
Анти-дцДНК

Антитела против двухцепочечной ДНК (анти-дцДНК) тесно связаны с СКВ. Они очень специфический маркер болезни, причем в некоторых исследованиях цитируется почти 100%.[7] Данные о чувствительность колеблется в пределах 25–85%. Уровни антител против дцДНК, известные как титры, коррелируют с активностью заболевания при СКВ; высокие уровни указывают на более активную волчанку. Наличие антител против дцДНК также связано с волчаночный нефрит и есть доказательства, что они являются причиной. Некоторые антитела против дцДНК обладают перекрестной реактивностью с другими антигенами, обнаруженными на клубочковая базальная мембрана (GBM) почки, например гепаран сульфат, коллаген IV, фибронектин и ламинин. Связывание с этими антигенами в почках может вызвать воспаление и фиксация комплемента, что приводит к поражению почек. Наличие высокого связывания ДНК и низкого C3 было показано, что уровни имеют чрезвычайно высокую прогностическую ценность (94%) для диагностики СКВ.[36] Также возможно, что антитела против дцДНК интернализуются клетками, когда они связываются с мембранными антигенами, а затем отображаются на поверхности клетки. Это может способствовать воспалительной реакции со стороны Т-клеток в почках. Важно отметить, что не все антитела против дцДНК связаны с волчаночным нефритом и что другие факторы могут вызывать этот симптом в их отсутствие. Антигеном антител против дцДНК является двухцепочечная ДНК.[37][38]
Антигистоновые антитела
Антигистоновые антитела обнаруживаются в сыворотке до 75–95% людей с лекарственная волчанка и 75% идиопатической СКВ. В отличие от антител против дцДНК при СКВ, эти антитела не фиксируют комплемент. Хотя они чаще всего встречаются при лекарственной волчанке, они также обнаруживаются в некоторых случаях СКВ, склеродермия, ревматоидный артрит и недифференцированное заболевание соединительной ткани. Известно, что многие лекарства вызывают лекарственную волчанку, и они производят различные антигенные мишени в нуклеосоме, которые часто перекрестно реагируют с несколькими гистоновыми белками и ДНК. Прокаинамид вызывает форму лекарственной волчанки, которая продуцирует антитела к гистоновому комплексу H2A и H2B.[39][40]
Анти-gp210 и анти-p62
Обе анти-гликопротеин-210 (анти-gp210) и антинуклеопорин 62 (anti-p62) антитела представляют собой антитела к компонентам ядерной мембраны и обнаруживаются в первичный билиарный цирроз (КПБ). Каждое антитело присутствует примерно в 25–30% ПБЦ. Антигены обоих антител являются составными частями ядерная мембрана. gp210 представляет собой белок 200 кДа, участвующий в закреплении компонентов ядерная пора к ядерной мембране. Антиген p62 представляет собой комплекс ядерных пор 60 кДа.[41][42]
Антицентромерные антитела
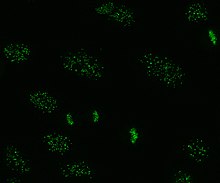
Антицентромерные антитела связаны с ограниченным кожным системным склерозом, также известным как КРЕСТ-синдром, первичный билиарный цирроз и проксимальная склеродермия.[43] Известно шесть антигенов, все они связаны с центромера; CENP-A в CENP-F. CENP-A - 17 кДа гистон H3 -подобный белок. CENP-B представляет собой ДНК-связывающий белок массой 80 кДа, участвующий в сворачивании гетерохроматин. CENP-C представляет собой белок 140 кДа, участвующий в кинетохора сборка. CENP-D представляет собой белок 50 кДа с неизвестной функцией, но может быть гомологичный к другому белку, участвующему в конденсация хроматина, RCC1. CENP-E представляет собой белок 312 кДа из кинезин семейство моторных белков. CENP-F представляет собой белок 367 кДа из ядерного матрикса, который ассоциируется с кинетохорой в конце Фаза G2 во время митоза. Антитела CENP-A, B и C встречаются наиболее часто (16–42% системного склероза) и связаны с феноменом Рейно, телеангиэктазии, поражение легких и раннее начало системного склероза.[32][44][45]
Анти-sp100
Антитела против sp100 находятся примерно в 20–30% первичный билиарный цирроз (КПБ). Они обнаруживаются у немногих людей без ПБЦ и поэтому являются очень специфическим маркером болезни. Антиген sp100 находится внутри ядерных тел; большие белковые комплексы в ядре, которые могут играть роль в росте и дифференцировке клеток.[46]
Анти-PM-Scl
Антитела против PM-Scl обнаруживаются почти в 50% синдром перекрытия полимиозит / системный склероз (PM / SSc). Около 80% людей с антителами, присутствующими в сыворотке крови, страдают этим заболеванием. Присутствие антител связано с ограниченным поражением кожи синдромом перекрытия PM / SSc. Антигенные мишени антител являются компонентами РНК -обработка экзосомальный комплекс в ядрышко.[32] В этом комплексе десять белков, и антитела к восьми из них обнаруживаются с разной частотой; PM / Scl-100 (70–80%), PM / Scl-75 (46–80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 ( 10%) и hRrp40 (7%).[47]
Антитела против DFS70
Антитела против DFS70 образуют плотный мелкий пятнистый узор при непрямой иммунофлуоресценции и обнаруживаются у нормальных людей и в различных условиях, но не связаны с системной аутоиммунной патологией. Следовательно, их можно использовать, чтобы исключить такие состояния у людей с положительной анестезиологической активностью. У значительного числа пациентов диагностируется системная красная волчанка или недифференцированное заболевание соединительной ткани, в основном на основании положительного результата ANA. В случае, если не могут быть обнаружены определенные аутоантитела (например, антитела против ENA), рекомендуется тестирование антител против DFS70 для подтверждения диагноза. Тесты на антитела к DFS70 доступны как тесты с маркировкой CE. До сих пор нет доступных анализов, одобренных FDA.[48]
ANA тест


Наличие ANA в крови может быть подтверждено скрининговым тестом. Хотя существует множество тестов для обнаружения ANA, наиболее распространенными тестами, используемыми для скрининга, являются непрямая иммунофлуоресценция и иммуноферментный анализ (ELISA).[49] После обнаружения ANA определяются различные подтипы.[7]
Непрямая иммунофлуоресценция
Косвенный иммунофлуоресценция является одним из наиболее часто используемых тестов для ANA. Обычно клетки HEp-2 используются в качестве субстрата для обнаружения антител в сыворотке крови человека. Предметные стекла микроскопа покрыты клетками HEp-2, и сыворотка инкубируется с клетками. Если указанные и целевые антитела присутствуют, они будут связываться с антигены на клетках; в случае ANA антитела связываются с ядром. Их можно визуализировать, добавив флуоресцентные метки (обычно FITC или родопсин B) антитело против человека, которое связывается с антителами. Молекула будет флуоресцировать, когда на нее будет светить определенная длина волны, что можно увидеть под микроскопом. В зависимости от антитела, присутствующего в сыворотке крови человека, и локализации антигена в клетке, на клетках HEp-2 будут видны различные модели флуоресценции.[50][51] Уровни антител анализируют, выполняя разведения сыворотки крови. Тест ANA считается положительным, если флуоресценция наблюдается при титре 1: 40/1: 80. Более высокие титры более клинически значимы, поскольку низкие положительные результаты (≤1: 160) обнаруживаются почти у 20% здоровых людей, особенно у пожилых людей. Только около 5% здорового населения имеют титры АНА 1: 160 или выше.[7][52]
HEp-2
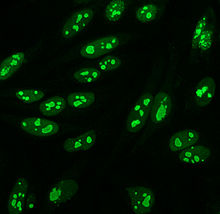
Примерно до 1975 года, когда были введены клетки HEp-2, животная ткань использовалась в качестве стандартного субстрата для иммунофлуоресценции.[10] Клетки HEp-2 в настоящее время являются одним из наиболее распространенных субстратов для обнаружения ANA с помощью иммунофлуоресценции.[53]
Первоначально возник штамм карциномы гортани, клеточная линия была загрязнена и вытеснена HeLa клеток, и теперь они были идентифицированы как клетки HeLa.[54]
Они превосходят ранее использованные ткани животных из-за их большого размера и высокой скорости митоз (деление клеток) в клеточная линия. Это позволяет обнаруживать антитела к митоз-специфическим антигенам, например, центромерным антителам. Они также позволяют идентифицировать антитела против Ro, потому что ацетон используется для фиксация клеток (другие фиксаторы могут смыть антиген).[55]
На клетках HEp-2 наблюдается множество паттернов окрашивания ядер: гомогенные, пятнистые, ядрышковые, ядерно-мембранозные, центромерные, ядерные точки и плеоморфные. Однородный узор виден, когда конденсированный хромосомы и межфазный хроматин пятно. Этот паттерн связан с антитела против дцДНК, антитела к нуклеосомным компонентам и антигистоновые антитела. Есть два пестрых рисунка: мелкий и грубый. Мелкий крапчатый узор имеет тонкое ядерное окрашивание с неокрашенными метафаза хроматин, который связан с антителами против Ro и против La. Картина грубого окрашивания имеет грубое зернистое окрашивание ядер, вызванное антителами против U1-RNP и против Sm. Картина окрашивания ядрышек связана со многими антителами, включая анти-Scl-70, анти-PM-Scl, анти-фибрилларин и анти-Th / To. Окрашивание ядерной мембраны проявляется в виде флуоресцентного кольца вокруг ядра клетки и вырабатывается антителами против gp210 и p62. Паттерн центромеры показывает несколько ядерные точки в интерфазных и митотических клетках, что соответствует количеству хромосом в клетке. Ядерные точки показывают от 13 до 25 ядерных точек в межфазный клетки и продуцируются анти-sp100 антитела. Плеоморфный паттерн вызывается антителами к ядерный антиген пролиферирующих клеток.[25][52][56][57] Было показано, что непрямая иммунофлуоресценция несколько превосходит ELISA при обнаружении ANA из клеток HEp-2.[53]
Crithidia luciliae

Crithidia luciliae находятся гемофлаггелат одноклеточный протисты. Они используются в качестве субстрата в иммунофлуоресценции для обнаружения антител против дцДНК. Они обладают органелла известный как кинетопласт что является большим митохондрия с сетью взаимосвязанных кольцевых молекул дцДНК. После инкубации с сывороткой, содержащей антитела против дцДНК и флуоресцентно меченые антитела против человека, кинетопласт будет флуоресцировать. Отсутствие других ядерных антигенов в этой органелле означает, что использование C.luciliae в качестве субстрата позволяет проводить специфическое обнаружение антител против дцДНК.[7][58][59]
ELISA
Иммуноферментный анализ (ELISA) использует покрытые антигеном микротитровальные планшеты для обнаружения ANA.[60] Каждая лунка микротитровального планшета покрыта либо одним антигеном, либо несколькими антигенами для обнаружения специфических антител или для скрининга ANA соответственно. Антигены либо из клеточных экстрактов, либо из рекомбинантных. Сыворотка крови инкубируется в лунках планшета и промывается. Если присутствуют антитела, связывающиеся с антигеном, они останутся после промывки. Вторичное антитело против человека, конъюгированное с ферментом, таким как пероксидаза хрена добавлен. Ферментативная реакция приведет к изменению цвета раствора, которое пропорционально количеству антитела, связанного с антигеном.[10][51][61] Существуют значительные различия в обнаружении ANA с помощью иммунофлуоресценции и различных наборов ELISA, и между ними существует лишь незначительное согласие. Клиницист должен быть знаком с различиями, чтобы оценить результаты различных анализов.[60]
Чувствительность
В следующей таблице перечислены чувствительность различных типов АНА при разных заболеваниях.
| Тип АНА | Целевой антиген | Чувствительность (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| SLE | ЛЕ, вызванное лекарственными средствами | Диффузный системный склероз | Ограниченная системная склеродермия | Синдром Шегрена | Воспалительная миопатия | MCTD | ||
| Все ANA (косвенно ЕСЛИ ) | Разные | 95[62] | 100[62] | 80[62] | 80[62] | 70[62] | 40–60 | 95[62] |
| Анти-дцДНК | ДНК | 60[62] | –[62] | –[62] | –[62] | 30[62] | – | -[62] |
| Анти-См | Основные белки snRNPs | 40[62] | –[62] | –[62] | –[62] | –[62] | – | -[62] |
| Антигистон | Гистоны | 60[62] | 90[62] | –[62] | –[62] | –[62] | – | -[62] |
| Анти Scl-70 | Топоизомераза I типа | –[62] | –[62] | 20[62] | 10[62] | –[62] | – | -[62] |
| Антицентромера | Центромерный белки | –[62] | –[62] | 30[62] | 80[62] | –[62] | – | -[62] |
| СС-А (Ро) | РНП | 40[62] | –[62] | –[62] | –[62] | 50[62] | 10 | -[62] |
| СС-Б (Ла) | РНП | 10–15 | – | – | – | 60–90 | – | |
| - = чувствительность менее 5% | ||||||||
Некоторые АНА появляются при нескольких типах заболеваний, что приводит к снижению специфичность теста. Например, IgM-ревматоидный фактор (IgM-RF) перекрестно реагируют с ANA, давая ложноположительные иммунофлуоресценция.[63] Положительные ANA, а также антитела против ДНК были зарегистрированы у пациентов с аутоиммунное заболевание щитовидной железы.[64][65] ANA может иметь положительный результат теста у 45% людей с аутоиммунными заболеваниями щитовидной железы или ревматоидный артрит и до 15% людей с ВИЧ или же гепатит С.[65][66][67][68] Согласно Американский фонд волчанки, "около 5% населения в целом будут иметь положительный результат ANA. Однако по крайней мере 95% людей с положительным результатом ANA не болеют волчанкой. Положительный тест ANA может иногда проводиться в семьях, даже если члены семьи не имеют свидетельство волчанки ". [9] С другой стороны, они говорят, что, хотя 95% пациентов, у которых на самом деле тест на волчанку положительный на АНА, «лишь небольшой процент имеет отрицательный результат АНА, и многие из них имеют другие антитела (например, антифосфолипидные антитела, анти-Ro, анти-SSA) или их ANA, преобразованные из положительного в отрицательный из стероиды, цитотоксические препараты, или же уремия (почечная недостаточность) ".[9]
История

В LE ячейка был обнаружен в Костный мозг в 1948 году Харгрейвсом и другие.[69] В 1957 году Холбороу и др. впервые продемонстрировал ANA с помощью непрямой иммунофлуоресценции.[70] Это было первым признаком того, что процессы, влияющие на ядро клетки, ответственны за СКВ. В 1959 году было обнаружено, что сыворотка от людей с СКВ содержала антитела, которые осаждались солевыми экстрактами ядер, известными как извлекаемые ядерные антигены (ENA). Это привело к характеристике антигенов ENA и их соответствующих антител. Таким образом, антитела против Sm и против РНП были открыты в 1966 и 1971 годах соответственно. В 1970-х годах были открыты антитела против Ro / анти-SS-A и анти-La / анти-SS-B. Антитело Scl-70 было известно как специфическое антитело к склеродермии в 1979 году, однако антиген (топоизомераза-I) не был охарактеризован до 1986 года. Антиген и антитело Jo-1 были охарактеризованы в 1980 году.[7][19]
Смотрите также
Рекомендации
- ^ «Медицинские предметные рубрики (MeSH)». Национальная медицинская библиотека. Получено 12 февраля 2013.
- ^ а б Рис, Джейн; Кэмпбелл, Нил (2005). Биология (7-е изд.). Сан-Франциско: Пирсон / Бенджамин-Каммингс. ISBN 978-0805371468.[страница нужна ]
- ^ Сервера, Р; Шрифт, J; Рамос-Казальс, М; Гарсия-Карраско, М. Росас, Дж; Morlà, RM; Muñoz, FJ; Артиг, А; Pallarés, L; Ингельмо, М. (2000). «Первичный синдром Шегрена у мужчин: клинико-иммунологическая характеристика». Волчанка. 9 (1): 61–4. Дои:10.1177/096120330000900111. PMID 10713648. S2CID 39696993.
- ^ Барнетт, AJ; McNeilage, LJ (май 1993 г.). «Антинуклеарные антитела у больных склеродермией (системным склерозом) и их кровных родственников и супругов». Анналы ревматических болезней. 52 (5): 365–8. Дои:10.1136 / ard.52.5.365. ЧВК 1005051. PMID 8323384.
- ^ Burdt, Mark A .; Хоффман, Роберт В .; Deutscher, Susan L .; Wang, Grace S .; Джонсон, Джейн С.; Шарп, Гордон С. (1 мая 1999 г.). «Долгосрочные результаты при смешанном заболевании соединительной ткани: продольные клинические и серологические данные». Артрит и ревматизм. 42 (5): 899–909. Дои:10.1002 / 1529-0131 (199905) 42: 5 <899 :: AID-ANR8> 3.0.CO; 2-L. PMID 10323445.
- ^ Обермайер-Штрауб, П; Страсбург, КП; Маннс, депутат (2000). «Аутоиммунный гепатит». Журнал гепатологии. 32 (1 приложение): 181–97. Дои:10.1016 / S0168-8278 (00) 80425-0. PMID 10728804.
- ^ а б c d е ж грамм час я j Кавано А., Томар Р., Ревейл Дж., Соломон Д.Х., Homburger HA (январь 2000 г.). «Руководство по клиническому использованию теста на антинуклеарные антитела и тестов на специфические аутоантитела к ядерным антигенам. Американский колледж патологов». Архив патологии и лабораторной медицины. 124 (1): 71–81. Дои:10.1043 / 0003-9985 (2000) 124 <0071: GFCUOT> 2.0.CO; 2 (неактивно 10.11.2020). PMID 10629135.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Tan, EM; Feltkamp, TE; Смолен, JS; Мясник, B; Докинз, Р. Фрицлер, MJ; Гордон, Т; Хардин, JA; Kalden, JR; Лахита, РГ; Maini, RN; McDougal, JS; Ротфилд, Северная Каролина; Сминк, Р.Дж.; Такасаки, Y; Wiik, A; Уилсон, MR; Koziol, JA (сентябрь 1997 г.). «Диапазон антинуклеарных антител у« здоровых »лиц». Артрит и ревматизм. 40 (9): 1601–11. Дои:10.1002 / арт.1780400909. PMID 9324014.
- ^ а б c «Тест на антинуклеарные антитела: что это значит». Американский фонд волчанки. Получено 7 июн 2013.
- ^ а б c d Кумар, Й; Бхатия, А; Минц, RW (2 января 2009 г.). «Антинуклеарные антитела и методы их обнаружения в диагностике заболеваний соединительной ткани: новое путешествие». Диагностическая патология. 4: 1. Дои:10.1186/1746-1596-4-1. ЧВК 2628865. PMID 19121207.
- ^ а б c d Ямамото К. (январь 2003 г.). «Патогенез синдрома Шегрена». Аутоиммунный Rev. 2 (1): 13–8. Дои:10.1016 / S1568-9972 (02) 00121-0. PMID 12848970.
- ^ Ричардсон, Б. Эпштейн, Западная Вирджиния (сентябрь 1981 г.). «Полезность теста флуоресцентных антинуклеарных антител у одного пациента». Анналы внутренней медицины. 95 (3): 333–8. Дои:10.7326/0003-4819-95-3-333. PMID 7023311.
- ^ Маллесон П.Н., Маккиннон М.Дж., Зайлер-Хук М., Спенсер С.Х. (2010). «Обзор для универсального врача: тест на антинуклеарные антитела у детей - когда его использовать и что делать при положительном титре». Педиатр Ревматол Интернет J. 8: 27. Дои:10.1186/1546-0096-8-27. ЧВК 2987328. PMID 20961429.
- ^ а б Damoiseaux, JG; Tervaert, JW (январь 2006 г.). «От ANA к ENA: как действовать?». Отзывы об аутоиммунности. 5 (1): 10–7. Дои:10.1016 / j.autrev.2005.05.007. PMID 16338206.
- ^ а б Венцель, Дж; Гердсен, Р.; Уерлих, М; Bauer, R; Бибер, Т; Бем, I (декабрь 2001 г.). «Антитела, направленные против экстрагируемых ядерных антигенов: историческое развитие и современные знания». Британский журнал дерматологии. 145 (6): 859–67. Дои:10.1046 / j.1365-2133.2001.04577.x. PMID 11899137. S2CID 45350044.
- ^ а б Эрнандес-Молина, G; Leal-Alegre, G; Мишель-Перегрина (январь 2011 г.). «Значение анти-Ro и анти-La антител при первичном синдроме Шегрена». Отзывы об аутоиммунности. 10 (3): 123–5. Дои:10.1016 / j.autrev.2010.09.001. PMID 20833272.
- ^ Кассан, СС; Мутсопулос, HM (июнь 2004 г.). «Клинические проявления и ранняя диагностика синдрома Шегрена». Arch Intern Med. 164 (12): 1275–84. Дои:10.1001 / archinte.164.12.1275. PMID 15226160.
- ^ Defendenti, C; Atzeni, F; Spina, MF; Гроссо, S; Середа, А; Guercilena, G; Bollani, S; Saibeni, S; Путтини, PS (январь 2011 г.). «Клинические и лабораторные аспекты аутоантител Ro / SSA-52». Отзывы об аутоиммунности. 10 (3): 150–4. Дои:10.1016 / j.autrev.2010.09.005. PMID 20854935.
- ^ а б c Венейблс, П.Дж. (июнь 2004 г.). "Синдром Шегрена". Лучшие практики и исследования. Клиническая ревматология. 18 (3): 313–29. Дои:10.1016 / j.berh.2004.02.010. PMID 15158743.
- ^ Клоуз, Меган Э.Б .; Юди, Аманда М .; Кирнан, Элизабет; Уильямс, Мэтью Р .; Бермас, Бонни; Чакраварти, Элиза; Саммаритано, Лиза Р .; Чемберс, Кристина Д .; Буйон, Джилл (1 июля 2018 г.). «Профилактика, скрининг и лечение врожденной сердечной блокады от неонатальной волчанки: обзор практики медицинских работников». Ревматология (Оксфорд, Англия). 57 (suppl_5): v9 – v17. Дои:10.1093 / ревматология / key141. ISSN 1462-0332. ЧВК 6099126. PMID 30137589.
- ^ Сонессон, Свен-Эрик; Хедлунд, Малин; Амбрози, Орели; Варен-Херлениус, Мари (1 октября 2017 г.). «Факторы, влияющие на сердечную проводимость плода при беременностях с анти-Ro / SSA». Ревматология (Оксфорд, Англия). 56 (10): 1755–1762. Дои:10.1093 / ревматология / kex263. ISSN 1462-0332. PMID 28957562. S2CID 3803597.
- ^ Скофилд, Р.Х. (8 мая 2004 г.). «Аутоантитела как предикторы заболевания». Ланцет. 363 (9420): 1544–6. Дои:10.1016 / S0140-6736 (04) 16154-0. PMID 15135604. S2CID 13983923.
- ^ Дешмук, США; Багавант, Н; Льюис, Дж; Гаскин, Ф; Фу, С.М. (ноябрь 2005 г.). «Распространение эпитопа внутри ассоциированных с волчанкой рибонуклеопротеиновых антигенов». Клиническая иммунология (Орландо, Флорида). 117 (2): 112–20. Дои:10.1016 / j.clim.2005.07.002. PMID 16095971.
- ^ Бен-Четрит, Э (май 1993 г.). «Молекулярные основы антигенов SSA / Ro и клиническое значение их аутоантител». Британский журнал ревматологии. 32 (5): 396–402. Дои:10.1093 / ревматология / 32.5.396. PMID 8495261.
- ^ а б c d фон Мюлен, Калифорния; Тан, Э.М. (апрель 1995 г.). «Аутоантитела в диагностике системных ревматических заболеваний». Семинары по артриту и ревматизму. 24 (5): 323–58. Дои:10.1016 / S0049-0172 (95) 80004-2. PMID 7604300.
- ^ Lyons, R; Нараин, S; Николс, К; Сато, М; Ривз, WH (июнь 2005 г.). «Эффективное использование тестов на аутоантитела в диагностике системных аутоиммунных заболеваний». Летопись Нью-Йоркской академии наук. 1050: 217–28. Bibcode:2005НЯСА1050..217Л. Дои:10.1196 / летопись.1313.023. PMID 16014537. S2CID 7150107.
- ^ Зиеве, ГВт; Хусиал, ПР (сентябрь 2003 г.). «Анти-Sm иммунный ответ в аутоиммунной и клеточной биологии». Отзывы об аутоиммунности. 2 (5): 235–40. Дои:10.1016 / S1568-9972 (03) 00018-1. PMID 12965173.
- ^ Migliorini, P; Бальдини, К; Рокки, V; Бомбардиери, С. (февраль 2005 г.). «Анти-Sm и анти-РНП антитела». Аутоиммунитет. 38 (1): 47–54. Дои:10.1080/08916930400022715. PMID 15804705. S2CID 1627719.
- ^ Бенито-Гарсия, Э; Schur, PH; Лахита, Р. Специальный комитет Американского колледжа ревматологии по иммунологическому тестированию, Рекомендации (15 декабря 2004 г.). «Руководство по иммунологическим лабораторным исследованиям при ревматических заболеваниях: тесты на антитела к Sm и RNP». Артрит и ревматизм. 51 (6): 1030–44. Дои:10.1002 / арт.20836. PMID 15593352.
- ^ Венейблс П.Дж. (2006). «Смешанное заболевание соединительной ткани». Волчанка. 15 (3): 132–7. Дои:10.1191 / 0961203306lu2283rr. PMID 16634365. S2CID 25736411.
- ^ Хименес, SA; Дерк, Коннектикут (6 января 2004 г.). «Следуя молекулярным путям к пониманию патогенеза системного склероза». Анналы внутренней медицины. 140 (1): 37–50. Дои:10.7326/0003-4819-140-2-200401200-00013. PMID 14706971.
- ^ а б c Ho, KT; Reveille, JD (2003). «Клиническая значимость аутоантител при склеродермии». Исследования и лечение артрита. 5 (2): 80–93. Дои:10.1186 / ar628. ЧВК 165038. PMID 12718748.
- ^ Mahler M, Silverman ED, Schulte-Pelkum J, Fritzler MJ (сентябрь 2010 г.). «Антитела Anti-Scl-70 (topo-I) при СКВ: миф или реальность?». Аутоиммунный Rev. 9 (11): 756–60. Дои:10.1016 / j.autrev.2010.06.005. PMID 20601198.
- ^ Guldner, HH; Szostecki, C; Фосберг, HP; Lakomek, HJ; Пеннер, Э; Бауц, Ф.А. (1986). «Аутоантитела Scl 70 от пациентов со склеродермией распознают белок 95 кДа, идентифицированный как ДНК-топоизомераза I». Хромосома. 94 (2): 132–8. Дои:10.1007 / BF00286991. PMID 2428564. S2CID 24851422.
- ^ Шмидт, Вашингтон; Ветцель, Вт; Friedländer, R; Lange, R; Соренсен, HF; Lichey, HJ; Genth, E; Mierau, R; Громница-Ихле, Э (2000). «Клинические и серологические аспекты пациентов с антителами к Jo-1 - развивающийся спектр проявлений болезни». Клиническая ревматология. 19 (5): 371–7. Дои:10.1007 / с100670070030. PMID 11055826. S2CID 3014699.
- ^ Вайнштейн, А; Bordwell, B; Камень, В; Тиббетс, К; Ротфилд, штат Нью-Йорк (февраль 1983 г.) «Антитела к нативной ДНК и уровням сывороточного комплемента (C3). Применение для диагностики и классификации системной красной волчанки». Американский журнал медицины. 74 (2): 206–16. Дои:10.1016/0002-9343(83)90613-7. PMID 6600582.
- ^ Mok, CC; Лау, CS (июль 2003 г.). «Патогенез системной красной волчанки». Журнал клинической патологии. 56 (7): 481–90. Дои:10.1136 / jcp.56.7.481. ЧВК 1769989. PMID 12835292.
- ^ Юнг, S; Чан, TM (февраль 2008 г.). «Анти-ДНК-антитела в патогенезе волчаночного нефрита - новые механизмы». Отзывы об аутоиммунности. 7 (4): 317–21. Дои:10.1016 / j.autrev.2007.12.001. PMID 18295737.
- ^ Васу, S (2006). «Лекарственная волчанка: обновленная информация». Волчанка. 15 (11): 757–61. Дои:10.1177/0961203306070000. PMID 17153847. S2CID 17593016.
- ^ Кац, У; Зандман-Годдард, Г. (ноябрь 2010 г.). «Лекарственная волчанка: обновленная информация». Отзывы об аутоиммунности. 10 (1): 46–50. Дои:10.1016 / j.autrev.2010.07.005. PMID 20656071.
- ^ Хижина; Гуань, Т; Джерас, Л. (август 1996). «Молекулярная и функциональная характеристика комплекса p62, сборки гликопротеинов комплекса ядерных пор». Журнал клеточной биологии. 134 (3): 589–601. Дои:10.1083 / jcb.134.3.589. ЧВК 2120945. PMID 8707840.
- ^ Mackay, IR; Уиттингем, S; Fida, S; Майерс, М; Икуно, N; Гершвин, Мэн; Роули, MJ (апрель 2000 г.). «Своеобразный аутоиммунитет первичного билиарного цирроза». Иммунологические обзоры. 174: 226–37. Дои:10.1034 / j.1600-0528.2002.017410.x. PMID 10807519. S2CID 596338.
- ^ Калленберг, CG (март 1990 г.). «Антицентромерные антитела (АСА)». Клиническая ревматология. 9 (1 Дополнение 1): 136–9. Дои:10.1007 / BF02205562. PMID 2203592. S2CID 43833409.
- ^ Раттнер, JB; Мак, ГДж; Фрицлер, MJ (июль 1998 г.). «Аутоантитела к компонентам митотического аппарата». Отчеты по молекулярной биологии. 25 (3): 143–55. Дои:10.1023 / А: 1016523013819. PMID 9700050. S2CID 8595680.
- ^ Ренц, Харальд (2012). Аутоиммунная диагностика. Берлин: Де Грюйтер. ISBN 978-3-11-022864-9.
- ^ Worman, HJ; Курвалин, JC (июнь 2003 г.). «Антинуклеарные антитела, специфичные для первичного билиарного цирроза». Отзывы об аутоиммунности. 2 (4): 211–7. Дои:10.1016 / S1568-9972 (03) 00013-2. PMID 12848948.
- ^ Mahler, M; Райджмейкерс, Р. (август 2007 г.). «Новые аспекты аутоантител к комплексу PM / Scl: клинические, генетические и диагностические выводы». Отзывы об аутоиммунности. 6 (7): 432–7. Дои:10.1016 / j.autrev.2007.01.013. PMID 17643929.
- ^ Малер, Майкл; Мерони, Пьер Луиджи; Андраде, Луис Э .; Кхамашта, Мунтер; Биццаро, Никола; Касиано, Карлос А .; Фрицлер, Марвин Дж. (2016). «На пути к лучшему пониманию клинической ассоциации аутоантител против DFS70». Отзывы об аутоиммунности. 15 (2): 198–201. Дои:10.1016 / j.autrev.2015.11.006. PMID 26588998.
- ^ Granito A, Muratori P, Quarneti C, Pappas G, Cicola R, Muratori L (январь 2012 г.). «Антинуклеарные антитела как дополнительные маркеры первичного билиарного цирроза». Экспертный обзор молекулярной диагностики. 12 (1): 65–74. Дои:10.1586 / erm.11.82. PMID 22133120. S2CID 28444340.
- ^ Кляйн, Вульф Б. Сторч. Пер. Р. А. (2000). Иммунофлуоресценция в клинической иммунологии: праймер и атлас. Базель [u.a.]: Birkhäuser. ISBN 978-3764361822.
- ^ а б Гонсалес-Буитраго, JM; Гонсалес, К. (март 2006 г.). «Настоящее и будущее лаборатории аутоиммунитета». Clinica Chimica Acta; Международный журнал клинической химии. 365 (1–2): 50–7. Дои:10.1016 / j.cca.2005.07.023. PMID 16126186.
- ^ а б Tozzoli R, Bizzaro N, Tonutti E, Villalta D, Bassetti D, Manoni F, Piazza A, Pradella M, Rizzotti P (февраль 2002 г.). Исследовательская группа итальянского общества лабораторной медицины по диагностике аутоиммунных заболеваний. «Руководство по лабораторному использованию тестов на аутоантитела в диагностике и мониторинге аутоиммунных ревматических заболеваний». Американский журнал клинической патологии. 117 (2): 316–24. Дои:10.1309 / Y5VF-C3DM-L8XV-U053. PMID 11863229.
- ^ а б Ulvestad, E (март 2001 г.). «Рабочие характеристики и клиническая применимость гибридного ELISA для обнаружения ANA». APMIS. 109 (3): 217–22. Дои:10.1034 / j.1600-0463.2001.090305.x. PMID 11430499. S2CID 22229427.
- ^ Lacroix M (январь 2008 г.). «Постоянное использование« ложных »клеточных линий». Int. J. Рак. 122 (1): 1–4. Дои:10.1002 / ijc.23233. PMID 17960586. S2CID 27432788.
- ^ Керен, Д.Ф. (июнь 2002 г.). «Тестирование на антинуклеарные антитела». Клиники лабораторной медицины. 22 (2): 447–74. Дои:10.1016 / S0272-2712 (01) 00012-9. PMID 12134471.
- ^ Нешер, Г; Маргалит, Р; Ашкенази, YJ (апрель 2001 г.). «Антитела против ядерной оболочки: клинические ассоциации». Семинары по артриту и ревматизму. 30 (5): 313–20. Дои:10.1053 / sarh.2001.20266. PMID 11303304.
- ^ Мешок, U; Конрад, К; Чернок, Э; Фрэнк, я; Hiepe, F; Krieger, T; Кромминга, А; Landenberg, Pv; Мессер, G; Витте, Т; Миерау, Р. (июнь 2009 г.). die deutsche EASI-Gruppe (Европейская инициатива по стандартизации аутоиммунитета). «Обнаружение аутоантител с помощью непрямой иммунофлуоресценции на клетках HEp-2» (PDF). Deutsche Medizinische Wochenschrift. 134 (24): 1278–82. Дои:10.1055 / с-0029-1225278. PMID 19499499.
- ^ Слейтер, НГ; Кэмерон, JS; Lessof, MH (сентябрь 1976 г.). «Тест иммунофлуоресценции кинетопластов Crithidia luciliae при системной красной волчанке». Клиническая и экспериментальная иммунология. 25 (3): 480–6. ЧВК 1541410. PMID 786521.
- ^ Шапиро Т.А.; Englund, PT (1995). «Структура и репликация кинетопластной ДНК». Ежегодный обзор микробиологии. 49: 117–43. Дои:10.1146 / annurev.mi.49.100195.001001. PMID 8561456.
- ^ а б Эмлен, Вт; О'Нил, Л. (сентябрь 1997 г.). «Клиническое значение антинуклеарных антител: сравнение обнаружения с помощью иммунофлуоресценции и иммуноферментного анализа». Артрит и ревматизм. 40 (9): 1612–8. Дои:10.1002 / арт.1780400910. PMID 9324015.
- ^ Дешпанде, С. С. (1996). Иммуноферментные анализы: от концепции до разработки продукта. Лондон: Чепмен и Холл. ISBN 978-0-412-05601-7.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap Таблица 6-2 в: Элизабет Д Агабеги; Агабеги, Стивен С. (2008). Шаг вперед к медицине (серия Step-Up). Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7153-5.
- ^ Frokjaer, Vibe G .; Мортенсен, Эрик Л .; Nielsen, Finn Å .; Хаугбол, Стивен; Пинборг, Ларс Х .; Адамс, Карен Х .; Сварер, Клаус; Hasselbalch, Steen G .; Holm, Soeren; Полсон, Олаф Б .; Кнудсен, Гитте М. (29 февраля 2008 г.). «Связывание рецептора фронтолимбического серотонина 2А у здоровых субъектов связано с факторами риска личности для аффективного расстройства». Биологическая психиатрия. 63 (6): 569–576. Дои:10.1016 / j.biopsych.2007.07.009. PMID 17884017. S2CID 25979780.
- ^ Tektonidou, MG; Анаплиоту, М; Vlachoyiannopoulos, P; Мутсопулос, HM (1 сентября 2004 г.). «Наличие системных аутоиммунных нарушений у пациентов с аутоиммунными заболеваниями щитовидной железы». Анналы ревматических болезней. 63 (9): 1159–1161. Дои:10.1136 / ard.2004.022624. ЧВК 1755126. PMID 15308528.
- ^ а б Петри, М; Карлсон, EW; Купер, Д.С. Ладенсон, П. В. (октябрь 1991 г.). «Тесты на аутоантитела при аутоиммунном заболевании щитовидной железы: исследование случай-контроль». Журнал ревматологии. 18 (10): 1529–31. PMID 1765977.
- ^ Чарльз, П. Дж .; Smeenk, R. J. T .; Де Йонг, Дж .; Feldmann, M .; Майни, Р. Н. (1 ноября 2000 г.). «Оценка антител к двухцепочечной ДНК, индуцированной у пациентов с ревматоидным артритом после лечения инфликсимабом, моноклональным антителом к фактору некроза опухоли α: результаты открытых и рандомизированных плацебо-контролируемых исследований». Артрит и ревматизм. 43 (11): 2383–2390. Дои:10.1002 / 1529-0131 (200011) 43:11 <2383 :: AID-ANR2> 3.0.CO; 2-D. PMID 11083258.
- ^ Cassani, F; Cataleta, M; Валентини, П; Muratori, P; Giostra, F; Francesconi, R; Muratori, L; Лензи, М; Bianchi, G; Заули, Д; Бианки, Ф. Б. (1 сентября 1997 г.). «Сывороточные аутоантитела при хроническом гепатите С: сравнение с аутоиммунным гепатитом и влияние на профиль болезни». Гепатология. 26 (3): 561–566. Дои:10.1002 / hep.510260305. PMID 9303483. S2CID 3228360.
- ^ Медина-Родригес, Франция; Гусман, К; Jara, LJ; Гермида, C; Alboukrek, D; Сервера, H; Миранда, JM; Фрага, А. (ноябрь 1993 г.). «Ревматические проявления у людей с положительным и отрицательным результатом на вирус иммунодефицита человека: исследование двух популяций со схожими факторами риска». Журнал ревматологии. 20 (11): 1880–4. PMID 8308773.
- ^ Харгрейвс М., Ричмонд Х, Мортон Р. Представление двух компонентов костного мозга, кислой клетки и клетки LE. Mayo Clin Proc, 1948; 27: 25–28.
- ^ Holborow, E.J .; Weir, D. M .; Джонсон, Г. Д. (28 сентября 1957 г.). «Сывороточный фактор красной волчанки со сродством к тканевым ядрам». BMJ. 2 (5047): 732–734. Дои:10.1136 / bmj.2.5047.732. ЧВК 1962253. PMID 13460368.
внешняя ссылка
- Блог аутоиммунитета - сводка HEp-2 ANA
- Антинуклеарные + антитела в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Greidinger, Eric L .; Хоффман, Д. О.; Роберт У. (31 января 2003 г.). «Обновление CE [химия | иммунология]: тестирование на антинуклеарные антитела: методы, показания и интерпретация». Лабораторная медицина. 34 (2): 113–117. Дои:10.1309 / VUB90VTPMEWV3W0F.
