Надсемейство резистентность-клубенько-деление клеток - Resistance-nodulation-cell division superfamily
| RND надсемейство пермеаз | |
|---|---|
 Кристаллизованный AcrB: Белок подкласса HAE-RND, участвующий в оттоке лекарств и амфифильных клеток. | |
| Идентификаторы | |
| Символ | RND_Permease |
| Pfam клан | CL0322 |
| TCDB | 2.A.6 |
| OPM суперсемейство | 16 |
| Белок OPM | 2gif |
Сопротивление-нодуляция-деление (RND) семейные перевозчики относятся к категории насосы для удаления бактерий, особенно выявленные в Грамотрицательные бактерии и расположен в цитоплазматической мембране, что активно транспортировать субстраты. RND надсемейство включает семь семейств: отток тяжелых металлов (HME), гидрофоб / amphiphile efflux-1 (грамотрицательные бактерии), семейство экспортеров фактора клубеньков (NFE), семейство вспомогательных белков секреции белка SecDF, семейство гидрофобных / амфифильных эффлюкс-2, эукариотический стерол гомеостаз семейство и семейство гидрофобных / амфифильных эффлюкс-3.[1] Эти системы RND участвуют в поддержании гомеостаз клетки, удаление токсичные соединения, и экспорт детерминанты вирулентности.[2] Они имеют широкий спектр субстратов и могут привести к снижению активности неродственных классов лекарств, если они чрезмерно экспрессированы. Первые сообщения о лекарственной устойчивости бактериальные инфекции сообщалось в 1940-х годах после первого массового производства антибиотики.[3] Большинство транспортных систем суперсемейства RND состоит из больших полипептидных цепей.[4] Белки RND существуют в основном у грамотрицательных бактерий, но также могут быть найдены в грамположительные бактерии, археи, и эукариоты.
Функция
Белок RND определяет субстрат для завершенных транспортных систем, включая: ионы металлов, ксенобиотики или же наркотики. Транспортировка гидрофобный и амфифильный соединения выполняются подсемейством HAE-RND. Пока истечение тяжелые металлы предварительно сформированы HME-RND.[5]

Механизм и структура
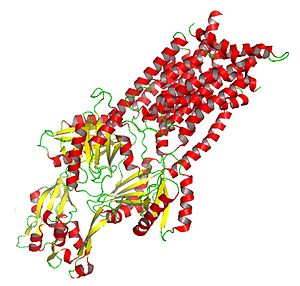
Белки RND большие и могут включать более 1000 аминокислота остатки. Обычно они состоят из двух гомологичный субъединицы (предполагая, что они возникли в результате внутригенного тандемного события дупликации, которое произошло в первичной системе до расхождения членов семейства), каждая из которых содержит периплазматический петля, прилегающая к 12 трансмембранной спирали. Из двенадцати спиралей есть единственный трансмембранный гаечный ключ (TMS) на N-конец за ним следует большой экстрацитоплазматический домен, затем шесть дополнительных TMS, второй большой экстрацитоплазматический домен и пять последних C-концевых TMS. TM4 определяет специфичность определенного субстрата в данном белке RND. Следовательно, TM4 может быть индикатором специфичности RND без явного знания остальной части белка.[6]
Насосы RND представляют собой находящуюся в цитоплазме часть полного трехкомпонентного комплекса (рис. 1), который распространяется через внешнюю и внутреннюю мембраны грамотрицательных бактерий, также обычно называемых системой оттока CBA. Белок RND ассоциируется с каналом внешней мембраны и периплазматический Адаптерный белок, а ассоциация всех трех белков позволяет системе экспортировать субстраты во внешнюю среду, обеспечивая огромное преимущество для бактерии.[7]
Белок CusA, член-переносчик HME-RND, мог быть кристаллизованный предоставление ценной структурной информации о насосах HME-RND. CusA существует как гомотример с каждым блоком, состоящим из 12 трансмембранный спирали (TM1-TM12). Периплазматический домен состоит из двух спиралей TM2 и TM8. Кроме того, периплазматический домен состоит из шести субдоменов, PN1, PN2, PC1, PC2, DN, DC, которые образуют центральную пору и док-домен. Центральная пора образована PN1, PN2, PC1, PC2 и вместе стабилизирует тримерную организацию гомотример.[8]
Отток ионов металлов (HME-RND)
Семейство HME-RND функционирует как центральный протеиновый насос в истечении ионов металлов, питаемых протонной подложкой антипорт. В это семейство входят насосы, перекачивающие одновалентные металлы - система Cus, и насосы, перекачивающие двухвалентные металлы - система Czc.[5]
Тяжелый металл сопротивление со стороны семьи RND было впервые обнаружено в R. Metallidurans через CzcA, а затем через белок CnrA. Наиболее охарактеризованные белки RND включают CzcCBA (Cd2+, Zn2+, и Co2+), CnrCBA (Ni2+ и Ко2+) и NccCBA (Ni2+, Co2+ и Cd2+) в Cupriavidus, Czr (Cd2+ и Zn2+ сопротивление) в Синегнойная палочка, и Czn (Cd2+, Zn2+, а Ni2+ сопротивление) в Helicobacter pylori.[9] Было высказано предположение, что истечение ионов металлов происходит из цитоплазма и периплазма на основе расположения нескольких сайтов связывания субстрата на белке RND.[6]
CznCBA
Система Czn поддерживает гомеостаз Кадмий, Цинк, и Никель сопротивление; он участвует в Уреаза модуляция и колонизация желудка Хеликобактер пилори. Белки CznC и CznA играют доминирующую роль в гомеостазе никеля.[10]
CzcCBA
Czc оказывает сопротивление Кобальт, Цинк, и Кадмий. Оперон CzcCBA включает: CzcA (белок семейства RND), мембрана слитый белок (MFP) CzcB и белок фактора внешней мембраны (OMF) CzcC, все из которых образуют активный трехкомпонентный комплекс, и czcoperon. Выражение оперон регулируется ионами металлов.[6]
Лекарственная устойчивость (HAE-RND)
Семейство RND играет важную роль в создании внутренней и повышенной множественной лекарственной устойчивости у грамотрицательных бактерий. Экспорт амфифильный и гидрофобный субстратов регулируется семейством HAE-RND. В Кишечная палочка Были специально идентифицированы пять насосов RND: AcrAB, AcrAD, AcrEF, MdtEF и MdtAB. Хотя неясно, как трехчастный комплекс работает у бактерий, были предложены два механизма: Модель моста адаптера и Модель упаковки адаптера.
Участие HAE-RND в детоксикация а экспорт органических субстратов позволил в последнее время охарактеризовать конкретные насосы в связи с их растущим медицинским значением. Половина устойчивости к антибиотикам продемонстрирована в in vivo больничные штаммы Синегнойная палочка был отнесен к белкам оттока RND. P. aeruginosa содержат 13 транспортных систем RND, включая одну HME-RND и остальные HAE-RND. Среди наиболее известных - белки Mex: MexB, MexD и MexF, которые детоксифицируют органические вещества. Предполагается, что системы MexB демонстрируют субстратную специфичность для бета-лактамы; в то время как система MexD проявляет специфичность к цефемным соединениям.[6]
Кишечная палочка - AcrB
В Кишечная палочка Множественная лекарственная устойчивость развивается в результате множества механизмов. Особое беспокойство вызывает способность механизмов оттока обеспечивать широкополосное сопротивление. Отводящие насосы RND обеспечивают экструзию для ряда соединений. Пять белковых транспортеров в Кишечная палочка клетки, принадлежащие к подсемейству HAE-RND, классифицированы,[11] включая мультилекарственный выходной белок AcrB, белок внешней мембраны TolC и периплазматический адаптерный белок AcrA.[12] Белки TolC и AcrA также используются в трехкомпонентном комплексе в других идентифицированных белках оттока RND.[11] Система оттока AcrAB-TolC отвечает за отток антимикробных препаратов, таких как пенициллин G, клоксациллин, нафциллин, макролиды, новобиоцин, линезолид, и фузидиевая кислота антибиотики. Другие субстраты включают красители, моющие средства, некоторые органические растворители, и стероидные гормоны. Способы, которыми липофильные домены субстрата и насосы RND, полностью не определены.
Кристаллизованный белок AcrB дает представление о механизме действия белков HAE-RND и других белков семейства RND.[6]
Отток множественного лекарственного транспорта (Mdt)
Mdt (A) - это откачивающий насос, который придает устойчивость к различным лекарствам. Это выражается в L. lactis, E. coli и различные другие бактерии. В отличие от других белков RND, Mdt (A) содержит предполагаемый сайт связывания АТФ и два С-мотива, консервативных в его пятом TMS. Mdt эффективен при обеспечении устойчивости бактерий к тетрациклин, хлорамфеникол, линкозамиды и стрептомицин. Источник энергии для активного истечения Mdt (A) в настоящее время неизвестен.[13]
Рекомендации
- ^ Ценг Т.Т., Грэтвик К.С., Коллман Дж., Парк Д., Ниес Д.Х., Гоффо А., Сайер М.Х. (август 1999 г.). «Суперсемейство пермеаз RND: древнее, повсеместное и разнообразное семейство, которое включает в себя белки болезней и развития человека». Журнал молекулярной микробиологии и биотехнологии. 1 (1): 107–25. PMID 10941792.
- ^ Койн С., Розенфельд Н., Ламберт Т., Курвалин П., Перихон Б. (октябрь 2010 г.). «Сверхэкспрессия насоса деления резистентности-клубеньков AdeFGH обеспечивает множественную лекарственную устойчивость у Acinetobacter baumannii». Противомикробные препараты и химиотерапия. 54 (10): 4389–93. Дои:10.1128 / AAC.00155-10. ЧВК 2944555. PMID 20696879.
- ^ Раус, Мэтью Дэвид, "Структура, функция и регуляция белков экспорта нескольких лекарственных препаратов среди суперсемейства RND у грамотрицательных бактерий" (2010). Кандидатские диссертации и диссертации. Документ 11401.http://lib.dr.iastate.edu/etd/11401
- ^ "2.A.6 Суперсемейство резистентно-клубневых клеток (RND)". База данных классификации транспортеров.
- ^ а б Мораледа-Муньос А., Перес Дж., Экстремра А. Л., Муньос-Дорадо Дж. (Сентябрь 2010 г.). «Дифференциальная регуляция шести систем оттока тяжелых металлов в ответе Myxococcus xanthus на медь». Прикладная и экологическая микробиология. 76 (18): 6069–76. Дои:10.1128 / AEM.00753-10. ЧВК 2937488. PMID 20562277.
- ^ а б c d е Nies DH (июнь 2003 г.). «Опосредованная оттоком устойчивость к тяжелым металлам у прокариот». Обзор микробиологии FEMS. 27 (2–3): 313–39. Дои:10.1016 / s0168-6445 (03) 00048-2. PMID 12829273.
- ^ Никайдо Х (2011). «Устройство и механизм многокомпонентных отводящих насосов типа РНД». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 77. С. 1–60. Дои:10.1002 / 9780470920541.ch1. ISBN 9780470920541. ЧВК 3122131. PMID 21692366.
- ^ Long F, Su CC, Zimmermann MT, Boyken SE, Rajashankar KR, Jernigan RL, Yu EW (сентябрь 2010 г.). «Кристаллические структуры откачивающего насоса CusA предполагают опосредованный метионином транспорт металлов». Природа. 467 (7314): 484–8. Дои:10.1038 / природа09395. ЧВК 2946090. PMID 20865003.
- ^ Валенсия EY, Браз VS, Гуццо C, Маркес М.В. (апрель 2013 г.). «Два белка RND, участвующие в оттоке тяжелых металлов у Caulobacter crescentus, принадлежат к отдельным кластерам внутри протеобактерий». BMC Microbiology. 13: 79. Дои:10.1186/1471-2180-13-79. ЧВК 3637150. PMID 23578014.
- ^ Шталер Ф. Н., Оденбрайт С., Хаас Р., Уилрих Дж., Ван Влит А. Х., Кустерс Дж. Г., Кист М., Бересвилл С. (июль 2006 г.). «Новый отток металла Helicobacter pylori CznABC необходим для устойчивости к кадмию, цинку и никелю, модуляции уреазы и колонизации желудка». Инфекция и иммунитет. 74 (7): 3845–52. Дои:10.1128 / IAI.02025-05. ЧВК 1489693. PMID 16790756.
- ^ а б Анес Дж., Маккаскер МП, Фаннинг С., Мартинс М. (2015). «Плюсы и минусы насосов для оттока RND при кишечной палочке». Границы микробиологии. 6: 587. Дои:10.3389 / fmicb.2015.00587. ЧВК 4462101. PMID 26113845.
- ^ Никайдо Х., Такацука Й. (май 2009 г.). «Механизмы многокомпонентных насосов РНД». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1794 (5): 769–81. Дои:10.1016 / j.bbapap.2008.10.004. ЧВК 2696896. PMID 19026770.
- ^ Перретен В., Шварц Ф.В., Тойбер М., Леви С.Б. (апрель 2001 г.). «Mdt (A), новый оттокный белок, придающий множественную устойчивость к антибиотикам у Lactococcus lactis и Escherichia coli». Противомикробные препараты и химиотерапия. 45 (4): 1109–14. Дои:10.1128 / AAC.45.4.1109-1114.2001. ЧВК 90432. PMID 11257023.
