Порфириноген - Porphyrinogen
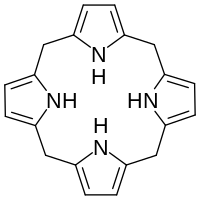
В биохимия а порфириноген является членом класса природных соединений с тетрапиррол ядро, а макроцикл четырех пиррол кольца соединены четырьмя метиленовые мостики.[1] Их можно рассматривать как производные от исходного соединения. гексагидропорфин заменой различных функциональные группы для водород атомы в самом внешнем (20-углеродном) кольце.
Порфириногены являются промежуточными продуктами в биосинтез из порфирины, кофакторы с порфин ядра, которые содержатся во многих ферментах и белках, включая миоглобин, гемоглобин, цитохромы, и хлорофиллы.[2]
Порфирины отличаются от порфириногенов наличием четырех пиррольных колец, связанных между собой метиновые мосты = CH− вместо метиленовых мостиков -CH
2−, а из-за отсутствия атома водорода в двух из четырех амин −NH− группы, превратив их в имины = N−. В биосинтезе порфиринов родительский порфириноген дегидрируется посредством протопорфириногеноксидаза.
Из-за ограниченной делокализации порфириногены бесцветны. Потеря всех четырех центральных атомов водорода в ядре дает четырехвалентный анион, который может действовать как лиганд для катионов металлов, создавая координационное соединение.[3] Последующие промежуточные продукты биосинтеза на пути к порфиринам сильно окрашены и часто фитотоксичный.
Природные порфириногены
Порфирогены, которые встречаются в живых организмах, обычно имеют боковые цепи, заменяющие некоторые или все водород атомы в двух крайних углерод атомы каждого пиррол кольцо (в отличие от атомов водорода в метиленовых мостиках).

Уропорфириноген III, предшественник копропорфириногена III.
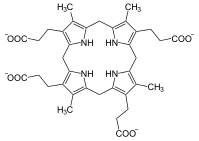
копропорфириноген III, предшественник протопорфириногена IX.
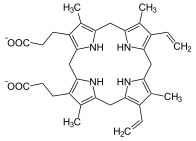
Протопорфириноген IX, предшественник протопорфирин IX.
Неприродные порфириногены
Различные синтетические порфириногены были произведены и исследованы в лабораториях. У них часто есть боковые группы, которые не встречаются в природе, и, возможно, у атомов углерода в метиленовых мостиках (мезо позиции) вместо пиррольных колец. В Мезо-замещенные порфириногены являются промежуточными продуктами в так называемых Линдси синтез мезозамещенных порфиринов. Окисление превращает центральное ядро гексагидропорфина в ядро порфина, давая желаемый порфирин.[4]
Под кислотный катализ, пиррол и кетоны R− (C = O) −R ' или альдегиды R− (C = O) −H конденсироваться с образованием многих олигомеров, в том числе циклических. [- (CRR ') - (C
4ЧАС
2NH) -]
п\. Желаемые порфириногены (п = 4) можно разделить.[4] Мезозамещенные порфириногены с восемью неводородными боковыми цепями также называют каликс [4] пирролы. Эти продукты сопротивляются дегидрирование внешнего кольца лучше, чем природные порфириногены.[3]
Например, конденсация с бензальдегид C
6ЧАС
5- (C = O) −H дает мезо-тетрафенилпорфириноген, который может окисляться до мезо-тетрафенилпорфирин.[4] Конденсация с ацетон ЧАС
3C− (C = O) −CH
3 дает мезо-октаметипорфириноген, родитель мезо-октаметилпорфирин.[3]
В качестве альтернативы, пиррол с боковыми цепями, замещенными атомами углерода 3 и 4 (не примыкающими к азоту), может быть конденсирован с формальдегид H− (C = O) −H давать порфириногены, более похожие на натуральные. Например, с 3,4-диэтилпиррол можно получить октаэтилпорфириноген, родитель октаэтилпорфирин.[нужна цитата ]

Мезооктаметилпорфириноген (CAS 4475-42-7).
использованная литература
- ^ порфириногены - ИЮПАК Золотая книга
- ^ Пол Р. Ортис де Монтельяно (2008). «Гемы в биологии». Энциклопедия химической биологии Wiley. Джон Вили и сыновья. Дои:10.1002 / 9780470048672.wecb221. ISBN 978-0470048672.
- ^ а б c Сесслер, Джонатан Л .; Анценбахер, Павел младший; Миядзи, Хидэкадзу; Юрсикова, Каролина; Bleasdale, Ellen R .; Гейл, Филип А. (2000). «Модифицированные каликс [4] пирролы». Промышленные и инженерные химические исследования. 39 (10): 3471–3478. Дои:10.1021 / ie000102y.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c Линдси, Джонатан С. (2000). «Синтез мезозамещенных порфиринов». В Кадиш, Карл М .; Смит, Кевин М .; Гилард, Роджер (ред.). Справочник по порфиринам. 1. С. 45–118. ISBN 0-12-393200-9.




