IQGAP1 - IQGAP1
Белок, активирующий Ras-ГТФазу, IQGAP1 (IQGAP1), также известный как p195 повсеместно выраженный белок что у людей кодируется IQGAP1 ген.[5][6][7] IQGAP1 - это каркасный белок участвует в регуляции различных клеточных процессов, начиная от организации актин цитоскелет, транскрипция и клеточная адгезия регулированию клеточный цикл.
История
IQGAP1 был открыт в 1994 году.[5]Его название связано с тем, что его RasGAP-родственный домен (GRD) имеет гомологию последовательности с Sar1 ГТФаза.[8] Было высказано предположение, что IQGAP1 будет действовать как Белок, активирующий ГТФазу (GAP) белок, способствующий переключению ras GTPases от активного GTP к формам, связанным с GDP. Однако, несмотря на гомологию домена GAP IQGAP с sar1 и тот факт, что IQGAP1 связывает Rho GTPases Rac1 и Cdc42, IQGAP фактически не имеет функции GAP. Вместо этого он связывает активные (связанные с GTP) формы RAC1 и CDC42 с более высоким сродством, чем формы, связанные с GDP, и стабилизирует активную форму in vivo.[9]
IQGAP1 теперь признан белковым каркасом, который объединяет сигналы, регулирующие клеточная адгезия, актин цитоскелет, клеточный цикл,[9] и другие клеточные функции. IQGAP особенно интересен как терапевтическая мишень, поскольку он действует как узел для многих сигнальных путей, участвующих в рак прогрессия.
Выражение
Анализ экспрессии IQGAP1 в тканях человека показал, что скаффолд экспрессируется более или менее повсеместно.[10] Обычно встречается в ядро, плазматическая мембрана, и цитоплазма. Другими словами, он обнаруживается во всей клетке, а также во всех типах тканей. Анализ экспрессии также показал, что IQGAP1 сверхэкспрессируется при многих формах рака, а при более агрессивном колоректальном раке и раке яичников IQGAP1 локализуется на инвазивном фронте новообразования, что указывает на его роль в мобилизации клеток.[8] Важно отметить, что примерно 10% генов, проявляющих повышенную экспрессию в метастатический клетки являются партнерами связывания IQGAP1.[8]
Домены
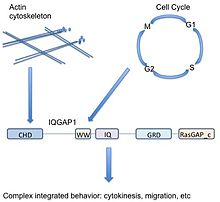
IQGAP1 представляет собой белок 190 кДа с 5 доменами.[9] А белковый домен представляет собой часть белка, которая многократно встречается в биологии и может существовать независимо от окружающего белка. Он очень похож на части других белков и может быть вырезан из текущего белка, существовать и функционировать сам по себе, или быть вставлен в новую белковую цепь и при этом функционировать должным образом. Поскольку эта область белка является консервативной по аминокислотной последовательности и структуре, ее можно охарактеризовать функцией или партнером по связыванию. IQGAP1 имеет 5 хорошо известных доменов, разделенных другими аминокислотами.

Начиная с N-конец (или перед белком) IQGAP1 содержит домен гомологии кальпонина (CHD), который опосредует связывание актина[11] и связывает кальпонин.
WW, или полипролиновый белок-белковый домен, названный так из-за двух функционально консервативных триптофанов, W, представляет собой домен белок-белкового взаимодействия, который ассоциируется с богатыми пролином участками других белков.[12][13]
В WW домен следует 4 IQ мотивы которые образуют IQ-домен. Этот домен связывает кальмодулин,[14] белок, известный как датчик кальция, который может связывать и регулировать многие целевые белки.[15]
GRD (домен, связанный с rasGAP) следует за доменом IQ. Этот домен очень похож на функциональную субъединицу Рас Белки, активирующие ГТФазу (GAP) и, таким образом, считалось, что он имеет функцию GAP. IQGAP1 связывает Rho GTPases CDC42 и RAC1 однако IQGAP1 необычен тем, что фактически не имеет функции GAP, а вместо этого стабилизирует GTP-связанные белки в их активном состоянии.[16]
Наконец, IQGAP1 имеет карбоксиконцевую последовательность RasGAP_c, важную для связывания. Бета-катенин и E-кадгерин.[9]
Родственные белки
Гомологи IQGAP1 известны у таких различных видов, как дрожжи, черви и люди (а также у других млекопитающих), хотя домены не всегда высококонсервативны.[9]
IQGAP1 - наиболее хорошо изученный член семейства каркасных белков IQGAP. Два других члена семьи включают IQGAP2 и IQGAP3 которые имеют гораздо более ограниченные паттерны экспрессии по сравнению с IQGAP1. IQGAP2 обнаруживается в печени, желудке и тромбоцитах и на 62% идентичен IQGAP1,[9] но, по всей видимости, имеет совершенно противоположную функцию с точки зрения патологии.[17]
В головном мозге IQGAP3, по-видимому, играет важную роль в морфогенезе нейронов.[18]
Функция
Этот ген кодирует член IQGAP семья. В белке содержится четыре IQ домены, один домен гомологии кальпонина, один Ras-GAP домен и один WW домен. Он взаимодействует с компонентами цитоскелет[19] такие как формин Dia1 (mDia1 ),[20] с молекулами клеточной адгезии (САМ ), а также с несколькими сигнальными молекулами для регулирования клеточного морфология и подвижность. Например, экспрессия IQGAP1 необходима для разрастания нейронального процесса на молекуле клеточной адгезии PTPmu (PTPRM ).[21] Экспрессия белка усиливается амплификацией гена в двух рак желудка Сотовые линии[7] и его сверхэкспрессия и отчетливая мембранная локализация также наблюдаются в ряде опухолей.[22]
Взаимодействия
IQGAP1 - это узел, пересекаемый многими сигнальными путями. Таким образом, он имеет множество партнеров по связыванию, многие из которых играют важную роль в контроле клеточного цикла и актинового цитоскелета.
IQGAP1 показал себя взаимодействовать с участием:
- Кальмодулин 1,[23][24]
- CDC42,[6][25][26][27][28]
- CDH1,[29]
- CLIP1,[26]
- PRKACA,[30]
- RAC1,[6][25][26][28] и
- S100B.[31]
- Актин - структура цитоскелета
- ARF6
- APC
- Бета-катенин –Клеточная адгезия и передача сигналов WNT: транскрипция
- Б-раф - Путь MAPK
- CD44
- Erk1 / 2 - путь MAPK, контроль клеточного цикла, пролиферация
- Mek ½ - путь MAPK, контроль клеточного цикла, пролиферация
- Src
- PTPmu (PTPRM )[21]
- полный список на [32]
Функция как подмости
Связывание с белками само по себе не создает интересной истории. Гораздо важнее результат привязки. Изменяет ли связывание локализацию целевого белка? Активирует ли он мишень или каким-то образом изменяет конформацию мишени (или эффекторной молекулы)? Как каркасный белок, IQGAP1 связывает и регулирует многие мишени - его роль заключается в интеграции и передаче сигналов от различных путей и изоляции ключевых участников пути от перекрестные помехи.
Строительные леса организуют сигнальные пути - помогают регулировать, как различные внеклеточные сигналы могут передаваться одними и теми же членами канонического пути в различные клеточные выходы.[33] Как правило, скаффолды регулируют выход, локализацию и селективность путей.[34]
Как каркас, участвующий в различных сигнальных путях (актин цитоскелет, клеточная адгезия, клеточный цикл, транскрипция), IQGAP1 обладает уникальной способностью потенциально связывать различные клеточные функции. Например, IQGAP1 связан с динамикой актина через прямое связывание актина и косвенную регуляцию через Cdc42 / Rac1, но также модулирует Путь MAPK который связан с контролем клеточного цикла. Таким образом, IQGAP1 может связывать сигнализацию MAPK (решения о судьба клетки ) к цитоскелету или клеточной адгезии (потенциально влияя на эти решения) - важное значение для рака.
Для упрощения, из-за своего разнообразного диапазона партнеров по связыванию, IQGAP1 может действовать как связующее звено между логически связанными, но молекулярно различными клеточными функциями. В приведенном выше примере перестройка актинового цитоскелета необходима для распространение (цитокинез в течение митоз ). IQGAP1 помогает клеткам как прислушиваться к сигналам, так и действовать на них, играя важную роль в соединении точек между сигналами пролиферации и фактическим клеточным ответом.
Ключевые пути
ERK MAPK
В Рас →Раф →МЕК →ERK Сигнальный путь MAPK играет неотъемлемую роль в процессах распространение клеток, дифференциация, и апоптоз. Этот путь сохраняется во всех эукариоты.
Различные внеклеточные сигналы индуцируют путь ERK MAPK, включая EGF, IGF-1, PDGF, и NGF.[33] Различные каркасы этого пути, включая IQGAP1, ответственны за модуляцию клеточного ответа на активность этого пути. Например, в данной клеточной линии активация одним внеклеточным сигналом может вызывать дифференцировку, но не пролиферацию, тогда как активация одного и того же пути ERK MAPK другим внеклеточным сигналом будет вызывать пролиферацию, но не дифференцировку.[33] IQGAP1, по-видимому, отвечает за специфический выход пути после активации EGF.
IQGAP1 играет важную роль в распространении этого сигнального пути MAPK. IQGAP связывает напрямую б-РАФ,[35] MEK1 / 2 и ERK1 / 2, и фактически он необходим для фосфорилирования (активации) ERK при стимуляции EGF.[36][37]
Цитоскелетный контроль (динамика актина)
Актин является основным строительным блоком цитоскелета каждой эукариотической клетки. Динамика актина играет важную роль в подвижность клеток (филаменты строятся на переднем крае движущейся клетки и разрушаются на отступающей стороне). IQGAP1 связывает актин и влияет на динамику актина, локализуясь на переднем крае и рекрутируя полимеризация актина машины.[8][9][19]
IQGAP1 связывается и является мишенью Rho GTPases CDC42 и RAC1 которые являются хорошо известными регуляторами актинового цитоскелета.[38][39] Несмотря на свое название, IQGAP1 не имеет функции GAP, а вместо этого стабилизирует активный Cdc42. Это увеличение локального пула активного Cdc42 стимулирует актин образование нити и, следовательно, филоподии формирование.[9]
IQGAP1 может перекрестно связывать актин,[40] и у многих организмов IQGAP1 участвует в цитокинез.[41]
Адгезия
Кадгерины представляют собой семейство адгезионных белков, которые локализуются на поверхности клетки, где они прикрепляют клетку к ее соседям, сцепляясь с внеклеточной частью кадгеринов соседа. Актин связывает а-катенин что связывает бета-катенин что, в свою очередь, связывает E-кадгерин. E-кадгерин выступает во внеклеточное пространство, чтобы захватить внеклеточные домены соседних E-кадгеринов. IQGAP1 локализуется в контактах между клетками и связывает актин, b-катенин и E-кадгерин, ослабляя эти соединения и, таким образом, уменьшая адгезию между клетками.[9][42] IQGAP ослабляет клеточную адгезию, вытесняя α-катенин из комплекса.[43]
Активный RAC1 связывает IQGAP1 с поперечными связями актиновых филаментов и предотвращает взаимодействие IQGAP1 с бета-катенин, стабилизирующий межклеточные контакты.[44] Однако, когда IQGAP1 не связывает Rac1, он связывает бета-катенин, вытесняя а-катенин из комплекса клеточной адгезии кадгерин-катенин.
Транскрипция
IQGAP1 также влияет на транскрипцию через Сигнальный путь Wnt своим взаимодействием с бета-катенин.[8] Бета-катенин обычно изолирован в комплексе и исключается из ядра, но после активации WNT этот комплекс разрушается, и бета-катенин перемещается в ядро, где активирует программы транскрипции. IQGAP1 связывает b-катенин и увеличивает ядерную локализацию и экспрессию транскрипционных мишеней бета-катенина.
Клиническое значение
IQGAP1 связан с цитоскелет динамика, транскрипция, клеточная адгезия, клеточный цикл, и морфология, все из которых нарушены в рак. Как модулирующий белок, пересекающий все эти пути, IQGAP1 может связывать многие из них, а также отвечает за их правильное распространение. Поскольку рак - это заболевание, характеризующееся нарушением многих из этих клеточных процессов, IQGAP1 является логичным онкоген кандидат и терапевтическая цель.
Анализ экспрессии показал, что IQGAP1 участвует в колоректальный, плоскоклеточный, грудь, желудочный, печень, легкое, и яичник раки,[45] и при некоторых из этих видов рака более высокие уровни экспрессии IQGAP1 указывают на плохой прогноз.[46]
Для того, чтобы рак метастазировать, клетки должны получить миграционные способности и проникать в другие ткани. Через Rac1 / CDC42 IQGAP1 регулирует клеточную адгезию и динамику актина.
В нормальных клетках IQGAP1 локализуется в областях с высоким оборотом актина. Эта характеристика отражается в инвазивных тканях, где IQGAP1 располагается на переднем крае мигрирующих клеток.[8] Сверхэкспрессия IQGAP1 была связана с повышенной миграцией и инвазией в клеточную линию эпителиального рака груди человека (MCF-7 ячеек).[8][47] IQGAP1 также может участвовать в дерегулировании распространение и дифференциация через модуляцию Путь ERK MAPK.
IQGAP1 может понадобиться для туморогенез. Нокдаун IQGAP1 в раковых клетках MCF-7 снижает злокачественный фенотип (сывороточно-зависимая пролиферация и независимый от закрепления рост). У 100% мышей, которым вводили клетки MCF-7, сверхэкспрессирующие IQGAP1, развивались опухоли, и эти опухоли были высокоинвазивными. Контрольные клетки MCF-7 образовывали опухоли у 60% мышей, а клетки MCF-7 со стабильным нокдауном IQGAP1 образовывали опухоли только в 20% случаев.[47] Большой интерес представляет механизм того, как IQGAP1 может модулировать туморогенез / инвазию через своих различных партнеров по связыванию.
Нулевые мыши по IQGAP1 выглядят значительно нормальными, с единственной аномалией в истории жизни, являющейся увеличением желудочного гиперплазия.[48] Таким образом, IQGAP1 может быть эффективной терапевтической мишенью, если его нокдаун оказывает незначительное влияние на гомеостатический ткани, но ее экспрессия важна при раке.
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000140575 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000030536 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Weissbach L, Settleman J, Kalady MF, Snijders AJ, Murthy AE, Yan YX, Bernards A (сентябрь 1994 г.). «Идентификация человеческого rasGAP-родственного белка, содержащего кальмодулин-связывающие мотивы». J. Biol. Chem. 269 (32): 20517–21. PMID 8051149.
- ^ а б c Харт MJ, Callow MG, Соуза Б., Полакис П. (август 1996 г.). «IQGAP1, кальмодулин-связывающий белок с доменом, связанным с rasGAP, является потенциальным эффектором для cdc42Hs». EMBO J. 15 (12): 2997–3005. Дои:10.1002 / j.1460-2075.1996.tb00663.x. ЧВК 450241. PMID 8670801.
- ^ а б «Ген Entrez: мотив IQGAP1, содержащий белок 1, активирующий GTPase».
- ^ а б c d е ж г Белый CD, Brown MD, Sacks DB (июнь 2009 г.). «IQGAPs при раке: семейство каркасных белков, лежащих в основе туморогенеза». FEBS Lett. 583 (12): 1817–24. Дои:10.1016 / j.febslet.2009.05.007. ЧВК 2743239. PMID 19433088.
- ^ а б c d е ж г час я Бриггс М.В., Сакс ДБ (июнь 2003 г.). «Белки IQGAP являются неотъемлемыми компонентами регуляции цитоскелета». EMBO Rep. 4 (6): 571–4. Дои:10.1038 / sj.embor.embor867. ЧВК 1319206. PMID 12776176.
- ^ «IQGAP1: краткое изложение генов и белков». Атлас белков человека. Получено 2011-05-31.
- ^ Страдал Т., Краневиттер В., Виндер С.Дж., Гимона М. (июль 1998 г.). «Возвращение к доменам CH». FEBS Lett. 431 (2): 134–7. Дои:10.1016 / S0014-5793 (98) 00751-0. PMID 9708889.
- ^ Судол М., Чен Х., Бужере С., Эйнбонд А., Борк П. (август 1995 г.). «Характеристика нового белок-связывающего модуля - домена WW». FEBS Lett. 369 (1): 67–71. Дои:10.1016 / 0014-5793 (95) 00550-С. PMID 7641887.
- ^ Масиас М.Дж., Визнер С., Судол М. (февраль 2002 г.). «Домены WW и SH3, два разных каркаса для распознавания лигандов, богатых пролином». FEBS Lett. 513 (1): 30–7. Дои:10.1016 / S0014-5793 (01) 03290-2. PMID 11911877.
- ^ Rhoads AR, Friedberg F (апрель 1997 г.). «Мотивы последовательности для распознавания кальмодулина». FASEB J. 11 (5): 331–40. Дои:10.1096 / fasebj.11.5.9141499. PMID 9141499.
- ^ Стивенс (август 1983 г.). «Кальмодулин: введение». Мочь. J. Biochem. Cell Biol. 61 (8): 906–10. Дои:10.1139 / o83-115. PMID 6313166.
- ^ Курелла В.Б., Ричард Дж. М., Парк К.Л., Лекур Л.Ф., Беллами HD, Уортилейк, Д.К. (май 2009 г.). «Кристаллическая структура домена, связанного с белком, активирующим GTPase, из IQGAP1». J. Biol. Chem. 284 (22): 14857–65. Дои:10.1074 / jbc.M808974200. ЧВК 2685667. PMID 19321438.
- ^ Белый CD, Хурана Х., Гнатенко Д.В., Ли З., Одзе Р.Д., Сакс ДБ, Шмидт В.А. (2010). «IQGAP1 и IQGAP2 реципрокно изменяются при гепатоцеллюлярной карциноме». BMC Гастроэнтерол. 10: 125. Дои:10.1186 / 1471-230X-10-125. ЧВК 2988069. PMID 20977743.
- ^ Ван С., Ватанабе Т., Норитаке Дж., Фуката М., Йошимура Т., Ито Н., Харада Т., Накагава М., Мацуура Ю., Аримура Н., Кайбути К. (февраль 2007 г.). «IQGAP3, новый эффектор Rac1 и Cdc42, регулирует рост нейритов». J. Cell Sci. 120 (Pt 4): 567–77. Дои:10.1242 / jcs.03356. PMID 17244649.
- ^ а б Brandt DT, Grosse R (ноябрь 2007 г.). «Приступим к делу: управление локальной динамикой актина с помощью IQGAP». EMBO Rep. 8 (11): 1019–23. Дои:10.1038 / sj.embor.7401089. ЧВК 2247391. PMID 17972901.
- ^ Брандт Д.Т., Марион С., Гриффитс Г., Ватанабе Т., Кайбути К., Гросс Р. (июль 2007 г.). «Dia1 и IQGAP1 взаимодействуют при миграции клеток и формировании фагоцитарной чашки». J. Cell Biol. 178 (2): 193–200. Дои:10.1083 / jcb.200612071. ЧВК 2064439. PMID 17620407.
- ^ а б Филлипс-Мейсон П.Дж., Гейтс Т.Дж., Майор Д.Л., Сакс Д.Б., Брэди-Калнай С.М. (2006). «Рецептор протеин-тирозинфосфатазы PTPmu взаимодействует с IQGAP1». Журнал биологической химии. 281 (8): 4903–10. Дои:10.1074 / jbc.M506414200. PMID 16380380.
- ^ Джонсон М., Шарма М., Хендерсон Б.Р. (март 2009 г.). «Регуляция IQGAP1 и роль в раке». Cell. Сигнал. 21 (10): 1471–8. Дои:10.1016 / j.cellsig.2009.02.023. PMID 19269319.
- ^ Ли З., Sacks DB (февраль 2003 г.). «Выяснение взаимодействия кальмодулина с IQ-мотивами IQGAP1». J. Biol. Chem. 278 (6): 4347–52. Дои:10.1074 / jbc.M208579200. PMID 12446675.
- ^ Бриггс М.В., Ли З., Сакс Д.Б. (март 2002 г.). «IQGAP1-опосредованная стимуляция совместной активации транскрипции бета-катенином модулируется кальмодулином». J. Biol. Chem. 277 (9): 7453–65. Дои:10.1074 / jbc.M104315200. PMID 11734550.
- ^ а б Курода С., Фуката М., Кобаяси К., Накафуку М., Номура Н., Ивамацу А., Кайбути К. (сентябрь 1996 г.). «Идентификация IQGAP как предполагаемой цели для малых GTPases, Cdc42 и Rac1». J. Biol. Chem. 271 (38): 23363–7. Дои:10.1074 / jbc.271.38.23363. PMID 8798539.
- ^ а б c Фуката М., Ватанабэ Т., Норитаке Дж., Накагава М., Ямага М., Курода С., Мацуура Ю., Ивамацу А., Перес Ф, Кайбути К. (июнь 2002 г.). «Rac1 и Cdc42 захватывают микротрубочки через IQGAP1 и CLIP-170». Ячейка. 109 (7): 873–85. Дои:10.1016 / S0092-8674 (02) 00800-0. PMID 12110184.
- ^ Joyal JL, Annan RS, Ho YD, Huddleston ME, Carr SA, Hart MJ, Sacks DB (июнь 1997 г.). «Кальмодулин модулирует взаимодействие между IQGAP1 и Cdc42. Идентификация IQGAP1 с помощью тандемной масс-спектрометрии с наноэлектрораспылением». J. Biol. Chem. 272 (24): 15419–25. Дои:10.1074 / jbc.272.24.15419. PMID 9182573.
- ^ а б Чжан Б., Чернофф Дж., Чжэн Ю. (апрель 1998 г.). «Взаимодействие Rac1 с белками, активирующими GTPase, и предполагаемыми эффекторами. Сравнение с Cdc42 и RhoA». J. Biol. Chem. 273 (15): 8776–82. Дои:10.1074 / jbc.273.15.8776. PMID 9535855.
- ^ Ли З, Ким Ш., Хиггинс Дж. М., Бреннер МБ, Сакс Д. Б. (декабрь 1999 г.). «IQGAP1 и кальмодулин модулируют функцию E-кадгерина». J. Biol. Chem. 274 (53): 37885–92. Дои:10.1074 / jbc.274.53.37885. PMID 10608854.
- ^ Науэрт Дж. Б., Ригас Дж. Д., Лестер Л. Б. (сентябрь 2003 г.). «Идентификация комплекса IQGAP1 / AKAP79 в бета-клетках». J. Cell. Биохим. 90 (1): 97–108. Дои:10.1002 / jcb.10604. PMID 12938160.
- ^ Mbele GO, Deloulme JC, Gentil BJ, Delphin C, Ferro M, Garin J, Takahashi M, Baudier J (декабрь 2002 г.). «Связывающий цинк и кальций S100B взаимодействует и совместно локализуется с IQGAP1 во время динамической перестройки клеточных мембран». J. Biol. Chem. 277 (51): 49998–50007. Дои:10.1074 / jbc.M205363200. PMID 12377780.
- ^ https://www.ncbi.nlm.nih.gov/gene/8826[требуется полная цитата ]
- ^ а б c Sacks DB (ноябрь 2006 г.). «Роль каркасных белков в передаче сигналов MEK / ERK». Biochem. Soc. Транс. 34 (Pt 5): 833–836. Дои:10.1042 / BST0340833. PMID 17052209.
- ^ Хороший MC, Залатан Дж. Г., Лим ВА (май 2011 г.). «Белки каркаса: узлы для управления потоком клеточной информации». Наука. 332 (6030): 680–6. Bibcode:2011Научный ... 332..680G. Дои:10.1126 / science.1198701. ЧВК 3117218. PMID 21551057.
- ^ Ren JG, Li Z, Sacks DB (июнь 2007 г.). «IQGAP1 модулирует активацию B-Raf». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 104 (25): 10465–9. Bibcode:2007ПНАС..10410465Р. Дои:10.1073 / pnas.0611308104. ЧВК 1965536. PMID 17563371.
- ^ Рой М., Ли З., Сакс Д. Б. (апрель 2004 г.). «IQGAP1 связывает ERK2 и модулирует его активность». J. Biol. Chem. 279 (17): 17329–37. Дои:10.1074 / jbc.M308405200. PMID 14970219.
- ^ Рой М., Ли З., Сакс Д. Б. (сентябрь 2005 г.). «IQGAP1 - это каркас для передачи сигналов митоген-активируемой протеинкиназы». Мол. Cell. Биол. 25 (18): 7940–52. Дои:10.1128 / MCB.25.18.7940-7952.2005. ЧВК 1234344. PMID 16135787.
- ^ Зал А (май 1992 г.). «Ras-связанные ГТФазы и цитоскелет». Мол. Биол. Ячейка. 3 (5): 475–9. Дои:10.1091 / mbc.3.5.475. ЧВК 275601. PMID 1611153.
- ^ Нарумия С. (август 1996 г.). «Малая GTPase Rho: клеточные функции и передача сигналов». J. Biochem. 120 (2): 215–28. Дои:10.1093 / oxfordjournals.jbchem.a021401. PMID 8889802.
- ^ Фуката М., Курода С., Фудзи К., Накамура Т., Сёдзи И., Мацуура Ю., Окава К., Ивамацу А., Кикучи А., Кайбути К. (ноябрь 1997 г.). «Регулирование перекрестного сшивания актиновых филаментов с помощью IQGAP1, мишени для Cdc42». J. Biol. Chem. 272 (47): 29579–83. Дои:10.1074 / jbc.272.47.29579. PMID 9368021.
- ^ Маски Л.М. (март 1998 г.). «Цитокинез: IQGAP находят функцию». Curr. Биол. 8 (6): R202–5. Дои:10.1016 / S0960-9822 (98) 70125-3. PMID 9512410.
- ^ Курода С., Фуката М., Накагава М., Фуджи К., Накамура Т., Окубо Т., Идзава И., Нагасе Т., Номура Н., Тани Х., Сёдзи И., Мацуура И., Йонехара С., Кайбути К. (август 1998 г.). «Роль IQGAP1, мишени малых GTPases Cdc42 и Rac1, в регуляции E-кадгерин-опосредованной межклеточной адгезии». Наука. 281 (5378): 832–5. Bibcode:1998Научный ... 281..832K. Дои:10.1126 / science.281.5378.832. PMID 9694656.
- ^ Фуката М., Курода С., Накагава М., Кавадзири А., Ито Н., Сёдзи И., Мацуура Ю., Йонехара С., Фудзисава Х, Кикучи А., Кайбути К. (сентябрь 1999 г.). «Cdc42 и Rac1 регулируют взаимодействие IQGAP1 с бета-катенином». J. Biol. Chem. 274 (37): 26044–50. Дои:10.1074 / jbc.274.37.26044. PMID 10473551.
- ^ Норитаке Дж., Ватанабэ Т., Сато К., Ван С., Кайбути К. (май 2005 г.). «IQGAP1: ключевой регулятор адгезии и миграции». J. Cell Sci. 118 (Pt 10): 2085–92. Дои:10.1242 / jcs.02379. PMID 15890984.
- ^ Атлас белков человека: http://www.proteinatlas.org/ENSG00000140575
- ^ Макдональд К.Л., О'Салливан М.Г., Паркинсон Дж. Ф., Шоу Дж. М., Пейн Калифорния, Брюер Дж. М., Янг Л., Ридер DJ, Уиллер Х. Т., Кук Р. Дж., Биггс М. Т., Литтл Н. С., Тео С., Стоун Дж., Робинсон Б. Г. (май 2007 г.) . «IQGAP1 и IGFBP2: ценные биомаркеры для определения прогноза у пациентов с глиомой». J. Neuropathol. Exp. Neurol. 66 (5): 405–17. Дои:10.1097 / nen.0b013e31804567d7. PMID 17483698.
- ^ а б Jadeski L, Mataraza JM, Jeong HW, Li Z, Sacks DB (январь 2008 г.). «IQGAP1 стимулирует пролиферацию и усиливает онкогенез эпителиальных клеток груди человека». J. Biol. Chem. 283 (2): 1008–17. Дои:10.1074 / jbc.M708466200. PMID 17981797.
- ^ Ли С., Ван К., Чакладар А., Бронсон Р. Т., Бернардс А. (январь 2000 г.). «Гиперплазия желудка у мышей, лишенных предполагаемого эффектора Cdc42 IQGAP1». Мол. Cell. Биол. 20 (2): 697–701. Дои:10.1128 / mcb.20.2.697-701.2000. ЧВК 85173. PMID 10611248.
дальнейшее чтение
- Тирнауэр Дж.С. (2004). «Новое цитоскелетное соединение для APC: связано с актином через IQGAP». Dev. Ячейка. 7 (6): 778–80. Дои:10.1016 / j.devcel.2004.11.012. PMID 15572120.
- Маккаллум SJ, Wu WJ, Cerione RA (1996). «Идентификация предполагаемого эффектора для Cdc42Hs с высоким сходством последовательности с RasGAP-родственным белком IQGAP1 и партнером по связыванию Cdc42Hs со сходством с IQGAP2». J. Biol. Chem. 271 (36): 21732–7. Дои:10.1074 / jbc.271.36.21732. PMID 8702968.
- Башур А.М., Фуллертон А.Т., Харт М.Дж., Блум Г.С. (1997). «IQGAP1, белок, связывающий Rac и Cdc42, напрямую связывает и перекрестно связывает микрофиламенты». J. Cell Biol. 137 (7): 1555–66. Дои:10.1083 / jcb.137.7.1555. ЧВК 2137827. PMID 9199170.
- Маккаллум SJ, Эриксон JW, Cerione RA (1998). «Характеристика ассоциации актин-связывающего белка, IQGAP и активированного Cdc42 с мембранами Гольджи». J. Biol. Chem. 273 (35): 22537–44. Дои:10.1074 / jbc.273.35.22537. PMID 9712880.
- Сугимото Н., Имото И., Фукуда Й, Курихара Н., Курода С., Танигами А., Кайбути К., Камияма Р., Инадзава Дж. (2001). «IQGAP1, негативный регулятор клеточной адгезии, активируется путем амплификации гена в 15q26 в клеточных линиях рака желудка HSC39 и 40A». J. Hum. Genet. 46 (1): 21–5. Дои:10.1007 / с100380170119. PMID 11289714.
- Набешима К., Шимао Ю., Иноуэ Т., Куно М. (2002). «Иммуногистохимический анализ экспрессии IQGAP1 в колоректальных карциномах человека: его сверхэкспрессия в карциномах и связь с фронтами инвазии». Рак Lett. 176 (1): 101–9. Дои:10.1016 / S0304-3835 (01) 00742-X. PMID 11790459.
- Mateer SC, McDaniel AE, Николас V, Habermacher GM, Lin MJ, Cromer DA, King ME, Bloom GS (2002). «Механизм регуляции активности связывания F-актина IQGAP1 с помощью кальция / кальмодулина». J. Biol. Chem. 277 (14): 12324–33. Дои:10.1074 / jbc.M109535200. PMID 11809768.
- Сварт-Матараза Дж. М., Ли З., Сакс ДБ (2002). «IQGAP1 является компонентом передачи сигналов Cdc42 в цитоскелет». J. Biol. Chem. 277 (27): 24753–63. Дои:10.1074 / jbc.M111165200. PMID 11948177.
- Брандт Д.Т., Марион С., Гриффитс Г., Ватанабе Т., Кайбути К., Гросс Р. (июль 2007 г.). «Dia1 и IQGAP1 взаимодействуют при миграции клеток и формировании фагоцитарной чашки». J. Cell Biol. 178 (2): 193–200. Дои:10.1083 / jcb.200612071. ЧВК 2064439. PMID 17620407.









