Перекрестные помехи (биология) - Crosstalk (biology)
Биологические перекрестные помехи относится к случаям, когда один или несколько компонентов одного преобразование сигнала путь влияет на другой. Это может быть достигнуто несколькими способами, наиболее распространенной из которых является перекрестное взаимодействие между белками сигнальных каскадов. В этих путях передачи сигналов часто есть общие компоненты, которые могут взаимодействовать с любым путем. Более сложный случай перекрестных помех можно наблюдать с трансмембранными перекрестными помехами между внеклеточный матрикс (ECM) и цитоскелет.
Перекрестные помехи между сигнальными путями
Один из примеров перекрестных помех между белками в сигнальном пути можно увидеть с циклический аденозинмонофосфат (цАМФ) в регуляции пролиферации клеток путем взаимодействия с митоген-активированный белок (MAP) киназный путь. цАМФ представляет собой соединение, синтезируемое в клетках аденилатциклазой в ответ на множество внеклеточных сигналов.[1] цАМФ в первую очередь действует как внутриклеточный вторичный мессенджер, основным внутриклеточным рецептором которого является цАМФ-зависимая протеинкиназа (ПКА), которая действует через фосфорилирование целевых белков.[2] Путь передачи сигнала начинается с внеклеточных взаимодействий лиганд-рецептор. Затем этот сигнал передается через мембрану, стимулируя аденилатциклазу на внутренней поверхности мембраны, чтобы катализировать превращение АТФ в цАМФ.[3][4]
ERK, белок, участвующий в сигнальном пути MAPK, может быть активирован или ингибирован цАМФ.[5] цАМФ может ингибировать ERK различными способами, большинство из которых включает в себя цАМФ-зависимую протеинкиназу (PKA) и ингибирование Ras-зависимых сигналов к Raf-1.[6] Однако цАМФ также может стимулировать пролиферацию клеток, стимулируя ERK. Это происходит за счет индукции специфических генов через фосфорилирование фактора транскрипции CREB с помощью PKA.[5] Хотя ERK, по-видимому, не являются необходимыми для этого фосфорилирования CREB, путь MAPK действительно снова играет роль перекрестных помех, поскольку ERK необходимы для фосфорилирования белков ниже CREB.[5] Другие известные примеры потребности в ERK для цАМФ-индуцированных транскрипционных эффектов включают индукцию гена пролактина в клетках гипофиза и гена бета-гидроксилата дофамина в феохромоцитомных клетках (PC12).[6] Существует ряд разнообразных механизмов, с помощью которых цАМФ может влиять на передачу сигналов ERK. Большинство механизмов, включающих ингибирование цАМФ ERK, отделяют Raf-1 от активации Ras посредством прямого взаимодействия PKA с Raf-1 или опосредованно через взаимодействие PKA с GTPase Rap1 [6] (см. рисунок 1). PKA также может негативно регулировать ERK за счет активации PTPases. Механизмы активации ERK с помощью цАМФ еще более разнообразны, обычно включая Rap1 или Ras, и даже непосредственно цАМФ.[6]

Трансмембранные перекрестные помехи
Перекрестные помехи могут наблюдаться даже через мембраны. Мембранные взаимодействия с внеклеточным матриксом (ЕСМ) и с соседними клетками могут вызывать различные реакции внутри клетки. Однако топография и механические свойства ЕСМ также играют важную роль в мощных сложных перекрестных помехах с клетками, растущими на матрице или внутри нее.[7] Например, интегрин -опосредованный цитоскелет сборка и даже подвижность клеток зависят от физического состояния контроллера ЭСУД.[7] Связывание интегрина α5β1 с его лигандом (фибронектин ) активирует образование фибриллярных спаек и актиновые нити.[5] Тем не менее, если ECM иммобилизован, реорганизация матрикса такого рода и образование фибриллярных адгезий подавляются.[7] В свою очередь, связывание того же интегрина (α5β1) с иммобилизованным фибронектиновым лигандом, как видно, образует высоко фосфорилированные очаговые контакты /очаговая адгезия (клетки, участвующие в адгезии матрикса) внутри мембраны и снижает скорость миграции клеток[7] В другом примере перекрестного взаимодействия это изменение в составе фокальных контактов в цитоскелете может быть ингибировано участниками еще одного пути: ингибиторами киназ легкой цепи миозина или киназ Rho, H-7 или ML-7, которые снижают сократимость клеток. и, следовательно, моторика.[7] (см. рисунок 2).

Перекрестные помехи в активации лимфоцитов
Более сложный, конкретный пример перекрестного взаимодействия между двумя основными сигнальными путями можно наблюдать при взаимодействии сигнальных путей цАМФ и MAPK при активации лимфоциты. В этом случае компоненты пути цАМФ прямо или косвенно влияют на сигнальный путь MAPK, предназначенный для активации гены с участием иммунитет и лимфоциты.
Вновь образованный цАМФ высвобождается из мембрана и диффундирует через внутриклеточное пространство, где он служит для активации PKA. В каталитический субъединица PKA должна связывать четыре молекулы цАМФ для активации, после чего активация состоит из расщепления между регуляторной и каталитической субъединицами.[4] Это расщепление, в свою очередь, активирует PKA, открывая каталитические сайты субъединиц С, которые затем могут фосфорилировать массив белков в клетке.[4]
В лимфоцитах внутриклеточные уровни цАМФ повышаются при стимуляции антиген-рецептора и даже в большей степени в ответ на простагландин E и другие иммуносупрессия агенты.[8] В этом случае цАМФ служит для подавления иммунитета игроков. PKA типа I совместно с Т-клетка и В-клетка рецепторы антигена[9] и вызывает ингибирование активации Т- и В-клеток. PKA даже была выделена как прямой индуктор генов, способствующих иммуносупрессии.[10]
Кроме того, путь цАМФ также взаимодействует с путем MAPK более косвенным образом через взаимодействие с гематопоэтической PTPase (HePTP). HePTP экспрессируется во всех лейкоцитах. При сверхэкспрессии в Т-клетках HePTP снижает активацию транскрипции интерлейкин-2 промоутер обычно индуцируется активированным Т-клеточным рецептором через сигнальный каскад MAPK.[11] Способ, которым HePTP эффективно ингибирует передачу сигналов MAPK, заключается в взаимодействии с MAP-киназами Erk1, Erk2 и p38 через короткую последовательность на некаталитическом N-конце HePTP, называемую мотивом взаимодействия с киназой (KIM).[11][12] Высокоспецифичное связывание Erk и p38 с этой субъединицей HePTP приводит к быстрой инактивации сигнального каскада (см. Рисунок 3).
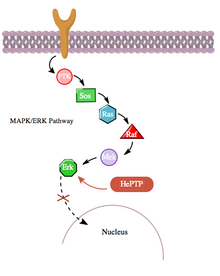
Тем не менее, поскольку и HePTP, и Erk являются цитозольный ферменты,[13] Разумно сделать вывод, что существует механизм прекращения ингибирования Erk HePTP, чтобы позволить транслокацию активированного Erk в ядро. В самом деле, как и во многих других случаях взаимодействия белок-белок, HePTP, по-видимому, фосфорилируется Erk и p38 по сайтам Thr45 и Ser72.[11] Однако важно отметить, что был обнаружен третий сайт фосфорилирования на некаталитическом N-конце (область KIM) HePTP - тот, который фосфорилируется до гораздо более высокой стехиометрии с помощью пути цАМФ,[1] в еще одном случае перекрестного взаимодействия между путями цАМФ и MAPK.
Фосфорилирование этого третьего сайта с помощью PKA из пути цАМФ ингибирует связывание киназ MAP с HePTP и, таким образом, усиливает сигнальный каскад MAPK / ERK. Путь MAPK через Ras, Raf, Mek и Erk проявляет низкую активность в присутствии нефосфорилированного (активного) HePTP. Однако активация пути цАМФ стимулирует активацию PKA, которая, в свою очередь, фосфорилирует HePTP по Ser23. Это предотвращает связывание HePTP с Erk и освобождает путь MAPK от ингибирования, позволяя продолжать передачу сигналов ниже по течению (см. Рисунок 4).

Более того, исследования с участием гладкомышечных клеток из предсердия сердца показали, что PKA может снижать активацию киназ MAP в ответ на тромбоцитарный фактор роста (PDGF ) путем фосфорилирования киназы c-Raf.[14] Таким образом, кажется правдоподобным, что PKA в пути цАМФ может даже дополнительно участвовать в регуляции активации лимфоцитов не только путем ингибирования сигнального пути антиген-рецептор MAPK на его конечной стадии, но даже дальше по течению.
Примечания и ссылки
- ^ а б Saxena, M. (1999), «Перекрестные помехи между цАМФ-зависимой киназой и MAP-киназой через протеинтирозинфосфатазу», Nat. Cell Biol., 1 (5): 305–311, Дои:10.1038/13024, PMID 10559944
- ^ Скотт, Дж. Д. (1991), «Циклические нуклеотид-зависимые протеинкиназы», Pharmacol. Ther., 50 (1): 123–145, Дои:10.1016 / 0163-7258 (91) 90075-В, PMID 1653962
- ^ Krupinski J .; и другие. (1989), «Аминокислотная последовательность аденилатциклазы: возможная структура, подобная каналу или переносчику», Наука, 244 (4912): 1558–1564, Дои:10.1126 / science.2472670, PMID 2472670
- ^ а б c Вино, Джеффри. (1999–2008), «Через мембрану; внутриклеточные мессенджеры: цАМФ и цГМФ», Стэнфордский университет, PSYCH121.
- ^ а б c d Кац; и другие. (2000), «Физическое состояние внеклеточного матрикса регулирует структуру и молекулярный состав адгезий клетка-матрикс», Мол. Биол. Клетка, 11 (3): 1047–1060, Дои:10.1091 / mbc.11.3.1047, ЧВК 14830, PMID 10712519
- ^ а б c d Филип Дж. Сторк и Джон М. Шмитт. (2002), «Перекрестные помехи между передачей сигналов киназы цАМФ и МАР в регуляции пролиферации клеток», Тенденции в клеточной биологии, 12 (6): 258–266, Дои:10.1016 / S0962-8924 (02) 02294-8, PMID 12074885
- ^ а б c d е Гейгер, Б .; и другие. (2001), «Физическое состояние внеклеточного матрикса регулирует структуру и молекулярный состав клеточно-матричных адгезий», Обзоры природы Молекулярная клеточная биология, 2 (11): 793–805, Дои:10.1038/35099066, PMID 11715046
- ^ Ледбеттер; и другие. (1986), «Связывание антител с поверхностными молекулами CD5 (Tp67) и Tp44 Т-клеток: влияние на циклические нуклеотиды, цитоплазматический свободный кальций и опосредованное цАМФ подавление», Журнал иммунологии, 137: 3299–3305
- ^ Леви; и другие. (1996), «Циклическая AMP-зависимая протеинкиназа (cAK) в B-клетках человека: совместная локализация cAK типа I (RIα2C2) с рецептором антигена во время активации B-клеток, индуцированной антииммуноглобулином», Евро. J. Immunol., 26 (6): 1290–1296, Дои:10.1002 / eji.1830260617, PMID 8647207
- ^ Уислер; и другие. (1991), «Циклическая AMP-модуляция пролиферативных ответов В-клеток человека: роль цАМФ-зависимых протеинкиназ в усилении В-клеточных ответов на форболдиэфиры и иономицин», Клетка. Иммунол., 142 (2): 398–415, Дои:10.1016 / 0008-8749 (92) 90300-э
- ^ а б c Saxena, M .; и другие. (1999), «Ингибирование передачи сигналов Т-лимфоцитами с помощью гематопоэтической тирозинфосфатазы (HePTP), нацеленной на MAP-киназу», J. Biol. Chem., 274 (17): 11693–700, Дои:10.1074 / jbc.274.17.11693, PMID 10206983
- ^ Pulido, R. (1998), "PTP-SL и STEP протеинтирозинфосфатазы регулируют активацию регулируемых внеклеточными сигналами киназ ERK1 и ERK2 путем ассоциации через мотив взаимодействия с киназой", EMBO J., 17 (24): 7337–7350, Дои:10.1093 / emboj / 17.24.7337, ЧВК 1171079, PMID 9857190
- ^ Кобб; и другие. (1994), "Регулирование каскада киназ MAP", Клетка. Мол. Биол. Res., 40 (3): 253–256, PMID 7874203
- ^ Могилы; и другие. (1993), «Протеинкиназа А противодействует передаче сигналов, индуцированной фактором роста тромбоцитов, вызванной митоген-активируемой протеинкиназой в клетках гладких мышц артерий человека», Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ., 90 (21): 10300–10304, Дои:10.1073 / пнас.90.21.10300, ЧВК 47762, PMID 7694289
