Цианур хлорид - Cyanuric chloride
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,4,6-трихлор-1,3,5-триазин | |
| Другие имена Трихлортриазин s-Triazine трихлорид Цианурилхлорид TCT | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 124246 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.003.287 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 2670 |
| |
| |
| Характеристики | |
| C3Cl3N3 | |
| Молярная масса | 184.40 г · моль−1 |
| Внешность | белый порошок |
| Запах | острый |
| Плотность | 1,32 г / см3 |
| Температура плавления | 144–148 ° С (291–298 ° F, 417–421 К) |
| Точка кипения | 192 ° С (378 ° F, 465 К) |
| гидролизует | |
| Растворимость в органических растворителях | растворимый |
| Структура | |
| моноклинический | |
| Опасности | |
| Паспорт безопасности | ICSC 1231 |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| H302, H314, H317, H330 | |
| P260, P261, P264, P270, P271, P272, P280, P284, P301 + 312, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P320, P321, P330, P333 + 313, P363, P403 + 233, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 485 мг / кг (крыса, перорально) |
| Родственные соединения | |
Связанный триазины | Циануровая кислота Циануровый фторид Циануров бромид Трихлоризоциануровой кислоты |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Цианур хлорид является органическое соединение с формула (NCCl)3. Это белое твердое вещество - хлорированный производная от 1,3,5-триазин. Это тример из цианоген хлорид.[1] Цианурхлорид является основным предшественником популярного, но вызывающего споры гербицида. атразин.
Производство
Цианурхлорид получают в два этапа из цианистый водород через посредство цианоген хлорид, который тримеризуется при повышенных температурах над углеродным катализатором:
- HCN + Cl2 → ClCN + HCl

В 2005 году было произведено около 200 000 тонн.[2]
Промышленное использование
Подсчитано, что 70% циануровхлорида используется для приготовления пестицидов класса триазина, особенно атразин. Такие реакции основаны на легком замещении хлорида нуклеофилы такие как амины:
- (ClCN)3 + 2 РНХ2 → (RNHCN) (ClCN)2 + RNH3+Cl−
Другие триазиновые гербициды, такие как симазин, анилазин и циромазин сделаны аналогично.[3]
Цианурхлорид также используется в качестве предшественника красителей и сшивающих агентов. Самый большой класс этих красителей - это сульфированные триазин-стильбеновые оптические отбеливатели (OBA) или флуоресцентные отбеливающие агенты (FWA), обычно встречающиеся в формулах моющих средств и белой бумаге.[2] Много реактивные красители также включают триазиновое кольцо. Их также производят с помощью реакции замещения хлорида, показанной выше.[3][4]
Органический синтез
В одном специализированном применении хлорид циануровой кислоты используется в качестве реагент в органический синтез для превращения спиртов и карбоновых кислот в алкил- и ацилхлориды соответственно:[5]
Он также используется как дегидратирующий агент и для активации карбоновых кислот для восстановления до спиртов. Отопление с DMF дает "Реагент Золота" Мне2NCH = NCH = NMe2+Cl−, который является универсальным источником аминоалкилирования и предшественником гетероциклов.[6][7]
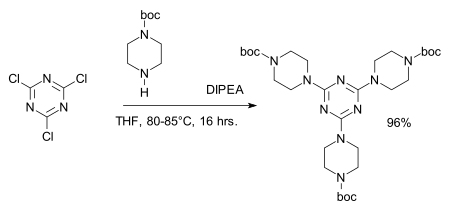
Хлоридные центры легко заменяются на амины давать меламин производные, например при синтезе дендримеры:[8][9]
Также используется синтез экспериментального аденозиновый рецептор лиганд .:[10]
Цианурхлорид также можно использовать в качестве альтернативы оксалилхлорид в Окисление Сверна.[11]
Смотрите также
- Тример тиазилхлорида - структурный аналог с атомами серы вместо углерода
Рекомендации
- ^ Цианур хлорид в Chemicalland21.com
- ^ а б Клаус Хутмахер, Дитер Мост «Циануровая кислота и циануровхлорид» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a08_191.
- ^ а б Словарь промышленных химикатов Эшфорда, 3-е издание, 2011 г., стр. 2495-8
- ^ Таппе, Хорст; Хелмлинг, Уолтер; Мишке, Питер; Ребсамен, Карл; Рейхер, Уве; Расс, Вернер; Шлефер, Людвиг; Вермерен, Петра (2000). Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a22_651. ISBN 978-3527306732.
- ^ К. Венкатараман и Д. Р. Вэгл (1979). «Цианурхлорид: полезный реагент для превращения карбоновых кислот в хлориды, сложные эфиры, амиды и пептиды». Tetrahedron Lett. 20 (32): 3037–3040. Дои:10.1016 / S0040-4039 (00) 71006-9.
- ^ Probst, D. A .; Hanson, P.R .; Барда, Д. А. «Цианур хлорид» в Энциклопедии реагентов для органического синтеза, 2004, John Wiley & Sons. Дои:10.1002 / 047084289X.rn00320
- ^ Джон Т. Гаптон; Стивен А. Эндрюс (1990). «β-Диметиламинометиленирование: N,N-Диметил-N'-p-толилформамидин ". Органический синтез.; Коллективный объем, 7, п. 197
- ^ Абделлатиф Чуай и Эрик Э. Симанек (2008). «Синтез в масштабе килограмма дендримера второго поколения на основе 1,3,5-триазина с использованием экологически чистых и промышленно совместимых методов с одной хроматографической стадией». J. Org. Chem. 73 (6): 2357–2366. Дои:10.1021 / jo702462t. PMID 18307354.
- ^ Реагент: DIPEA, амин защитная группа: BOC
- ^ Заявка WO 03101980, "1,3,5-ТРИАЗИНОВЫЕ ПРОИЗВОДНЫЕ КАК ЛИГАНДЫ ДЛЯ РЕЦЕПТОРОВ АДЕНОЗИНА-А3 ЧЕЛОВЕКА", опубликовано 11 декабря 2003 г. (Реагент номер два: норэфедрин, основание DIPEA )
- ^ De Luca, L .; Giacomelli, G .; Прочедду, А (2001). «Мягкая и эффективная альтернатива классическому окислению Сверна». J. Org. Chem. 66 (23): 7907. Дои:10.1021 / jo015935s.