Кротоновая кислота - Crotonic acid
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC (2E) -Бут-2-еновая кислота | |
| Другие имена (E) -Бут-2-еновая кислота (E) -2-бутеновая кислота Кротоновая кислота транс-2-бутеновая кислота β-Метилакриловая кислота 3-метилакриловая кислота | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.003.213 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C4ЧАС6О2 | |
| Молярная масса | 86.090 г · моль−1 |
| Плотность | 1,02 г / см3 |
| Температура плавления | От 70 до 73 ° C (от 158 до 163 ° F, от 343 до 346 K) |
| Точка кипения | От 185 до 189 ° C (от 365 до 372 ° F, от 458 до 462 K) |
| Кислотность (пKа) | 4.69 [1] |
| Опасности | |
| Паспорт безопасности | SIRI.org |
| Родственные соединения | |
Другой анионы | кротонат |
Связанный карбоновые кислоты | пропионовая кислота акриловая кислота Масляная кислота Янтарная кислота яблочная кислота Винная кислота фумаровая кислота пентановая кислота тетроловая кислота |
Родственные соединения | бутанол масляный альдегид кротоновый альдегид 2-бутанон |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Кротоновая кислота ((2E) -бут-2-еновая кислота) короткоцепной ненасыщенный карбоновая кислота, описываемый формулой CH3CH = CHCO2H. Она называется кротоновой кислотой, потому что ошибочно считалась омыление продукт кротоновое масло.[2] Он кристаллизуется в виде бесцветных игл из горячей воды. В СНГ-изомер кротоновой кислоты называется изокротоновая кислота. Кротоновая кислота растворима в воде и многих органических растворителях. Его запах похож на Масляная кислота.
Производство
Кротоновую кислоту можно получить несколькими способами:
- к окисление из кротоновый альдегид:[3]:230
- к Конденсация Кневенагеля из ацетальдегид с малоновая кислота в пиридин:[3]:229
- или щелочным гидролизом аллилцианид после внутримолекулярной перестройки двойная связь:[4][5]
- Кроме того, он образуется во время дистилляция из 3-гидроксимасляная кислота:[6]
Характеристики
Кротоновая кислота кристаллизуется в моноклинная кристаллическая система в космическая группа P21 / a (пространственная группа 14, позиция 3) с параметры решетки а = 971 вечера, б = 690 вечера, c = 775 вечера и β = 104.0°. Элементарная ячейка содержит четыре формульные единицы.[7]
Реакции
Кротоновая кислота превращается в Масляная кислота к гидрирование или сокращением с цинк и серная кислота.[8]
При лечении хлор или же бром, кротоновая кислота превращается в 2,3-дигалогенмасляные кислоты:[8]
Кротоновая кислота добавляет бромистый водород с образованием 3-броммасляной кислоты.[8][9]
Реакция с щелочью перманганат калия решение дает 2,3-дигидроксимасляная кислота.[8]
При нагревании с уксусный ангидрид, кротоновая кислота превращается в ангидрид кислоты:[10]
Этерификация кротоновой кислоты с использованием серной кислоты в качестве катализатора обеспечивает соответствующий кротонат сложные эфиры:
Кротоновая кислота реагирует с хлорноватистая кислота до 2-хлор-3-гидроксимасляной кислоты. Это можно уменьшить с помощью амальгама натрия к Масляная кислота, может образовываться с серной кислотой 2-хлорбутеновая кислота, реагируют с хлороводородом до 2,3-дихлорбутеновой кислоты или с этоксид калия до 3-метилоксиран-2-карбоновой кислоты.[11]
Кротоновая кислота реагирует с аммиаком в альфа-положении в присутствии ацетат ртути (II). Эта реакция обеспечивает DL-реонин.[12]
Использовать
Кротоновая кислота в основном используется в качестве сомономера с винилацетатом.[13] Полученные сополимеры используются в красках и клеи.[14]
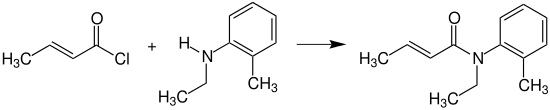
Кротонилхлорид реагирует с N-этил-2-метиланилин (N-этил-о-толуидин) для обеспечения кротамитон, который используется как средство против чесотка.[15]
Безопасность
Его LD50 составляет 1 г / кг (перорально, крысы).[14] Он раздражает глаза, кожу и дыхательную систему.[13]
Смотрите также
Рекомендации
- ^ Доусон, Р. М. С .; и другие. (1959). Данные для биохимических исследований. Оксфорд: Clarendon Press.
- ^ Чисхолм, Хью, изд. (1911). . Британская энциклопедия. 7 (11-е изд.). Издательство Кембриджского университета. п. 511.
- ^ а б Бейер, Ганс; Вальтер, Вольфганг (1984). Organische Chemie (на немецком). Штутгарт: S. Hirzel Verlag. ISBN 3-7776-0406-2.
- ^ Rinne, A .; Толленс, Б. (1871). "Ueber das Allylcyanür oder Crotonitril" [Об аллилцианиде или кротононитриле]. Юстус Либигс Аннален дер Хеми. 159 (1): 105–109. Дои:10.1002 / jlac.18711590110.
- ^ Померанц, К. (1906). "Убер аллилцианид и аллилсенфёль" [Об аллилцианиде и аллиловом горчичном масле]. Юстус Либигс Аннален дер Хеми. 351 (1–3): 354–362. Дои:10.1002 / jlac.19073510127.
- ^ Байльштейн, Ф. (1893). Handbuch der Organischen Chemie (на немецком). 1 (3-е изд.). Verlag Leopold Voss. п. 506.
- ^ Shimizu, S .; Кекка, С .; Кашино, С .; Хайса, М. (1974). «Топохимические исследования. III. Кристаллическая и молекулярная структура кротоновой кислоты, CH3CH = CHCO2H и кротонамид, CH3CH = CHCONH2". Бюллетень химического общества Японии. 47 (7): 1627–1631. Дои:10.1246 / bcsj.47.1627.
- ^ а б c d Хейльброн (1953). «Кротоновая кислота». Словарь органических соединений. 1: 615.
- ^ Lovén, J.M .; Йоханссон, Х. (1915). "Einige schwefelhaltige β-Замены производное от Buttersäure" [Некоторые серосодержащие β-замещающие производные масляной кислоты]. Berichte der deutschen chemischen Gesellschaft. 48 (2): 1254–1262. Дои:10.1002 / cber.19150480205.
- ^ Clover, A. M .; Ричмонд, Г. Ф. (1903). «Гидролиз органических пероксидов и надкислот». Американский химический журнал. 29 (3): 179–203.
- ^ Байльштейн, Ф. (1893). Handbuch der Organischen Chemie (на немецком). 1 (3-е изд.). Verlag Leopold Voss. п. 562.
- ^ Carter, H.E .; Уэст, Х. Д. (1955). "дл-Треонин ». Органический синтез.; Коллективный объем, 3, п. 813
- ^ а б Вход на Butensäuren. в: Römpp Online. Георг Тиме Верлаг, получено 7 января 2020 г.
- ^ а б Schulz, R.P .; Blumenstein, J .; Кольпайнтнер, К. (2005). «Кротоновый альдегид и кротоновая кислота». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a08_083.
- ^ Kleemann, A .; Энгель, Дж. Pharmazeutische Wirkstoffe: Synthesen, Patente, Anwendungen. 5 (2-е изд. И обновл. Ред.). Штутгарт и Нью-Йорк: Георг Тим Верлаг. п. 251. ISBN 3-13-558402-X.