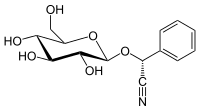
Прунасин - Prunasin
 | |
| Имена | |
|---|---|
| Название ИЮПАК (2р) -2-Фенил-2 - [(2р,3р,4S,5S,6р) -3,4,5-тригидрокси-6- (гидроксиметил) оксан-2-ил] оксиацетонитрил | |
| Другие имена (р) -Прунасин D-Прунасин D-Манделонитрил-β-D-глюкозид Прулауразин Лауроцеразин, Самбунигрин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.489 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C14ЧАС17NО6 | |
| Молярная масса | 295.291 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
(р) -прунасин это цианогенный гликозид относится к амигдалин. Химически это глюкозид из (р)-манделонитрил.
Природные явления
Prunasin встречается у видов рода Prunus Такие как Prunus japonica или же P. maximowiczii И в горький миндаль.[1] Он также содержится в листьях и стеблях Olinia ventosa, O. radiata, О. emarginata и О. рочетиана[2] И в Acacia greggii. Это биосинтетический предшественник и промежуточный продукт в биосинтезе амигдалин, то химическое соединение отвечает за вкус горький миндаль.
Он также встречается в одуванчик кофе Заменитель кофе.
Самбунигрин
Самбунигрин, а диастереомер пруназина, полученного из (S) -манделонитрил вместо него (р) -изомер, выделен из листьев бузины (Sambucus nigra ).[3] Самбунигрин присутствует в листьях и стеблях бузины в соотношении 1: 3 самбунигрина к пруназину и 2: 5 в незрелых семенах.[4] В корне не встречается.[4]
Биосинтез
Обзор
(р) -прунасин начинается с общей аминокислоты фенилаланин, который на заводах производится через Путь Шикимата в первичный метаболизм. Этот путь катализируется в основном двумя цитохром P450 (CYP) ферменты и UDP-глюкозилтрансфераза (UGT ). После (р) -прунасин, он либо превращается в амигдалин дополнительной UDP-глюкозилтрансферазой или распадается на бензальдегид и цианистый водород.
Исследователи показали, что накопление (или отсутствие) пруназина и амигдалина в ядре миндаля является причиной сладких и горьких генотипов.[1] Поскольку амигдалин отвечает за горький миндальный вкус, производители миндаля выбрали генотипы которые минимизируют биосинтез амидгалина. Ферменты CYP, ответственные за образование пруназина, сохраняются во Prunus разновидность.[5] Существует корреляция между высокой концентрацией чернослива в вегетативных областях растения и сладостью миндаля, что имеет отношение к миндаль сельскохозяйственная промышленность. В миндале биосинтетический амигдалин гены находятся выразил на разных уровнях тегумента (материнская ткань или внешний отдел) и семядоли (ядро или отцовская ткань) и значительно различаются во время миндального онтогенез.[1][6][7] Биосинтез пруназина происходит в тегументе, затем переносится в другие ткани для преобразования в амигдалин или разложения.[1][5]
Биосинтез (р) -прунасин

Биосинтез (р) -прунасин в Prunus dulcis
L-фенилаланин сначала гидроксилируется CYP79D16 с последующим декарбоксилированием и дегидратацией с образованием E-оксим фенилацетальдоксим.[8] Затем CYP71AN24 катализирует перестройку E-оксим в Z-оксим с последующими дегидратацией и гидроксилированием с образованием нитрила миндальонитрила.[8] Наконец, UGT85A19 или UGT94AF3 используют UDP-глюкозу для гликозилирования манделонитрила, образуя (р) -прунасин.[1]
После создания (р) -прунасин, продукт дальше гликозилированный в амидгалин либо изоформа UGT94AF1 или UGT94AF2.[1] Экспрессия UGTAF1 / 2 и пруназина гидролазы приводит к низкой общей концентрации (р) -прунасин в тканях миндаля. Важно отметить, что альфа-глюкозидаза или пруназин гидролаза может преобразовывать (р) -пруназин до его предшественника манделонитрила, который затем может быть спонтанно или ферментативно гидролизован до бензальдегида и цианистого водорода.[9]
Биосинтез (р) -прунасин в Кладокаликс эвкалипта
Биосинтез (р) -прунасин в E. кладокаликс, то сахарная камедь, было показано синтезировать (р) -прунасин с использованием дополнительного промежуточного продукта, фенилацетонитрил, используя CYP706C55.[10] Путь проходит аналогично пути в Prunus видов, где многофункциональный CYP79A125 катализирует превращение L-фенилаланина в фенилацетальдоксим. Затем CYP706C55 катализирует обезвоживание фенилацетальдоксима в фенилацетонитрил. Затем фенилацетонитрил гидроксилируется CYP71B103 до манделонитрил. После образования миндонитрила UGT85A59 переводит глюкозу в выход (р) -прунасин.[10]
Взаимодействия метаболических путей
В качестве (р) -прунасин является продуктом вторичного метаболизма, его образование и деградация влияют на несколько метаболических путей за счет потребления L-фенилаланина или увеличения количества бензальдегида и токсичного цианистого водорода за счет разложения пруназина.
Метаболический профиль миндаля, маниоки и сорго выявил потенциальный механизм утилизации, когда (р) -прунасин и другие цианогликозиды могут использоваться для хранения азота и рециркуляции азота без образования HCN.[11] В 2017 году исследователи использовали маркировку стабильных изотопов, чтобы продемонстрировать, что 13C-меченый L-фенилаланин, включенный в (р) -прунасин может быть превращен в бензальдегид и в салициловую кислоту с использованием нитрила миндалина в качестве промежуточного соединения.[12]
Токсичность
Токсичность пруназина основана на продуктах его распада: (р) -прунасин гидролизованный формировать бензальдегид и цианистый водород, вызывающий токсичность. Следовательно, растения, содержащие прунасин, могут быть токсичными для животных, особенно жвачные животные.[13]
Чтобы разложить амигдалин до пруназина, амигдалин бета-глюкозидаза гидролизует дисахарид с образованием (р) -прунасин и D-глюкоза. Потом, прунасин бета-глюкозидаза использует (р) -прунасин и вода для производства D-глюкоза и манделонитрил. После создания агликон манделонитрил, затем манделонитриллиаза может разлагать соединение на бензальдегид и цианистый водород.
Рекомендации
- ^ а б c d е ж Санчес-Перес, Ракель; Бельмонте, Фара Саес; Борх, Йонас; Дисента, Федерико; Мёллер, Биргер Линдберг; Йоргенсен, Кирстен (апрель 2012 г.). «Гидролазы пруназина во время развития плодов сладкого и горького миндаля». Физиология растений. 158 (4): 1916–1932. Дои:10.1104 / стр.111.192021. ISSN 0032-0889. ЧВК 3320195. PMID 22353576.
- ^ Нарстедт, Адольф; Рокенбах, Юрген (1993). «Встречаемость цианогенного глюкозида prunasin и II соответствующего амида глюкозида миндальной кислоты у видов Olinia (oliniaceae)». Фитохимия. 34 (2): 433. Дои:10.1016 / 0031-9422 (93) 80024-М.
- ^ Эндрю Пенгелли (2004), Составляющие лекарственных растений (2-е изд.), Allen & Unwin, стр. 44–45, ISBN 978-1-74114-052-1
- ^ а б Миллер, Ребекка Э .; Gleadow, Roslyn M .; Вудро, Ян Э. (2004). «Цианогенез тропического Prunus turneriana: характеристика, вариабельность и реакция на слабое освещение». Функциональная биология растений. 31 (5): 491. Дои:10.1071 / FP03218. ISSN 1445-4408.
- ^ а б Тодберг, Сара; Дель Куэто, Хорхе; Маццео, Роза; Паван, Стефано; Лотти, Кончетта; Дисента, Федерико; Jakobsen Neilson, Elizabeth H .; Мёллер, Биргер Линдберг; Санчес-Перес, Ракель (ноябрь 2018 г.). «Выяснение пути амигдалина раскрывает метаболическую основу горького и сладкого миндаля (Prunus dulcis) 1 [ОТКРЫТО]». Физиология растений. 178 (3): 1096–1111. Дои:10.1104 / стр. 18.00922. ISSN 0032-0889. ЧВК 6236625. PMID 30297455.
- ^ Санчес-Перес, Ракель; Йоргенсен, Кирстен; Олсен, Карл Эрик; Дисента, Федерико; Мёллер, Биргер Линдберг (март 2008 г.). «Горечь в миндале». Физиология растений. 146 (3): 1040–1052. Дои:10.1104 / pp.107.112979. ISSN 0032-0889. ЧВК 2259050. PMID 18192442.
- ^ Нейлсон, Элизабет Х .; Гуджер, Джейсон К.Д .; Мотавиа, Мохаммед Саддик; Бьярнхольт, Нанна; Фриш, Тина; Олсен, Карл Эрик; Мёллер, Биргер Линдберг; Вудро, Ян Э. (декабрь 2011 г.). «Цианогенные диглюкозиды, производные фенилаланина из камфорного эвкалипта, и их количество в зависимости от онтогенеза и типа ткани». Фитохимия. 72 (18): 2325–2334. Дои:10.1016 / j.phytochem.2011.08.022.
- ^ а б Ямагути, Такуя; Ямамото, Кадзунори; Асано, Ясухиса (сентябрь 2014 г.). «Идентификация и характеристика CYP79D16 и CYP71AN24, катализирующих первый и второй этапы биосинтеза цианогенных гликозидов на основе l-фенилаланина в японском абрикосе Prunus mume Sieb. Et Zucc». Молекулярная биология растений. 86 (1–2): 215–223. Дои:10.1007 / s11103-014-0225-6. ISSN 0167-4412.
- ^ Чжоу, Джиминг; Хартманн, Стефани; Shepherd, Brianne K .; Поултон, Джонатан Э. (01.07.2002). «Исследование микрогетерогенности и относящейся к агликону специфичности остатков прунасин гидролаз черной вишни». Физиология растений. 129 (3): 1252–1264. Дои:10.1104 / стр.010863. ISSN 0032-0889. ЧВК 166519. PMID 12114579.
- ^ а б Хансен, Сесили Сетти; Соренсен, Метте; Veiga, Thiago A.M .; Zibrandtsen, Juliane F.S .; Heskes, Allison M .; Олсен, Карл Эрик; Boughton, Berin A .; Мёллер, Биргер Линдберг; Нилсон, Элизабет Х. Дж. (Ноябрь 2018 г.). «Реконфигурированный биосинтез цианогенных глюкозидов в кладокаликсе эвкалипта с участием цитохрома P450 CYP706C55». Физиология растений. 178 (3): 1081–1095. Дои:10.1104 / стр. 18.00998. ISSN 0032-0889. ЧВК 6236593. PMID 30297456.
- ^ Пичманова, Мартина; Нейлсон, Элизабет Х .; Motawia, Mohammed S .; Олсен, Карл Эрик; Агербирк, Нильс; Грей, Кристофер Дж .; Флитч, Сабина; Мейер, Себастьян; Сильвестро, Даниэле; Йоргенсен, Кирстен; Санчес-Перес, Ракель (01.08.2015). «Путь рециркуляции цианогенных гликозидов, подтвержденный сравнительным метаболическим профилем трех видов цианогенных растений». Биохимический журнал. 469 (3): 375–389. Дои:10.1042 / BJ20150390. ISSN 0264-6021.
- ^ Диас-Виванкос, Педро; Берналь-Висенте, Агустина; Кантабелла, Даниэль; Петри, Сезар; Эрниндес, Хосин Антонио (2017-12-01). «Метаболомика и биохимические подходы связывают биосинтез салициловой кислоты с цианогенезом у растений персика». Физиология растений и клеток. 58 (12): 2057–2066. Дои:10.1093 / pcp / pcx135. ISSN 0032-0781.
- ^ Питер Р. Чик (1989). Токсиканты растительного происхождения: гликозиды. 2. CRC Press. п. 137.
