Органокатализ - Organocatalysis

В органическая химия, период, термин органокатализ (а чемодан терминов «органический» и «катализатор») относится к форме катализ, при этом скорость химическая реакция увеличивается на органический катализатор называемый «органокатализатор», состоящий из углерод, водород, сера и другие неметаллические элементы, содержащиеся в органических соединениях.[3][4][5][6][7][8] Из-за схожести состава и описания их часто принимают за неправильное употребление за ферменты из-за их сопоставимого воздействия на скорость реакции и формы вовлеченного катализа.
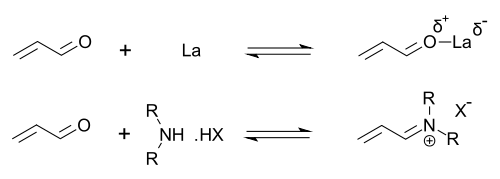
Органокатализаторы, показывающие вторичные амин функциональность может быть описана как выполнение либо енамин катализ (путем образования каталитических количеств активного енамина нуклеофил ) или же иминий катализ (путем образования каталитических количеств активированного иминиевого электрофила). Этот механизм типичен для ковалентного органокатализа. Ковалентное связывание субстрата обычно требует высокой загрузки катализатора (для пролинового катализа обычно 20-30 мол.%). Нековалентные взаимодействия, такие как водородная связь, облегчают низкие загрузки катализатора (до 0,001 мол.%).
Органокатализ дает несколько преимуществ. Нет необходимости в катализе на основе металлов, что вносит вклад в зеленая химия. В этом контексте простые органические кислоты использовались в качестве катализатора для модификации целлюлозы в воде в многотонном масштабе.[9] Когда органокатализатор хиральный проспект открыт для асимметричный катализ, например, использование пролин в альдольные реакции является примером хиральности и зеленой химии.[10]
Вступление
Обычные ахиральные органокатализаторы основаны на азоте, таком как пиперидин используется в Конденсация Кневенагеля.[11] DMAP используется в эстерификации[12] и DABCO используется в Реакция Бейлиса-Хиллмана.[13] Соли тиазолия работают в Реакция Стеттера. Эти катализаторы и реакции имеют долгую историю, но текущий интерес к органокатализу сосредоточен на асимметричный катализ с хиральными катализаторами, называемыми асимметричный органокатализ или же энантиоселективный органокатализ. Новаторская реакция, разработанная в 1970-х годах, называется Реакция Хайоса – Пэрриша – Эдера – Зауэра – Вихерта.. Между 1968 и 1997 годами было лишь несколько сообщений об использовании малых органических молекул в качестве катализаторов асимметричных реакций (реакция Хайоса – Пэрриша, вероятно, самая известная), но эти химические исследования рассматривались скорее как уникальные химические реакции, чем как интегральные. части более крупного взаимосвязанного поля.[14]
В этой реакции встречающийся в природе хиральный пролин является хиральным катализатором в Альдольная реакция. Исходный материал - ахиральный трикетон и требуется всего 3% пролина для получения продукта реакции, кетола в 93% энантиомерный избыток. Это первый пример асимметричной альдольной реакции, катализируемой аминокислотами.[15][16]
Асимметричный синтез Кетон Виланда-Мишера (1985) также основан на пролине, и еще одно раннее применение было одним из преобразований в полный синтез из Эритромицин к Роберт Б. Вудворд (1981).[17] Краткий обзор статьи посвящен избранным недавним примерам полного синтеза природных и фармацевтических продуктов с использованием органокаталитических реакций.[18]
Многие хиральные органокатализаторы являются адаптацией хиральные лиганды (которые вместе с металлическим центром также катализируют асимметричные реакции), и обе концепции в некоторой степени совпадают.
Классы органокатализаторов
Органокатализаторы асимметричного синтеза можно разделить на несколько классов:
- Биомолекулы: пролин, фенилаланин. Вторичные амины в целом.[19] В хинные алкалоиды, определенный олигопептиды.
- Синтетические катализаторы на основе биомолекул.
- Катализаторы водородного связывания, включая ТАДДОЛЫ, производные от БИНОЛ Такие как НОБИН, и органокатализаторы на основе тиомочевины
- Соли триазолия как новое поколение Реакция Стеттера катализаторы
Примеры асимметричных реакций с участием органокатализаторов:
- Асимметричные реакции Дильса-Альдера
- Асимметричные реакции Майкла
- Асимметричные реакции Манниха
- Эпоксидирование Ши
- Органокаталитический перенос гидрирования
Пролин
Был рассмотрен пролиновый катализ.[20][21]
Имидазолидиноновый органокатализ
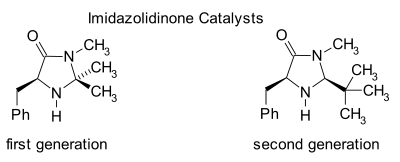
Имидазолидиноны являются катализаторами многих превращений, таких как асимметричные реакции Дильса-Альдера и Майкл дополнения. Хиральные катализаторы индуцируютасимметричные реакции, часто с высокой энантиоселективностью. Этот катализатор работает, образуя иминиевый ион с карбонил группы α, β-ненасыщенных альдегидов (Enals ) и Enones в быстром химическое равновесие. Этот активация иминия аналогична активации карбонильных групп Кислота Льюиса и оба катализатора снижают LUMO:[22][23]
Промежуточный иминиевый промежуточный продукт является хиральным, который переносится в продукт реакции через хиральная индукция. Катализаторы использовались в Реакции Дильса-Альдера, Майкл дополнения, Алкилирование Фриделя-Крафтса, перенос гидрирования и эпоксидирование.
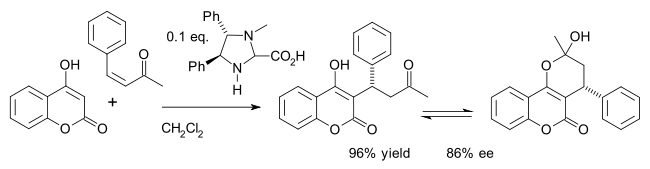
Одним из примеров является асимметричный синтез лекарства. варфарин (в равновесии с гемикетальный ) в Майкл дополнение из 4-гидроксикумарин и бензилиденацетон:[24]
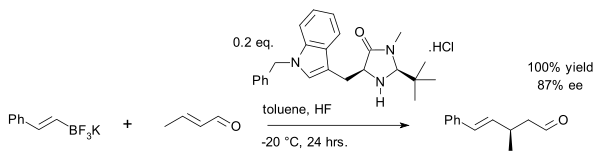
Недавний эксплойт - это винил алкилирование кротоновый альдегид с органотрифторборатная соль:[25]
Другие примеры его использования: см. органокаталитический перенос гидрирования и асимметричные реакции Дильса-Альдера.
Органокатализ тиомочевины
Большая группа органокатализаторов включает мочевина или тиомочевина часть. Эти каталитически эффективные производные (тио) мочевины, называемые органокатализаторами (тио) мочевины, обеспечивают явную двойную водородная связь взаимодействия для координации и активации субстратов, принимающих водородные связи.[26]
Рекомендации
- ^ Юстус фон Либих, Юстус (1860). "Ueber die Bildung des Oxamids aus Cyan". Annalen der Chemie und Pharmacie. 113 (2): 246–247. Дои:10.1002 / jlac.18601130213.
- ^ В. Лангенбек (1929). "Über Organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden". Либигс Энн. 469: 16–25. Дои:10.1002 / jlac.19294690103.
- ^ Беркессель А., Грегер Х. (2005). Асимметричный органокатализ. Вайнхайм: Wiley-VCH. ISBN 978-3-527-30517-9.CS1 maint: несколько имен: список авторов (связь)
- ^ Специальный выпуск: Список, Бенджамин (2007). «Органокатализ». Chem. Rev. 107 (12): 5413–5883. Дои:10.1021 / cr078412e.
- ^ Петр I. Далко; Лайонел Мойсан (2004). «В золотой век органокатализа». Энгью. Chem. Int. Эд. 43 (39): 5138–5175. Дои:10.1002 / anie.200400650. PMID 15455437.
- ^ Мэтью Дж. Гонт; Карин К. Йоханссон; Энди МакНелли; Нгок Т. Во (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня. 12 (1/2): 8–27. Дои:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ Дитер Эндерс; Кристоф Грондал; Маттиас Р. М. Хюттль (2007). «Асимметричные органокаталитические домино реакции». Энгью. Chem. Int. Эд. 46 (10): 1570–1581. Дои:10.1002 / anie.200603129. PMID 17225236.
- ^ Петр I. Далко; Лайонел Мойсан (2001). «Энантиоселективный органокатализ». Энгью. Chem. Int. Эд. 40 (20): 3726–3748. Дои:10.1002 / 1521-3773 (20011015) 40:20 <3726 :: AID-ANIE3726> 3.0.CO; 2-D.
- ^ Международный патент WO 2006068611 A1 20060629 «Прямая гомогенная и гетерогенная модификация аминов и спиртов, катализируемая органическими кислотами и аминокислотами». Изобретатели: Армандо Кордова, Стокгольм, Швеция; Йонас Хафрен, Стокгольм, Швеция.
- ^ Пример 4 в патенте США № 3975440 от 17 августа 1976 г., поданном 9 декабря 1970 г. Золтану Г. Хаджосу и Дэвиду Р. Пэрришу.
- ^ Лист Б. (2010). «Эмиль Кневенагель и корни аминокатализа». Angewandte Chemie International Edition на английском языке. 49 (10): 1730–1734. Дои:10.1002 / anie.200906900. PMID 20175175.
- ^ Нейзес, Бернхард; Стеглих, Вольфганг (июль 1978). «Простой метод этерификации карбоновых кислот». Angewandte Chemie International Edition на английском языке. 17 (7): 522–524. Дои:10.1002 / anie.197805221.
- ^ Басаваиа, Деэви; Рао, Анумолу Джаганмохан; Сатьянараяна, Тумманапалли (март 2003 г.). "Последние достижения в реакции и приложениях Бейлиса-Хиллмана". Химические обзоры. 103 (3): 811–892. Дои:10.1021 / cr010043d. PMID 12630854.
- ^ «Появление и развитие органокатализа» Дэвид К. Макмиллан, ПРИРОДА Том 455 | 18 сентября 2008| DOI: 10.1038 / nature07367
- ^ Z. G. Hajos, D. R. Parrish, патент Германии DE 2102623 1971
- ^ Золтан Г. Хаджос; Дэвид Р. Пэрриш (1974). «Асимметричный синтез бициклических интермедиатов химии природных продуктов». J. Org. Chem. 39 (12): 1615–1621. Дои:10.1021 / jo00925a003.
- ^ Р. Б. Вудворд; Э. Логуш; К. П. Намбьяр; К. Сакан; Д. Э. Уорд; Б. В. Ау-Йунг; П. Баларам; Л. Дж. Браун; и другие. (1981). «Асимметричный общий синтез эритромцина. 1. Синтез эритронолидного производного секокислоты посредством асимметричной индукции». Варенье. Chem. Soc. 103 (11): 3210–3213. Дои:10.1021 / ja00401a049.
- ^ Б. -Ф. Солнце (2015). «Полный синтез натуральных и фармацевтических продуктов за счет органокаталитических реакций». Tetrahedron Lett. 56 (17): 2133–2140. Дои:10.1016 / j.tetlet.2015.03.046.
- ^ Бертельсен, Сорен (2009). «Органокатализ - после золотой лихорадки». Обзоры химического общества. 38 (8): 2178–89. Дои:10.1039 / b903816g. PMID 19623342.
- ^ Gaunt, M. J .; Johansson, C. C. C .; McNally, A .; Во, Н. Т. (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня. 12 (1–2): 8–27. Дои:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ Кучеренко, А. С .; Сиюткин, Д. Э .; Мальцев, О. В .; Кочетков, С. В .; Злотин, С. Г. (2013). «Асимметричный органокатализ: от пролина до высокоэффективных иммобилизованных органокатализаторов». Российский химический вестник. 61 (7): 1313. Дои:10.1007 / s11172-012-0177-4. S2CID 93168492.
- ^ Жеральд Леле; Дэвид В. К. Макмиллан (2006). "Современные стратегии в области органического катализа: появление и развитие активации иминия" (PDF). Aldrichimica Acta. 39 (3): 79.
- ^ Эрккиля, Анниина; Маджандер, Инкери; Пихко, Петри М. (2007). «Иминиум-катализ». Chem. Rev. 107 (12): 5416–5470. Дои:10.1021 / cr068388p. PMID 18072802.
- ^ Ниш Халланд; Торе Хансен; Карл Анкер Йоргенсен (2003). «Органокаталитическая асимметричная реакция Михаэля циклических 1,3-дикарбонильных соединений и α, β-ненасыщенных кетонов - высокоатомно-экономичное каталитическое одностадийное образование оптически активного антикоагулянта варфарина». Энгью. Chem. Int. Эд. 42 (40): 4955–4957. Дои:10.1002 / anie.200352136. PMID 14579449.
- ^ Сандра Ли; Дэвид В. К. Макмиллан (2007). "Органокаталитический винил и алкилирование по Фриделю-Крафтсу солями трифторбората" (PDF). Варенье. Chem. Soc. 129 (50): 15438–15439. Дои:10.1021 / ja0767480. PMID 18031044.
- ^ Мадарас, Адам; Доса, Жолт; Варга, Сцилард; Соос, Тибор; Csámpai, Antal; Папай, Имре (июль 2016 г.). "Производные тиомочевины как органокатализаторы кислоты Бренстеда" (PDF). Катализ ACS. 6 (7): 4379–4387. Дои:10.1021 / acscatal.6b00618.