Т-клетка памяти - Memory T cell
Т-клетки памяти являются подмножеством Т-лимфоциты которые могут иметь те же функции, что и В-клетки памяти. Их происхождение неясно.
Функция
Антиген -специфические Т-клетки памяти, специфичные для вирусов или других микробный молекулы можно найти как в TСМ и тЭМ подмножества. Хотя большая часть информации в настоящее время основана на наблюдениях в цитотоксические Т-клетки (CD8 -положительный), похожие популяции, по-видимому, существуют как для хелперные Т-клетки (CD4 -положительные) и цитотоксические Т-клетки. Основная функция клеток памяти - усиление иммунного ответа после реактивации этих клеток путем повторного введения в организм соответствующего патогена. Важно отметить, что эта область интенсивно изучается, и некоторая информация может быть пока недоступна.
- ТСМ : ТСМ лимфоциты имеют несколько общих свойств со стволовыми клетками, наиболее важным из которых является способность к самообновлению, в основном из-за высокого уровня фосфорилирования ключевого фактора транскрипции, STAT5. У мышей TСМ доказано, что дает более мощный иммунитет против вирусов,[1] бактерии[1] и раковые клетки,[2] по сравнению с TЭМ лимфоциты в нескольких экспериментальных моделях.
- ТЭМ : ТЭМ и тEMRA лимфоциты в основном активны как варианты CD8, таким образом, они в основном ответственны за цитотоксическое действие против патогенов.[3]
- ТRM : Потому что TRM лимфоциты длительное время присутствуют в тканях или, что более важно, в барьерных тканях (например, в эпителии), они имеют решающее значение для быстрой реакции на нарушение барьера и ответа на любой соответствующий присутствующий патоген. Один механизм, используемый TRM для ограничения болезнетворных микроорганизмов выделяется гранзим B.[4][5]
- ТСКМ : Эти лимфоциты способны к самообновлению, как и TСМ лимфоциты, а также способны генерировать как ТСМ и тЭМ субпопуляции.[6] Присутствие этой популяции у людей в настоящее время исследуется.
- ТВМ : На данный момент единственная функция, видимая в TВМ клетки - выработка различных цитокинов,[7][8] но есть предположения об их влиянии на подавление нежелательных иммунологических состояний и их использовании при лечении аутоиммунных заболеваний.[9]
Гомеостатическое обслуживание
Клоны Т-клеток памяти, экспрессирующие определенный Т-клеточный рецептор, могут сохраняться в нашем организме десятилетиями. Поскольку Т-клетки памяти имеют более короткий период полураспада, чем наивные Т-клетки, непрерывная репликация и замена старых клеток, вероятно, вовлечены в процесс поддержания.[3] В настоящее время механизм поддержания Т-клеток памяти до конца не изучен. Активация через рецептор Т-клеток может иметь значение.[3] Обнаружено, что Т-клетки памяти могут иногда реагировать на новые антигены, что может быть вызвано внутренним разнообразием и широтой мишеней связывания рецепторов Т-клеток.[3] Эти Т-клетки могут перекрестно реагировать на экологические или резидентные антигены в нашем организме (например, бактерии в нашем кишечнике) и размножаться. Эти события помогут поддерживать популяцию Т-клеток памяти.[3] Механизм перекрестной реактивности может быть важным для Т-клеток памяти в тканях слизистой оболочки, поскольку эти участки имеют более высокую плотность антигена.[3] Для тех, кто находится в крови, костном мозге, лимфоидных тканях и селезенке, гомеостатические цитокины (включая Ил-17 и Ил-15 ) или же главный комплекс гистосовместимости II (MHCII) передача сигналов может быть более важной.[3]
Обзор срока службы
Т-клетки памяти претерпевают разные изменения и играют разные роли на разных этапах жизни человека. При рождении и в раннем детстве Т-клетки периферической крови в основном являются наивными Т-лимфоцитами.[10] За счет частого воздействия антигена происходит накопление популяции Т-клеток памяти. Это этап генерации памяти, который длится от рождения до 20-25 лет, когда наша иммунная система сталкивается с наибольшим количеством новых антигенов.[3][10] На следующей стадии гомеостаза памяти количество Т-клеток памяти стабилизируется за счет поддержания гомеостаза.[10] На этом этапе иммунный ответ больше смещается в сторону поддержания гомеостаза, поскольку обнаруживается мало новых антигенов.[10] На этом этапе также становится важным наблюдение за опухолью.[10] На более поздних этапах жизни, примерно в возрасте 65-70 лет, иммунное старение Наступает стадия, на которой наблюдается стадия иммунной дисрегуляции, снижение функциональности Т-клеток и повышенная восприимчивость к патогенам.[3][10]
Споры о происхождении
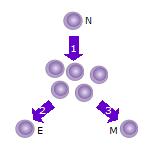
1. После наивная Т-клетка (N) встречает антиген это становится активирован и начинает размножаться (разделять ) во многие клоны или дочерние клетки.
2. Некоторые клоны Т-клеток будут дифференцироваться в эффекторные Т-клетки (E), который будет выполнять функцию этой клетки (например, производить цитокины в случае хелперные Т-клетки или вызвать уничтожение клеток в случае цитотоксические Т-клетки ).
3. Некоторые из клеток будут формировать Т-клетки памяти (M), которые будут выживать в неактивном состоянии в организме хозяина в течение длительного периода времени, пока они снова не встретятся с тем же антигеном и не активируются.
По состоянию на апрель 2020 года родственная связь между эффекторными Т-клетками и Т-клетками памяти неясна.[11][12][13] Существуют две конкурирующие модели. Одна называется моделью On-Off-On.[12] Когда наивные Т-клетки активируются Рецептор Т-клеток (TCR) связываясь с антигеном и его сигнальным путем, они активно пролиферируют и образуют большой клон эффекторных клеток. Эффекторные клетки подвергаются активному цитокин секреция и другие эффекторные действия.[11] После антиген После очистки некоторые из этих эффекторных клеток образуют Т-клетки памяти либо случайным образом, либо выбираются на основе их превосходной специфичности.[11] Эти клетки перейдут от активной эффекторной роли к состоянию, более сходному с наивными Т-клетками, и снова будут «включены» при следующем воздействии антигена.[13] Эта модель предсказывает, что эффекторные Т-клетки могут переходить в Т-клетки памяти и выживать, сохраняя способность к пролиферации.[11] Он также предсказывает, что определенный профиль экспрессии генов будет следовать паттерну включения-выключения во время наивной, эффекторной стадий и стадий памяти.[13] Доказательства, подтверждающие эту модель, включают обнаружение генов, связанных с выживанием и хоумингом, которые следуют паттерну экспрессии «включено-выключено», включая альфа-рецептор интерлейкина-7 (IL-7Rα), Bcl-2, CD26L и другие.[13]

В этой модели Т-клетки памяти генерируют эффекторные Т-клетки, а не наоборот.
Другая модель - это модель дифференциации развития.[12] Эта модель утверждает, что эффекторные клетки, продуцируемые высокоактивированными наивными Т-клетками, будут подвергаться апоптозу после клиренса антигена.[11] Вместо этого Т-клетки памяти продуцируются наивными Т-клетками, которые активируются, но никогда не входят в полную силу на эффекторную стадию.[11] Потомство Т-клеток памяти не активируется полностью, потому что они не так специфичны к антигену, как расширяющиеся эффекторные Т-клетки. Исследования, посвященные истории деления клеток, показали, что длина теломер и активность теломеразы были уменьшены в эффекторных Т-клетках по сравнению с Т-клетками памяти, что позволяет предположить, что Т-клетки памяти не претерпевают такого большого клеточного деления, как эффекторные Т-клетки, что несовместимо с модель On-Off-On.[11] Повторная или хроническая антигенная стимуляция Т-клеток, например ВИЧ-инфекция, может вызвать усиление эффекторных функций, но уменьшить память.[12] Было также обнаружено, что сильно пролиферирующие Т-клетки с большей вероятностью будут генерировать короткоживущие эффекторные клетки, тогда как минимально пролиферированные Т-клетки будут формировать более долгоживущие клетки.[11]
Эпигенетические модификации
Эпигенетический модификации участвуют в замене наивных Т-клеток.[14] Например, в CD4+ Т-клетки памяти, положительные модификации гистонов отмечают ключ цитокин гены, которые активируются во время вторичного иммунного ответа, в том числе IFNγ, IL4, и IL17A.[14] Некоторые из этих модификаций сохранялись после клиренса антигена, создавая эпигенетическую память, которая позволяет более быструю активацию при повторной встрече с антигеном.[14] За CD8+ Т-клетки памяти, некоторые эффекторные гены, такие как IFNγ, не будут экспрессироваться, но они транскрипционно готовы к быстрой экспрессии при активации.[14] Кроме того, усиление экспрессии определенных генов также зависит от силы исходной передачи сигналов TCR для потомства Т-клеток памяти, которая коррелирует с активацией регуляторного элемента, который напрямую изменяет уровень экспрессии гена.[14]
Субпопуляции
Исторически считалось, что Т-клетки памяти принадлежат либо к эффекторному, либо к подтипу центральной памяти, каждый со своим собственным отличительным набором маркеров клеточной поверхности (см. Ниже).[15] Впоследствии были обнаружены многочисленные дополнительные популяции Т-клеток памяти, включая резидентные в тканях Т-клетки памяти (ТRM) клетки стволовой памяти TСКМ клетки и Т-клетки виртуальной памяти. Единственная объединяющая тема для всех подтипов Т-клеток памяти заключается в том, что они являются долгоживущими и могут быстро увеличиваться до большого количества эффекторных Т-клеток при повторном воздействии на их родственный антиген. Посредством этого механизма они обеспечивают иммунную систему «памятью» против ранее встреченных патогенов. Т-клетки памяти могут быть либо CD4+ или же CD8+ и обычно выражают CD45RO и в то же время отсутствует CD45RA.[16]
Подтипы Т-клеток памяти
- Т-клетки центральной памяти (ТСМ клетки) экспрессируют CD45RO, C-C хемокиновый рецептор типа 7 (CCR7) и L-селектин (CD62L). Т-клетки центральной памяти также имеют среднюю или высокую экспрессию CD44. Эта подгруппа памяти обычно встречается в лимфатический узел и в периферическом кровообращении.
- Эффекторные Т-клетки памяти (ТЭМ клетки) экспрессируют CD45RO, но не экспрессируют CCR7 и L-селектин. Они также имеют среднюю и высокую степень выраженности CD44. Эти Т-клетки памяти лишены рецепторов, возвращающих к лимфатическим узлам, и поэтому они обнаруживаются в периферическом кровообращении и тканях.[17] ТEMRA означает терминально дифференцированные эффекторные клетки памяти, повторно экспрессирующие CD45RA, который является маркером, обычно обнаруживаемым на наивных Т-клетках.[18]
- Резидентные Т-клетки памяти в тканях (TRM) занимают ткани (кожу, легкие, желудочно-кишечный тракт и т. д.) без рециркуляции. Некоторые маркеры клеточной поверхности, которые были связаны с TRM CD69 и интегрин αeβ7 (CD103).[19] Однако стоит отметить, что TRM клетки, обнаруженные в разных тканях, экспрессируют разные наборы маркеров клеточной поверхности.[19] Хотя CD103 + TRM обнаружено, что клетки ограниченно локализованы в эпителиальных и нейрональных тканях, TRM клетки, локализованные в слюнных железах, поджелудочной железе и женских половых путях мышей, не экспрессируют ни CD69, ни CD103.[19][20] ТRM Считается, что клетки играют важную роль в защитном иммунитете против патогенов.[5][21] Исследования также предполагают двойную роль TRM клетки в защите и регулировании.[10] По сравнению с TЭМ ячеек, ТRM клетки секретируют более высокие уровни цитокинов, связанных с защитным иммунитетом, и экспрессируют более низкие уровни маркера пролиферации Ki67.[10] Было высказано предположение, что эти характеристики могут помочь в долгосрочном поддержании TRM клеток, а также поддержание баланса между быстрой реакцией на инвазию антигена и предотвращением ненужного повреждения тканей.[10] Дисфункциональный TRM клетки вовлечены в аутоиммунные заболевания, такие как псориаз, ревматоидный артрит, воспалительное заболевание кишечника.[21] Специфично для TRM лимфоциты - это гены, участвующие в липидный обмен, будучи очень активными, примерно в 20-30 раз более активными, чем другие типы Т-клеток.[21]
- Т-клетки виртуальной памяти (ТВМ) отличаются от других подмножеств памяти тем, что они не возникают после сильного события клональной экспансии. Таким образом, хотя эта популяция в целом многочисленна в периферическом кровообращении, отдельные клоны Т-клеток виртуальной памяти располагаются на относительно низких частотах. Одна из теорий состоит в том, что гомеостатическая пролиферация дает начало этой популяции Т-клеток. Хотя Т-клетки виртуальной памяти CD8 были описаны первыми,[22] теперь известно, что клетки виртуальной памяти CD4 также существуют.[23]
Было предложено множество других субпопуляций Т-клеток памяти. Следователи изучили Стволовая память ТСКМ клетки. Как наивные Т-клетки, ТСКМ клетки CD45RO-, CCR7 +, CD45RA +, CD62L + (L-селектин ), CD27 +, CD28 + и IL-7Rα +, но они также экспрессируют большие количества CD95, IL-2Rβ, CXCR3 и LFA-1 и демонстрируют многочисленные функциональные признаки, характерные для клеток памяти.[6]
Рекомендации
- ^ а б Уэрри Э.Дж., Тейхгребер В., Беккер Т.С., Масопуст Д., Каеч С.М., Антиа Р. и др. (Март 2003 г.). «Родословная взаимосвязь и защитный иммунитет субпопуляций Т-лимфоцитов CD8». Иммунология природы. 4 (3): 225–34. Дои:10.1038 / ni889. PMID 12563257.
- ^ Klebanoff CA, Gattinoni L, Torabi-Parizi P, Kerstann K, Cardones AR, Finkelstein SE и др. (Июль 2005 г.). «Собственные центральные запоминающие / опухолевые CD8 + Т-клетки обеспечивают превосходный противоопухолевый иммунитет по сравнению с эффекторными Т-клетками памяти». Труды Национальной академии наук Соединенных Штатов Америки. 102 (27): 9571–6. Bibcode:2005PNAS..102.9571K. Дои:10.1073 / pnas.0503726102. ЧВК 1172264. PMID 15980149.
- ^ а б c d е ж грамм час я Фарбер Д.Л., Юданин Н.А., Restifo Н.П. (январь 2014 г.). «Т-клетки памяти человека: генерация, компартментализация и гомеостаз». Обзоры природы. Иммунология. 14 (1): 24–35. Дои:10.1038 / nri3567. ЧВК 4032067. PMID 24336101.
- ^ Гебхардт Т., Ваким Л.М., Eidsmo L, Reading PC, Heath WR, Carbone FR (май 2009 г.). «Т-клетки памяти в нелимфоидной ткани, которые обеспечивают повышенный местный иммунитет во время заражения вирусом простого герпеса». Иммунология природы. 10 (5): 524–30. Дои:10.1038 / ni.1718. PMID 19305395.
- ^ а б Шин Х., Ивасаки А. (сентябрь 2013 г.). «Резидентные Т-клетки памяти». Иммунологические обзоры. 255 (1): 165–81. Дои:10.1111 / imr.12087. ЧВК 3748618. PMID 23947354.
- ^ а б Гаттинони Л., Лугли Е., Джи Й., Поз З., Паулос С.М., Куигли М.Ф. и др. (Сентябрь 2011 г.). «Подмножество Т-клеток памяти человека со свойствами стволовых клеток». Природа Медицина. 17 (10): 1290–7. Дои:10,1038 / нм.2446. ЧВК 3192229. PMID 21926977.
- ^ White JT, Cross EW, Kedl RM (июнь 2017 г.). «+ Т-клетки: откуда они берутся и зачем они нам нужны». Обзоры природы. Иммунология. 17 (6): 391–400. Дои:10.1038 / нет.2017.34. ЧВК 5569888. PMID 28480897.
- ^ Ли Дж.Й., Гамильтон С.Е., Акуэ А.Д., Хогквист К.А., Джеймсон СК (август 2013 г.). «Т-клетки CD8 виртуальной памяти обладают уникальными функциональными свойствами». Труды Национальной академии наук Соединенных Штатов Америки. 110 (33): 13498–503. Bibcode:2013ПНАС..11013498Л. Дои:10.1073 / pnas.1307572110. ЧВК 3746847. PMID 23898211.
- ^ Дробек А., Мудра А., Мюллер Д., Хуранова М., Хоркова В., Прибикова М. и др. (Июль 2018). «Сильные гомеостатические сигналы TCR вызывают образование самотолерантных CD8 Т-клеток виртуальной памяти». Журнал EMBO. 37 (14). Дои:10.15252 / embj.201798518. ЧВК 6043851. PMID 29752423.
- ^ а б c d е ж грамм час я Кумар Б.В., Коннорс Т.Дж., Фарбер Д.Л. (февраль 2018 г.). «Развитие, локализация и функции человеческих Т-клеток на протяжении всей жизни». Иммунитет. 48 (2): 202–213. Дои:10.1016 / j.immuni.2018.01.007. ЧВК 5826622. PMID 29466753.
- ^ а б c d е ж грамм час Restifo NP, Gattinoni L (октябрь 2013 г.). «Клонирование эффекторных Т-клеток и Т-клеток памяти». Текущее мнение в иммунологии. Специальный раздел: Системная биология и биоинформатика / Иммуногенетика и трансплантация. 25 (5): 556–63. Дои:10.1016 / j.coi.2013.09.003. ЧВК 3858177. PMID 24148236.
- ^ а б c d Хеннинг А.Н., Ройчудхури Р., Restifo NP (май 2018 г.). «+ Дифференцировка Т-клеток». Обзоры природы. Иммунология. 18 (5): 340–356. Дои:10.1038 / № 2017.146. ЧВК 6327307. PMID 29379213.
- ^ а б c d Янгблад Б., Хейл Дж. С., Ахмед Р. (июль 2013 г.). «Дифференциация Т-клеток памяти: выводы из сигнатур транскрипции и эпигенетики». Иммунология. 139 (3): 277–84. Дои:10.1111 / imm.12074. ЧВК 3701173. PMID 23347146.
- ^ а б c d е Шмидл С., Делахер М., Хюэн Дж., Фуэрер М. (сентябрь 2018 г.). «Эпигенетические механизмы, регулирующие Т-клеточные ответы». Журнал аллергии и клинической иммунологии. 142 (3): 728–743. Дои:10.1016 / j.jaci.2018.07.014. PMID 30195378.
- ^ Саллусто Ф, Лениг Д., Фёрстер Р., Липп М., Ланзавеккья А. (октябрь 1999 г.). «Два подмножества Т-лимфоцитов памяти с различными потенциалами самонаведения и эффекторными функциями». Природа. 401 (6754): 708–12. Bibcode:1999Натура.401..708С. Дои:10.1038/44385. PMID 10537110.
- ^ Акбар А.Н., Терри Л., Тиммс А., Беверли П.К., Джаносси Г. (апрель 1988 г.). «Потеря CD45R и повышение реактивности UCHL1 - это особенность примированных Т-клеток». Журнал иммунологии. 140 (7): 2171–8. PMID 2965180.
- ^ Виллинджер Т., Фриман Т., Хасегава Х., МакМайкл А.Дж., Каллан М.Ф. (ноябрь 2005 г.). «Молекулярные сигнатуры отличают центральную память человека от субнаборов Т-лимфоцитов CD8 эффекторной памяти». Журнал иммунологии. 175 (9): 5895–903. Дои:10.4049 / jimmunol.175.9.5895. PMID 16237082.
- ^ Кох С., Ларби А., Дерхованесян Е., Озчелик Д., Наумова Е., Павелец Г. (июль 2008 г.). «Многопараметрический проточный цитометрический анализ субпопуляций CD4 и CD8 Т-клеток у молодых и пожилых людей». Иммунитет и старение. 5 (6): 6. Дои:10.1186/1742-4933-5-6. ЧВК 2515281. PMID 18657274.
- ^ а б c Мюллер С.Н., Маккей Л.К. (февраль 2016 г.). «Резидентные Т-клетки памяти: местные специалисты по иммунной защите». Обзоры природы. Иммунология. 16 (2): 79–89. Дои:10.1038 / нет.2015.3. PMID 26688350.
- ^ Steinert EM, Schenkel JM, Fraser KA, Beura LK, Manlove LS, Igyártó BZ и др. (Май 2015 г.). «Количественная оценка Т-лимфоцитов CD8 выявляет регионализацию иммунного надзора». Клетка. 161 (4): 737–49. Дои:10.1016 / j.cell.2015.03.031. ЧВК 4426972. PMID 25957682.
- ^ а б c «Исследование указывает на возможную ахиллесову пятку в ключевых клетках иммунной памяти».
- ^ Ли Й.Дж., Джеймсон СК, Хогквист К.А. (февраль 2011 г.). «Альтернативная память в линии CD8 Т-клеток». Тенденции в иммунологии. 32 (2): 50–6. Дои:10.1016 / j.it.2010.12.004. ЧВК 3039080. PMID 21288770.
- ^ Марусина А.И., Оно Ю., Мерлеев А.А., Шимода М., Огава Х., Ван Э.А. и др. (Февраль 2017). «+ виртуальная память: неопытные антигенами Т-клетки находятся в наивных, регуляторных и Т-клеточных компартментах памяти с одинаковой частотой, что влияет на аутоиммунитет». Журнал аутоиммунитета. 77: 76–88. Дои:10.1016 / j.jaut.2016.11.001. ЧВК 6066671. PMID 27894837.
