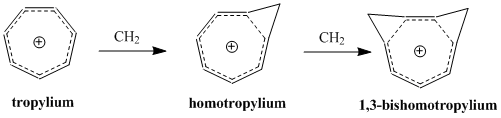
Гомоароматичность - Homoaromaticity
Гомоароматичность, в органическая химия, относится к частному случаю ароматичность в котором спряжение прерывается одним sp3 гибридизированный атом углерода. Хотя этот зр3 центр нарушает непрерывное перекрытие р-орбитали, традиционно считается требованием к ароматичности, значительной термодинамической стабильности и многие спектроскопические, магнитные и химические свойства, связанные с ароматическими соединениями, все еще наблюдаются для таких соединений. Этот формальный разрыв, по-видимому, перекрывается перекрытием p-орбиталей, поддерживая непрерывный цикл π-электронов, который отвечает за это сохраняющееся химическая стабильность.[1]

Концепция гомоароматичности была впервые предложена Сол Винштейн в 1959 г., чему способствовали его исследования катиона «трис-гомоциклопропенил».[2] С момента публикации статьи Винштейна много исследований было посвящено пониманию и классификации этих молекул, которые представляют собой дополнительный класс ароматических молекул, включенных в постоянно расширяющееся определение ароматичности. На сегодняшний день известно, что гомоароматические соединения существуют как катионный и анионный видов, и некоторые исследования подтверждают существование нейтральных гомоароматических молекул, хотя они встречаются реже.[3] Катион «гомотропилиум» (C8ЧАС9+) является, пожалуй, наиболее изученным примером гомоароматического соединения.
Обзор
Именование
Термин «гомоароматичность» происходит от структурного сходства между гомоароматическими соединениями и аналогичными гомо-конъюгированный алкены ранее отмечалось в литературе.[2] В ИЮПАК Золотая книга требует использования префиксов Bis-, Tris- и т. д. для описания гомоароматических соединений, в которых два, три и т. д. sp3 центры по отдельности прерывают сопряжение ароматической системы.
История
Концепция гомоароматичности берет свое начало в дебатах по поводу неклассический ионы карбония это произошло в 1950-х годах. Сол Винштейн, известный сторонник неклассической ионной модели, впервые описал гомоароматичность, изучая 3-бицикло [3.1.0] гексильный катион.
В серии экспериментов по ацетолизу Winstein et al. заметил, что сольволиз реакция произошла эмпирически быстрее, когда тозил уходящая группа был в экваториальный позиция. Группа приписала эту разницу в скорости реакции анхимерная помощь вызывается "цис-изомером". Таким образом, этот результат подтвердил неклассическую структуру катиона.[4]
Впоследствии Винштейн заметил, что эта неклассическая модель 3-бицикло [3.1.0] гексильного катиона аналогична ранее хорошо изученной ароматической модели. циклопропенил катион. Как и у циклопропенильного катиона, положительный заряд делокализованный над тремя эквивалентными атомами углерода, содержащими два π-электрона. Таким образом, эта электронная конфигурация удовлетворяет Правило Гюккеля (требуется 4n + 2 π электронов) для ароматичности. Действительно, Винштейн заметил, что единственное фундаментальное различие между этим ароматическим пропенильным катионом и его неклассическим гексильным катионом заключалось в том, что в последнем ионе спряжение прерывается тремя -CH
2- единицы. Таким образом, группа предложила название «трис-гомоциклопропенил» - трис-гомо аналог циклопропенильного катиона.
Доказательства гомоароматичности
Критерий гомоароматичности
Критерий ароматичность эволюционировала по мере того, как новые разработки и идеи продолжают способствовать нашему пониманию этих удивительно стабильных Органические молекулы.[5] Таким образом, требуемые характеристики этих молекул остаются предметом споров. Классически ароматические соединения определялись как плоские молекулы, которые циклически делокализованный система (4n + 2) π-электронов, удовлетворяющая Правило Гюккеля. Что наиболее важно, эти системы сопряженных колец, как известно, демонстрируют огромные термохимическая стабильность относительно прогнозов, основанных на локализованных резонансных структурах. Вкратце, ароматические соединения характеризуют три важные особенности:[6]
- молекулярная структура (т.е. копланарность: все участвующие атомы в одной плоскости)
- молекулярная энергетика (т.е. повышенная термодинамическая стабильность )
- спектроскопический и магнитный свойства (например, индуцированный магнитным полем кольцевой ток)
Однако существует ряд исключений из этих обычных правил. Многие молекулы, в том числе Мебиус 4nπ электронная разновидность, перициклический переходные состояния, молекулы, в которых делокализованные электроны циркулировать в плоскости кольца или через σ (скорее, чем π ) связи, многие сэндвич-молекулы переходных металлов и другие считаются ароматическими, хотя они каким-то образом отклоняются от обычных параметров ароматичности.[7]
Следовательно, критерий гомоароматической делокализации остается столь же неоднозначным и несколько противоречивым. Катион гомотропия (C8ЧАС9+), хотя и не первый из когда-либо обнаруженных гомоароматических соединений, оказался наиболее изученным из соединений, классифицируемых как гомоароматические, и поэтому часто считается классическим примером гомоароматичности. К середине 1980-х годов было зарегистрировано более 40 замещенных производных катиона гомотропия, что отражает важность этого иона в формировании нашего понимания гомоароматических соединений.[6]
Ранние доказательства гомоароматичности
После того, как Винштейн опубликовал первые сообщения о «гомоароматической» структуре трис-гомоциклопропенильного катиона, многие группы начали сообщать о наблюдениях за подобными соединениями. Одной из наиболее изученных из этих молекул является катион гомотропия, исходное соединение которого было впервые выделено в виде стабильной соли Петтитом и др. в 1962 году, когда группа отреагировала циклооктатраен с сильными кислотами.[8] Большая часть ранних доказательств гомоароматичности происходит из наблюдений необычных свойств ЯМР, связанных с этой молекулой.
ЯМР-спектроскопические исследования
При характеристике соединения, образующегося при депротонировании циклооктатриен от 1ЧАС ЯМР-спектроскопия группа отметила, что резонанс соответствует двум протоны связаны с тем же метиленовым мостиком углерод продемонстрировал поразительную степень разделения в химический сдвиг.

Исходя из этого наблюдения, Петтит и др. пришли к выводу, что классическая структура циклооктатриенильного катиона должна быть неправильной. Вместо этого группа предложила структуру бицикло [5.1.0] октадиенильного соединения, предполагая, что циклопропан связь, расположенная внутри восьмичленного кольца, должна подвергаться значительным делокализация, что объясняет резкую разницу в наблюдаемом химическом сдвиге. При дальнейшем рассмотрении Петтит был склонен представить соединение как «ион гомотропия», который показывает, что «внутренняя циклопропановая» связь полностью заменена делокализацией электронов. Эта структура показывает, как делокализация является циклической и включает 6 π-электронов, что соответствует правилу Хюккеля для ароматичности. Магнитное поле ЯМР могло, таким образом, индуцировать кольцевой ток в ионе, ответственный за значительные различия в резонансе между экзо- и эндо протонами этого метиленового мостика. Петтит и др. таким образом подчеркивается замечательное сходство между этим соединением и ароматическим ионом тропилия, описывая новый «гомо-аналог» уже известной ароматической разновидности, в точности как предсказано Винштейном.
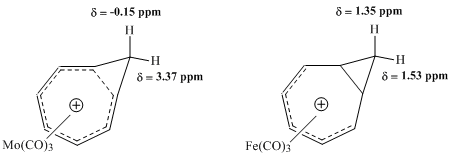
Последующие исследования ЯМР, предпринятые Винштейном и другими, стремились оценить свойства карбонильных комплексов металлов с ионом гомотропия. Особенно плодотворным оказалось сравнение комплекса молибдена и комплекса железа. Молибден Ожидалось, что трикарбонил будет координироваться с катионом гомотропия, принимая 6 π-электронов, тем самым сохраняя гомоароматические свойства комплекса. Напротив, утюг Ожидалось, что трикарбонил будет координироваться с катионом, принимая только 4 π-электронов от иона гомотропия, создавая комплекс, в котором локализованы электроны катиона. Исследования этих комплексов 1ЧАС ЯМР-спектроскопия показали большую разницу в значениях химического сдвига для метиленовых протонов комплекса Мо, согласующуюся с гомоароматической структурой, но практически не обнаружили сопоставимой разницы в резонансе для тех же протонов в комплексе Fe.[9]
УФ-спектроскопические исследования
Важным ранним доказательством в поддержку структуры катиона гомотропия, которое не зависит от магнитных свойств молекулы, является получение ее УФ спектр. Винштейн и др. определили, что максимумы поглощения катиона гомотропия имеют значительно более короткие длина волны чем можно было бы ожидать для классического циклооктатриенильного катиона или бицикло [5.1.0] октадиенильного соединения с полностью сформированной внутренней циклопропановой связью (и локализованной электронной структурой). Вместо этого УФ-спектр больше всего напоминал спектр ароматических ион тропилия. Дальнейшие расчеты позволили Винштейну определить, что ордер на облигации между двумя атомами углерода, смежными с удаленным метиленовым мостиком, сравнимо с атомом углерода π-связь разделение соответствующих атомов углерода в катионе тропилия.[10] Хотя этот эксперимент оказался очень ярким, УФ-спектры обычно считаются плохими индикаторами ароматичности или гомоароматичности.[6]
Более свежие доказательства гомоароматичности
Совсем недавно была проведена работа по исследованию структуры предположительно гомоароматического гомотропилиевого иона с использованием различных других экспериментальных методов и теоретических расчетов. Одно из ключевых экспериментальных исследований включало анализ замещенного иона гомотропилия с помощью Рентгеновская кристаллография. Эти кристаллографические исследования были использованы для демонстрации того, что межъядерное расстояние между атомами в основе циклопропенильной структуры действительно длиннее, чем можно было бы ожидать для нормального циклопропан молекула, а внешняя облигации оказались короче, что указывает на участие внутренней циклопропановой связи в делокализации заряда.[6]
Молекулярно-орбитальное описание
Молекулярно-орбитальное объяснение стабильности гомоароматичности широко обсуждалось в рамках множества различных теорий, в основном сосредоточенных на катионе гомотропенилия в качестве ссылки. R.C. Хэддон первоначально предложил Модель Мебиуса где внешние электроны sp3 гибридизованный метиленовый мостиковый углерод (2) отдает обратно соседним атомам углерода для стабилизации расстояния C1-C3.[11]
Теория возмущений молекулярных орбиталей
Гомоароматичность можно лучше объяснить с помощью теории молекулярных орбиталей возмущений (PMO), как описано в исследовании 1975 года Роберта К. Хаддона. Катион гомотропенилия можно рассматривать как возмущенную версию катиона тропенилия из-за добавления гомоконъюгатной связи, мешающей резонансу исходного катиона.[12]

Эффекты первого порядка
Наиболее важным фактором, влияющим на гомоароматический характер, является добавление одной гомоконъюгатной связи в исходное ароматическое соединение. Расположение гомоконъюгатной связи не имеет значения, поскольку все гомоароматические соединения могут происходить из ароматических соединений, обладающих симметрией и равным порядком связи между всеми атомами углерода. Введение гомоконъюгированной связи нарушает плотность π-электронов, величина δβ, которая в зависимости от размера кольца должна быть больше 0 и меньше 1, где 0 означает отсутствие возмущения, а 1 представляет полную потерю ароматичности (дестабилизация эквивалентна открытая цепная форма).[12] Считается, что с увеличением размера кольца резонансная стабилизация гомоароматичности компенсируется напряжением при образовании гомоконъюгатного мостика. Фактически, максимальный размер кольца для гомоароматичности довольно низок, поскольку 16-членный аннулен кольцо способствует образованию ароматического дикатиона вместо гомокации с натянутым мостиком.[13]
Эффекты второго порядка
Вторая гомоконъюгатная связь
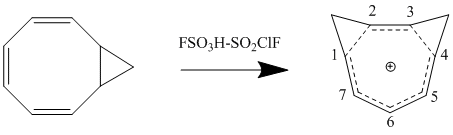
Существенным влиянием второго порядка на модель гомоароматичности Perturbation Molecular Orbital является добавление второй гомоконъюгатной связи и ее влияние на стабильность. Эффект часто заключается в удвоении нестабильности, вызванной добавлением одной гомоконъюгатной связи, хотя есть дополнительный член, который зависит от близости двух связей. Чтобы минимизировать δβ и, таким образом, свести к минимуму срок связывания, в зависимости от конформации образуются бисомоароматические соединения с наибольшей стабильностью по резонансу и наименьшим стерическим препятствием. Синтез катиона 1,3-бисомотропенилия протонированием цис-бицикло [6.1.0] нона-2,4,6-триена согласуется с теоретическими расчетами и максимизирует стабильность за счет образования двух метиленовых мостиков у 1-го и 3-го атомов углерода.[12]
Заместители
Добавление заместителя к гомоароматическому соединению имеет большое влияние на стабильность соединения. В зависимости от относительного расположения заместителя и гомоконъюгатной связи заместитель может оказывать либо стабилизирующее, либо дестабилизирующее действие. Это взаимодействие лучше всего демонстрируется при рассмотрении замещенного катиона тропенилия. Если индуктивно электронодонорная группа присоединена к катиону в 1-м или 3-м положении углерода, это оказывает стабилизирующий эффект, улучшая гомоароматический характер соединения. Однако, если тот же самый заместитель присоединен ко 2-му или 4-му атому углерода, взаимодействие между заместителем на гомоконъюгатном мостике оказывает дестабилизирующее действие. Следовательно, протонирование метил- или фенил-замещенных циклооктатетраенов приведет к образованию 1-го изомера катиона гомотропенилия.[12]

Примеры гомоароматических соединений
После открытия первых гомоароматических соединений были проведены исследования по синтезу новых гомоароматических соединений, которые обладают такой же стабильностью, что и их ароматические исходные соединения. Существует несколько классов гомоароматических соединений, каждый из которых предсказан теоретически и доказан экспериментально.
Катионные гомоароматические соединения
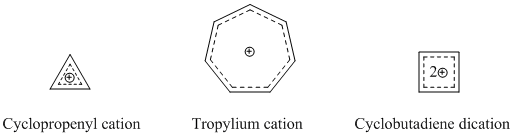
Наиболее устоявшимися и хорошо известными гомоароматическими разновидностями являются катионные гомоароматические соединения. Как указывалось ранее, катион гомотропенилия является одним из наиболее изученных гомоароматических соединений. Многие гомоароматические катионные соединения используют в качестве основы циклопропенильный катион, катион тропилия или дикатион циклобутадиена, поскольку эти соединения обладают сильным ароматическим характером.[14]
В дополнение к катиону гомотропилия, другим хорошо известным катионным гомоароматическим соединением является катион норборнен-7-ил, который, как было показано, является сильно гомоароматическим, что доказано как теоретически, так и экспериментально.[15]

Интригующий случай σ-бишомоароматичность можно найти в диктовках пагоданы. В этих системах с 4 центрами и 2 электронами делокализация происходит в плоскости, определяемой четырьмя атомами углерода (прототип явления σ-ароматичности циклопропан который набирает около 11,3 ккал моль−1 стабильность от воздействия[16]). Дикатионы доступны либо путем окисления пагодана, либо путем окисления соответствующего бис-додекаэдрадиена:[17]
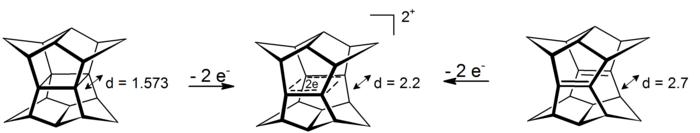
Восстановление соответствующих шестиэлектронных дианионов до сих пор не представлялось возможным.
Нейтральные гомоароматики
Существует много классов нейтральных гомоароматических соединений, хотя ведется много споров относительно того, действительно ли они проявляют гомоароматический характер или нет. Один класс нейтральных гомоароматических соединений называется моногомоароматическими соединениями, одним из которых является циклогептатриен, и были синтезированы многочисленные сложные моногомоароматические соединения. Одним из конкретных примеров является 60-углеродный фуллероид производное, имеющее единственный метиленовый мостик. УФ- и ЯМР-анализ показали, что ароматический характер этого модифицированного фуллероида не нарушается добавлением гомоконъюгатной связи, поэтому это соединение однозначно гомоароматическое.[18]
Бишомоароматика
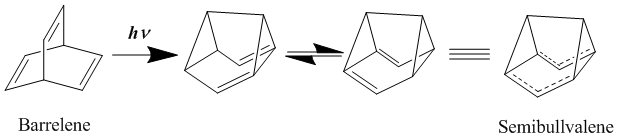
Долгое время считалось, что лучшими примерами нейтральных гомоароматических соединений являются такие биишомоароматические соединения, как Barrelene и полубулвален. Впервые синтезирован в 1966 г.,[19] полибуллвален имеет структуру, которая должна хорошо поддаваться гомоароматичности, хотя было много споров о том, могут ли производные полибуллвалена обеспечивать истинно делокализованное, нейтральное в основном состоянии гомоароматическое соединение или нет. В целях дальнейшей стабилизации делокализованной переходной структуры путем замены полубулвалена на электронные донорские и принимающие группы было обнаружено, что активационный барьер для этой перегруппировки может быть понижен, но не устранен.[20][21] Однако с введением кольцевой деформации в молекулу, направленной на дестабилизацию локализованных структур основного состояния посредством стратегического добавления циклических аннелирований, действительно может быть достигнута делокализованная гомоароматическая структура основного состояния.[22]
Из нейтральных гомоароматических соединений наиболее вероятными соединениями, проявляющими нейтральную гомоароматичность, являются борсодержащие соединения 1,2-диборетана и его производных. Показано, что замещенные диборетаны обладают гораздо большей стабилизацией в делокализованном состоянии по сравнению с локализованным, что дает явные признаки гомоароматичности.[23] Когда электронодонорные группы присоединены к двум атомам бора, соединение отдает предпочтение классической модели с локализованными связями. Гомоароматический характер лучше всего проявляется, когда электроноакцепторные группы связаны с атомами бора, в результате чего соединение принимает неклассическую, делокализованную структуру.

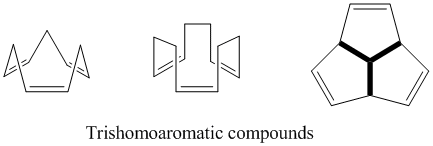
Тришомоароматика
Как следует из названия, тришомоароматические соединения определяются как содержащие один дополнительный метиленовый мостик по сравнению с бишомоароматическими соединениями, поэтому в целом содержат три из этих гомоконъюгатных мостиков. Как и в случае с полубулваленом, до сих пор ведутся споры о степени гомоароматического характера тришомоароматических соединений. Хотя теоретически они являются гомоароматическими, эти соединения показывают стабилизацию не более 5% бензола из-за делокализации.[24]
Анионные гомоароматики
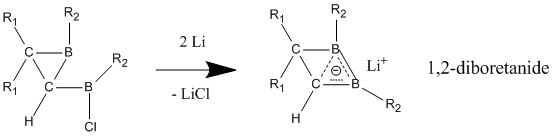
В отличие от нейтральных гомоароматических соединений широко распространено мнение, что анионные гомоароматические соединения проявляют «истинную» гомоароматичность. Эти анионные соединения часто получают из их нейтральных исходных соединений путем восстановления металлическим литием. Производные 1,2-диборетанида проявляют сильный гомоароматический характер благодаря своей трехатомной (бор, бор, углерод) двухэлектронной связи, которая содержит более короткие связи C-B, чем в нейтральном классическом аналоге.[25] Эти 1,2-диборетаниды могут быть расширены до большего размера кольца с различными заместителями, и все они содержат некоторую степень гомоароматичности.
Анионную гомоароматичность можно также увидеть в дианионных бис-диазеновых соединениях, которые содержат четырехатомный (четыре атома азота) шестиэлектронный центр. Результаты экспериментов показали сокращение трансаннулярного расстояния азот-азот, тем самым демонстрируя, что дианионный бис-диазен является одним из типов анионных бисомоароматических соединений. Особенностью этих систем является то, что циклическая делокализация электронов происходит в σ-плоскости, определяемой четырьмя атомами азота. Эти бис-диазен-дианионы, таким образом, являются первыми примерами 4-центра-6-электронного σ-бишомоароматичность.[26][27] Соответствующие 2-х электронные σ-бисомоароматические системы были реализованы в виде пагодане лекарства (см. выше).
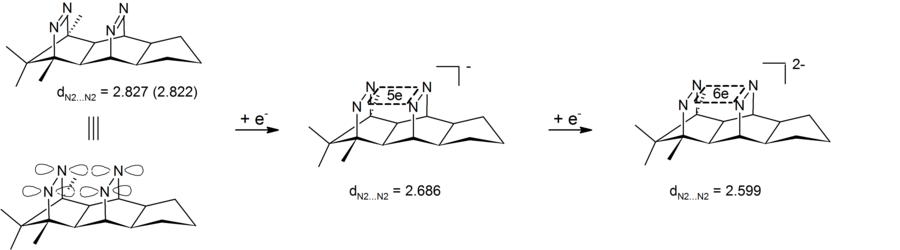
Антигомоароматичность
Также есть сообщения об антигомоароматических соединениях. Как только ароматный соединения обладают исключительной стабильностью, антиароматический соединения, которые отклоняются от Правило Гюккеля и содержат замкнутый контур из 4n π электронов, относительно нестабильны. В мостовой Катион бицикло [3.2.1] окта-3,6-диен-2-ила содержит только 4 π-электрона и, следовательно, является «бисомоантиароматическим». Серия теоретических расчетов подтверждает, что он действительно менее стабилен, чем соответствующий аллильный катион.[28]
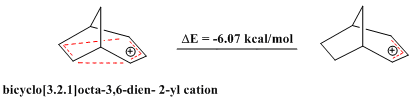
Аналогичным образом замещенный бицикло [3.2.1] окта-3,6-диен-2-ил катион (2- (4'-фторфенил) бицикло [3.2.1] окт-3,6-диен-2-ил катион ) также было показано, что он является антиароматическим веществом по сравнению с его соответствующим аллильным катионом, что подтверждено теоретическими расчетами, а также анализом ЯМР.[28]

внешняя ссылка
- Гомоароматичность Золотая книга Связь
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Гомоароматический ". Дои:10.1351 / goldbook.H02839
- ^ а б Винштейн, S (1959). «Гомо-ароматические структуры». Варенье. Chem. Soc. 81 (24): 6523. Дои:10.1021 / ja01533a052.
- ^ Фримен, П. К. (2005). «Нейтральная гомоароматичность в некоторых нейтральных гетероциклах». J. Org. Chem. 70 (6): 1998–2001. Дои:10.1021 / jo040250o. PMID 15760178.
- ^ Винштейн, С .; Sonnenberg, J .; Де Вриз, Л. (1959). «Трис-гомоциклопропенильный катион». Варенье. Chem. Soc. 81 (24): 6523–6524. Дои:10.1021 / ja01533a051.
- ^ Ле Нобл, У. Дж. «Ароматичность» в основных моментах органической химии: продвинутый учебник; Марсель Деккер, Inc.: Нью-Йорк, 1974. ISBN 0-8247-6210-X
- ^ а б c d Чайлдс, Р. Ф. (1984). «Ион гомотропия и гомоароматичность». Соотв. Chem. Res. 17 (10): 347–352. Дои:10.1021 / ar00106a001.
- ^ Шлейер П. Р. (2001). «Введение: ароматичность». Chem. Rev. 101 (5): 1115–1118. Дои:10.1021 / cr0103221. PMID 11749368.
- ^ Rosenburg, J. L .; Mahler, J. E .; Петтит Р. Дж. (1962). "Бицикло [5.1.0] октадиенильный катион, новый стабильный ион карбония". Варенье. Chem. Soc. 84 (14): 2842–2843. Дои:10.1021 / ja00873a051.
- ^ Винштейн, С .; Kaesz, H.D .; Kreiter, C.G .; Фридрих, E.C. (1965). «Гомотропилий-ион и его трикарбонильный комплекс молибдена». Варенье. Chem. Soc. 87 (14): 3267–3269. Дои:10.1021 / ja01092a060.
- ^ Винштейн, С .; Kreiter, C.G .; Брауман, Дж. (1966). «Кольцевая инверсия, ультрафиолетовый спектр и электронная структура иона моногомотропилия». Варенье. Chem. Soc. 88 (9): 2047–2048. Дои:10.1021 / ja00961a037.
- ^ Хэддон, Р. (1975). «Строение катиона гомотропенилия». Tetrahedron Lett. 16 (11): 863–866. Дои:10.1016 / S0040-4039 (00) 72004-1.
- ^ а б c d Хэддон, Р. (1975). «Теория гомоароматичности возмущающих молекулярных орбиталей (ПМО)». Варенье. Chem. Soc. 97 (13): 3608–3615. Дои:10.1021 / ja00846a009.
- ^ Oth, J.F.M .; Smith, D.M .; Prange, U .; Шредер, Г. (1973). «А [16] Аннулендиил Дикатион». Энгью. Chem. Int. Эд. Англ. 12 (4): 327–328. Дои:10.1002 / anie.197303271.
- ^ Сальников, Г.Е .; Генаев, А.М .; Маматюк, В.И .; Шубин, В. (2008). «Гомофеналенильные катионы, новые представители гомоароматических систем». Русь. J. Org. Chem. 44 (7): 1000–1005. Дои:10.1134 / S1070428008070099. S2CID 93688550.
- ^ Carey, F.A .; Сундберг, Р.Дж. Продвинутая органическая химия: Часть A: Структура и механизм; Kluwer Academic / Plenum Publishers: Нью-Йорк, 2000; 327-334. ISBN 978-0-387-68346-1
- ^ Экснер, Кай; Шлейер, Пол фон Раге (2001). «Теоретические энергии связи: критическая оценка». J. Phys. Chem. А. 105 (13): 3407–3416. Bibcode:2001JPCA..105.3407E. Дои:10.1021 / jp004193o.
- ^ Prinzbach, H .; Gescheidt, G .; Martin, H.-D .; Herges, R .; Heinze, J .; Пракаш, Г. К. Сурья; Олах, Г.А. «Циклическая делокализация электронов в углеводородных клетках (пагоданы, изопагоданы, (бисеко- / секо-) - (додекаэдрадиены))». Чистая и прикладная химия. 67 (5): 673–682, 1995. Дои:10.1351 / pac199567050673. S2CID 96232491.
- ^ Сузуки, Т .; Li, Q .; Khemani, K.C .; Wudl, F. (1992). «Дигидрофуллероид H3C61: синтез и свойства родительского фуллероида». Варенье. Chem. Soc. 114 (18): 7301–7302. Дои:10.1021 / ja00044a055.
- ^ Zimmerman, H.E .; Грюневальд, Г. Л. (1966). "Химия баррелена. III. Уникальная фотоизомеризация в семибулвален". Журнал Американского химического общества. 88: 183–184. Дои:10.1021 / ja00953a045.
- ^ Дьюар, M.J.S .; Ло, Д. Х. (1971). «Основные состояния молекул с сигма-связями. XIV. Применение энергетического разделения к методу MINDO / 2 и исследование перегруппировки Коупа». Варенье. Chem. Soc. 93 (26): 7201–7207. Дои:10.1021 / ja00755a014.
- ^ Hoffman, D .; Stohrer, W-D (1971). «Повторная перестановка Cope». Варенье. Chem. Soc. 93 (25): 6941–6948. Дои:10.1021 / ja00754a042.
- ^ Griffiths, P.R .; Пивонка, Д. Э .; Уильямс, Р. В. (2011). «Экспериментальная реализация нейтрального гомоароматического карбоцикла». Химия: европейский журнал. 17 (33): 9193–9199. Дои:10.1002 / chem.201100025. PMID 21735493.
- ^ Steiner, D .; Balzereit, C .; Winkler, H. J. R .; Stamatis, N .; Massa, W .; Berndt, A .; Hofmann, M .; Фон Раге Шлейер, П. (1994). «Неклассические 1,2-диборетаны и 1,2-дибороланы». Angewandte Chemie International Edition на английском языке. 33 (22): 2303–2306. Дои:10.1002 / anie.199423031.
- ^ Martin, H.D .; Майер, Б. (1983). "Эффекты близости в органической химии? Фотоэлектронное спектроскопическое исследование несвязывающих и трансаннулярных взаимодействий". Энгью. Chem. Int. Эд. Англ. 22 (4): 283–314. Дои:10.1002 / anie.198302831.
- ^ Steiner, D .; Winkler, H .; Balzereit, C .; Happel, T .; Hofmann, M .; Subramanian, G .; Schleyer, P.V.R .; Massa, W .; Берндт, А. (1996). «1,2-Диборетаниды: гомоароматические 2π-электронные соединения с высокими инверсионными барьерами». Энгью. Chem. Int. Эд. Англ. 35 (17): 1990–1992. Дои:10.1002 / anie.199619901.
- ^ Экснер, К .; Hunkler, D .; Gescheidt, G .; Принцбах, Х. (1998). «Существуют ли неклассические циклически делокализованные радикальные анионы 4N / 5e и дианионы 4N / 6e? - Одно- и двухэлектронное восстановление близких, синперипланарных бисдиазенов». Энгью. Chem. Int. Эд. Англ. 37 (13–14): 1910–1913. Дои:10.1002 / (SICI) 1521-3773 (19980803) 37: 13/14 <1910 :: AID-ANIE1910> 3.0.CO; 2-D.
- ^ Экснер, К .; Cullmann, O .; Vögtle, M .; Prinzbach, H .; Grossmann, B .; Heinze, J .; Liesum, L .; Bachmann, R .; Schweiger, A .; Гешайдт, Г. (2000). «Циклическая делокализация электронов в плоскости (σ-бисомоароматичность) в радикальных анионах 4N / 5e и дианионах 4N / 6e - генерация, структура, свойства, спаривание ионов и расчеты». Варенье. Chem. Soc. 122 (43): 10650–10660. Дои:10.1021 / ja0014943.
- ^ а б Volz, H .; Шин, Дж. (2006). "Бицикло [3.2.1] окта-3,6-диен-2-ил Катион: Бишомоантиаромат". J. Org. Chem. 71 (6): 2220–2226. Дои:10.1021 / jo0515125. PMID 16526766.
