Глутаминовая протеаза - Glutamic protease
| Сциталидопепсин B | |||||||
|---|---|---|---|---|---|---|---|
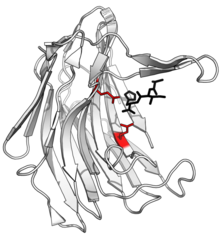 Структура сциталидокарбоксилпептидаза B, с расщепленным пептидом товар в черном и активный сайт Боковые цепи глутамат-глутаминовой диады показаны красным. (PDB: 1С2К) | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | Нет данных | ||||||
| PDB | 1С2К | ||||||
| UniProt | P15369 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.4.23.32 | ||||||
| |||||||
Глутаминовые протеазы группа протеолитический ферменты содержащий глютаминовая кислота остаток в активном сайте. Этот тип протеаза был впервые описан в 2004 г. и стал шестым каталитическим типом протеазы.[1] Ранее предполагалось, что члены этой группы протеаз являются аспартат протеаза, но структурное определение показало, что он принадлежит к новому семейству протеаз. Первой структурой этой группы протеаз была сциталидоглутаминовая пептидаза, активный центр которого содержит каталитическую диаду, глутаминовую кислоту (E) и глутамин (Q), которые дали название эколизин. Эта группа протеаз обнаруживается в основном в патогенных грибах, поражающих растения и человека.[2]
Распространение и виды
Есть два независимых семьи глутаминовых протеаз (G1 и G2) и имеют ограниченное распространение. Первоначально считалось, что они ограничиваются нитчатые грибы в основном в Аскомикота тип.[3] Однако впоследствии глутаминовые протеазы были идентифицированы в бактерии и археи.[4]
Первое суперсемейство глутаминовых протеаз было идентифицировано у грибов. Сциталидий лигникола и Aspergillus niger var. макроспор, откуда сциталидоглутаминовая пептидаза (эколизин) и аспергиллоглутаминовая пептидаза выводятся соответственно. Эти две протеазы содержат остатки Glu и Gln в активном центре и сгруппированы в MEROPS. семья G1.[5][6]
Конвергентно эволюционирующая глутаминовая пептидаза, белок придатка перед шейкой (бактериофаг phi-29), использует диаду Glu и Asp в активном центре и классифицируется как семейство MEROPS G2.[7]
Характеристики
Эти ферменты представляют собой кислотные протеазы; эколизин например, наиболее активен при pH 2,0, когда в качестве субстрата используется казеин.[2] Эколозины предпочитают объемные аминокислотные остатки в сайте P1 и небольшие аминокислотные остатки в сайте P1 '. Особенностью протеазы является ее нечувствительность к пепстатин и S-PI (ацетилпепстатин), который ранее был классифицирован как «нечувствительные к пепстатину карбоксилпротеиназы».[8] Другие «нечувствительные к пепстатину карбоксилпротеиназы» принадлежат к подсемейству сериновая протеаза, серин-карбоксилпротеаза (седолизин), открытая в 2001 году.[2] Эти протеазы также не ингибируются DAN (метиловый эфир диазоацетил-DL-норлейцина) (7), но могут ингибироваться EPNP (1,2-эпокси-3- (п-нитрофенокси) пропан).[9][10]
Активный центр и механизм катализа
В активный сайт эколосина содержит отличительный глютаминовая кислота и глутамин каталитические диады, которые участвуют в связывании субстрата и катализе. Эти остатки действуют как нуклеофилы, а глутаминовая кислота выступает в качестве общей кислоты на первой фазе реакции, отдавая протон карбонильному кислороду в пептидной связи субстрата. Одна или две молекулы воды могут быть вовлечены в реакцию, поставляющую гидроксильную группу, а глутаминовая кислота дополнительно отдает протон амидному азоту, что приводит к разрыву пептидной связи. Затем глутамин возвращает глутаминовую кислоту в исходное состояние.[11]
Смотрите также
Рекомендации
- ^ Fujinaga M, Cherney MM, Oyama H, Oda K, James MN (март 2004 г.). «Молекулярная структура и каталитический механизм новой карбоксилпептидазы из Scytalidium lignicolum». Труды Национальной академии наук Соединенных Штатов Америки. 101 (10): 3364–9. Дои:10.1073 / pnas.0400246101. ЧВК 373467. PMID 14993599.
- ^ а б c Ода К. (январь 2012 г.). «Новые семейства карбоксилпептидаз: серин-карбоксилпептидазы и глутаминовые пептидазы». Журнал биохимии. 151 (1): 13–25. Дои:10.1093 / jb / mvr129. PMID 22016395.
- ^ Симс А. Х., Данн-Коулман Н. С., Робсон Г. Д., Оливер С. Г. (октябрь 2004 г.). «Распределение глутаминовой протеазы ограничено мицелиальными грибами». Письма о микробиологии FEMS. 239 (1): 95–101. Дои:10.1016 / j.femsle.2004.08.023. PMID 15451106.
- ^ Йенсен К., Остергаард ПР, Уилтинг Р., Лассен С.Ф. (2010). «Идентификация и характеристика бактериальной глутаминовой пептидазы». BMC Биохимия. 11 (47): 47. Дои:10.1186/1471-2091-11-47. ЧВК 3009609. PMID 21122090.
- ^ Сасаки Х., Кубота К., Ли В. К., Оцука Дж., Кодзима М., Ивата С., Накагава А., Такахаши К., Танокура М. (июль 2012 г.). «Кристаллическая структура промежуточного димера аспергиллоглутаминовой пептидазы, которая имитирует комплекс продукта активации фермента, образующийся при автопротеолизе». Журнал биохимии. 152 (1): 45–52. Дои:10.1093 / jb / mvs050. PMID 22569035.
- ^ Такахаши К. (2013). «Исследования структуры и функции ферментов с каталитической карбоксильной группой (ами): от рибонуклеазы Т1 до карбоксилпептидаз». Труды Японской академии, серия B. 89 (6): 201–25. Дои:10.2183 / pjab.89.201. ЧВК 3749792. PMID 23759941.
- ^ «Семья G2». МЕРОПЫ.
- ^ «Семья G1». МЕРОПЫ.
- ^ Мурао С., Ода К., Мацусита Ю. (1973). «Выделение и идентификация микроорганизма, который продуцирует ингибитор пепсина, не являющийся Streptomyces, и кислотные протеазы, чувствительные к N-диазоацетил-DL-норлейцину и метилэфиру». Agric. Биол. Chem. 37 (6): 1417–1421. Дои:10.1271 / bbb1961.37.1417.
- ^ Морихара К., Цузуки Х., Мурао С., Ода К. (март 1979 г.). «Нечувствительные к пепстатину кислотные протеазы из Scytalidium lignicolum. Кинетическое исследование с синтетическими пептидами». Журнал биохимии. 85 (3): 661–8. PMID 34596.
- ^ Мозелио Шехтер, изд. (2009). Энциклопедия микробиологии (3-е изд.). Академическая пресса. п. 499. ISBN 978-0123739391.

