Метаванадат аммония - Ammonium metavanadate
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Триоксованадат аммония (V) | |
| Другие имена Ванадат аммония | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.329 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| NH4VO3 | |
| Молярная масса | 116,98 г / моль |
| Внешность | белый |
| Плотность | 2,326 г / см3 |
| Температура плавления | разлагается> 70 ° C (158 ° F, 343 K) |
| Точка кипения | разлагается |
| Растворимость | диэтаноламин, этаноламин |
| Опасности | |
| Главный опасности | возможный мутаген, опасно для окружающей среды |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H301, H332, H340, H361, H370, H372, H402, H412 | |
| P201, P202, P260, P261, P264, P270, P271, P273, P281, P301 + 310, P304 + 312, P304 + 340, P307 + 311, P308 + 313, P312, P314, P321, P330, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 58,1 мг / кг, перорально (крысы) |
| Родственные соединения | |
Другой анионы | Ортованадат аммония Гексаванадат аммония |
Другой катионы | Метаванадат натрия Метаванадат калия |
Родственные соединения | Пятиокись ванадия |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Метаванадат аммония это неорганическое соединение с формулой NH4VO3. Это белое твердое вещество, хотя образцы часто желтые из-за примесей V2О5. Это важный промежуточный продукт в очистке ванадия.[1]
Синтез и структура
Соединение получают добавлением солей аммония к растворам ванадат-ионов, образующихся при растворении V2О5 в основных водных растворах, таких как горячий карбонат натрия. Соединение выпадает в осадок в виде бесцветного твердого вещества.[2][3] Эта стадия осаждения может быть медленной.
Компаунд имеет полимерную структуру, состоящую из цепей [VO3] -, образованный как ВО4 тетраэдры. Эти цепочки связаны между собой через водородные связи с аммоний ионы.[4]
 |  | 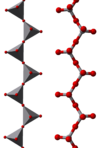 |
Использует
Ванадий часто очищают из водных экстрактов шлаков и руды путем селективного осаждения метаванадата аммония. Затем материал обжаривается, чтобы дать пятиокись ванадия:[1]
- 2 NH4VO3 → V2О5 + 2 NH3 + H2О
Другой
Ванадаты могут вести себя как структурные имитаторы фосфатов и, таким образом, проявлять биологическую активность.[5][6]
Метаванадат аммония используется для приготовления Реагент Манделина, качественный тест на алкалоиды.
Рекомендации
- ^ а б Гюнтер Бауэр, Фолькер Гютер, Ганс Хесс, Андреас Отто, Оскар Ройдл, Хайнц Роллер, Зигфрид Саттельбергер «Ванадий и соединения ванадия» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a27_367
- ^ Г. Брауэр «Метаванадат аммония» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1. п. 1272.
- ^ Роберт Х. Бейкер, Гарри Циммерман, Р. Н. Максон "Неорганический синтез метаванадата аммония", 1950, Vol. 3, 117-118. Дои:10.1002 / 9780470132340.ch30
- ^ Владимир Сынечек и Франтишек Ханич (1954). «Кристаллическая структура метаванадата аммония». Чехословацкий журнал физики. 4 (2): 120–129. Bibcode:1954CzJPh ... 4..120S. Дои:10.1007 / BF01687750.
- ^ Корбеки, Ян; Барановска-Босяцкая, Ирена; Гутовская, Изабела; Члубек, Дариуш "Биохимическое и медицинское значение соединений ванадия" Acta Biochimica Polonica 2012, vol. 59, с. 195-200.
- ^ Crans, D. C .; Чаттерджи, П. Б. "Биохимия ванадия" Ридейк, Ян; Poeppelmeier, Kenneth, Eds. Комплексная неорганическая химия II (2013), 3, 323-342. Дои:10.1016 / B978-0-08-097774-4.00324-7

