Вариант поверхностного гликопротеина - Variant surface glycoprotein
| Гликопротеин с переменной поверхностью | |
|---|---|
| Идентификаторы | |
| Организм | |
| Символ | Tb927.5.4730 |
| Альт. символы | Tb05.26C7.380 |
| Entrez | 3657576 |
| Прочие данные | |
| Хромосома | 5: 1.41 - 1.41 Мб |
| Вариант поверхностного гликопротеина MITAT 1.2 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | Нет данных | ||||||
| Альт. символы | VSG 221 | ||||||
| UniProt | P26332 | ||||||
| |||||||
Вариант поверхностного гликопротеина (VSG) представляет собой белок ~ 60 кДа, который плотно упаковывает поверхность клетки из простейшие паразиты принадлежность к роду Трипаносома. Они образуют поверхностное покрытие 12–15 нм и впервые были изолированы от Trypanosoma brucei в 1975 г. Георгий Крест.[1] VSG позволяет паразитам-трипаносоматидам уклоняться от иммунной системы млекопитающего-хозяина с помощью обширных антигенная вариация. VSG не имеет предписаний биохимический Мероприятия.

Паразит имеет большой клеточный репертуар антигенно различных VSG (~ 1500 полных и частичных (псевдогены )) находится в теломерный и субтеломерный массивы (на мегабаза хромосомы или минихромосомы ). VSG экспрессируются из сайта экспрессии кровотока (BES, ES) в полицистрон к РНК-полимераза I (рекрутированы в рибосомный тип промоутер ) с другими ES-ассоциированными генами (ESAG), из которых рецептор трансферрина (Tfr: ESAG6, ESAG7) один. Одновременно экспрессируется только один ген VSG, так как в клетке активен только один из ~ 15 ES. Выражение VSG "переключается" на гомологичная рекомбинация молчащего гена основной копии из массива (направленного гомологией) в активный теломерно расположенный сайт экспрессии.[2] Гены VSG мозаики могут быть созданы путем гомологичной рекомбинации частичного гена VSG из массива. Этот частичный ген может заменить любую часть постоянного гена VSG, создавая новый мозаичный VSG.
В Trypanosoma brucei
В Trypanosoma brucei, поверхность ячейки покрыта плотным слоем ~ 5 x 106 VSG димеры,[3] ~ 90% всего белка клеточной поверхности. Он также составляет ~ 10% от общего клеточного белка.
Свойства покрытия VSG, обеспечивающие уклонение от иммунитета, следующие:
- Экранирование - плотный характер оболочки VSG (белки VSG упаковываются плечом к плечу) предотвращает доступ иммунной системы млекопитающего к плазматическая мембрана или любая другая паразитно инвариантная поверхность эпитопы (Такие как ионные каналы, транспортеры, рецепторы так далее.). Покрытие однородное, состоит из миллионов копий одной и той же молекулы; следовательно, VSG - единственная часть трипаносомы, которую может распознать иммунная система.[4]
- Периодический антигенная вариация - шерсть VSG подвергается частой стохастический генетическая модификация - «переключение» - позволяющая вариантам, выражающим новую оболочку VSG, избежать специфический иммунный ответ поднял против предыдущего пальто. Эта антигенная вариация создает циклические волны паразитемии, характерные для африканского трипаносомоза человека.[5]
- «Очистка» антигена и рециркуляция VSG - VSG эффективно рециркулируется через жгутиковый карман трипаносомы, позволяя антителам «очищаться» от VSG перед повторным включением обратно в клеточную мембрану. Важно отметить, что VSGs, распознаваемые и связываемые антителами, выборочно проталкиваются к карману жгутика с большей скоростью, чем неидентифицированные VSG; в этом сценарии антитело действует как «парус», который ускоряет процесс доставки VSG в зону переработки.[6]
VSG из Т. brucei прикрепляются к плазматической мембране посредством ковалентного присоединения к двум гликозил-фосфатидилинозитол (GPI) анкеры (по одному на мономер ),[7] который направляет его прямое движение от ER к карману жгутика для включения в мембрану, как предсказано гипотезой валентности GPI.[8][9]
VSG заменяются одинаково плотным слоем проциклины когда паразит дифференцируется в проциклическую форму в муха цеце средняя кишка. При понижении температуры происходит очень быстрое подавление транскрипции гена VSG.[10]
Выражение
Источником изменчивости VSG во время заражения является большой «архив» VSG гены, присутствующие в Т. brucei геном. Некоторые из них полноразмерные, нетронутые гены; другие псевдогены (обычно с мутации сдвига рамки считывания, преждевременный стоп-кодоны, или фрагментация).[11] Экспрессия антигенно отличного VSG может происходить путем простого переключения на другой полноразмерный VSG ген путем переключения сайта экспрессии (переключение которого активен). Кроме того, химерный или "мозаика" VSG гены могут быть созданы путем объединения сегментов более чем одного молчащего VSG ген. Формирование мозаики VSGs позволяет (частичное) выражение псевдогена VSGs, которые могут составлять основную часть VSG архив и может непосредственно способствовать антигенной изменчивости, значительно увеличивая способность трипаносомы к уклонению от иммунитета и создавая серьезную проблему для вакцина разработка.[12]
VSG гены можно сохранить тихий и включается в любой момент. Выраженные VSG всегда находится на сайте выражений (ES), которые являются специализированным выражением места найдено в теломеры некоторых больших и промежуточных хромосом. Каждый ES представляет собой полицистронную единицу, содержащую ряд генов, ассоциированных с сайтами экспрессии (ESAG), все экспрессируемые вместе с активным VSG. Хотя существует несколько ES, единовременно может быть активна только одна. В этом процессе, по-видимому, задействован ряд механизмов, но точная природа молчания все еще неясна.[13]
Экспрессированный VSG можно переключить либо путем активации другого сайта экспрессии (и, таким образом, изменения для экспрессии VSG на этом сайте) или изменив VSG ген активного сайта к другому варианту. Геном содержит множество копий генов VSG как на минихромосомах, так и в повторяющихся участках внутри хромосом. Как правило, они молчащие, обычно с пропущенными секциями или преждевременными стоп-кодонами, но они важны в эволюции новых генов VSG. По оценкам, до 10% от T.brucei геном может состоять из генов VSG или псевдогены. Любой из этих генов можно переместить в активный сайт с помощью рекомбинация для выражения. Опять же, точные механизмы, которые контролируют это, неясны, но процесс, похоже, зависит от Ремонт ДНК машины и процесс гомологичная рекомбинация.[14]
Сайт экспрессии кровотока (BES), или сайт экспрессии теломера, используется для обмена вариантов поверхностных гликопротеинов, когда они находятся в кровотоке хозяина, чтобы избежать система комплемента. BES полиморфны по размеру и структуре, но обнаруживают удивительно консервативную архитектуру в контексте обширной рекомбинации. Существуют очень маленькие BES, и многие функционирующие BES не содержат полного набора гены, связанные с сайтом экспрессии (ESAG).[15] Существует около 20-30 сайтов, каждый из которых активен одновременно.[16] Активные сайты экспрессии VSG истощены нуклеосомы.[17]
Репертуар генов в Т. brucei разошлись, чтобы стать штаммами.[18]
Вариант генов поверхностных гликопротеинов Т. brucei были разделены на две группы в зависимости от того, наблюдается ли дупликация генов при их экспрессии.[19]

Секреторная торговля
Трипаносома имеют простую, поляризованную мембранную транспортную систему, состоящую из одного ER, лизосома, и аппарат Гольджи.
VSG сначала транскрибируется как полицистрон, а затем подвергается специфической для трипаносоматиды полиаденилирование и транс-сплайсинг режиссер полипиримидиновые тракты. Поскольку нет транскрипционного контроля, VSG 3'UTR важен для стабильности его РНК (в первую очередь, 8-мерного и 14-мерного). Затем VSG транскрибируется на мембраносвязанном полисомы, а появление N-концевой сигнальной последовательности направляет VSG в ER. Таким образом, VSG ко-трансляционно транспортируется в просвет ER быстро. N-гликозилированный (на сайтах asn-x-ser / thr) и GPI закреплен на узле ω трансаминирование реакция (удаление С-члена гидрофобной 17- или 23-аминокислотной закрепляющей последовательности GPI). Сайт ω всегда представляет собой Ser (обычно в пептидах сигнальной последовательности из 17 аминокислот), Asp (обычно в пептидах сигнальной последовательности из 23 аминокислот) или Asn. Также количество N-гликозилирование сайты на VSG могут различаться (обычно 1-3 N-гликана). VSG MITat.1.5 гликозилирован по всем трем потенциальным сайтам N-гликозилирования.[20]
VSG затем проходит кальретикулин /калнексин цикл сворачивания (калнексин отсутствует в Trypanosoma brucei), где он временно моноглюкозилирован и деглюкозилирован, и взаимодействует с различными белками-шаперонами ER, такими как BiP, для правильной укладки. VSG эффективно сворачивается и димеризуется (что указывает на благоприятное сворачивание) и транспортируется через Гольджи в карман жгутика для включения в клеточную мембрану.
Важно отметить, что после включения в клеточную мембрану VSG может позже рециклироваться через карман жгутика и сортироваться обратно на поверхность клетки. VSG не превращается лизосомными или протеасомными путями канонической деградации,[21] но вместо этого теряется из клетки в результате специфического расщепления ее якоря GPI специфическим для GPI ПЛК.
Структура
Гены VSG сильно различаются последовательность (первичный) уровень, но варианты считаются сильно законсервированными структурный (третичные) особенности, основанные на двух определенных трехмерных структурах[22] и сохранение мотивов двумерных последовательностей (нисходящих и восходящих альфа-спиралей, которые составляют интерфейс димеризации), что позволяет им выполнять аналогичную функцию экранирования.[23] VSG состоят из N терминал домен около 300-350 аминокислоты с низкой гомологией последовательностей (идентичность 13-30%) и более консервативной Терминал C домен из ~ 100 аминокислот. N-концевые домены сгруппированы в классы A-C в зависимости от их цистеиновых паттернов. Домены C-термов сгруппированы по гомологии последовательностей в классы I-III, без каких-либо ограничений на то, с какими классами N-термов они могут соединяться для формирования полного VSG. Чтобы димеризоваться, N-концевые домены VSG образуют пучок из четырех альфа спирали направляется гидрофобными взаимодействиями, вокруг которых висят более мелкие структурные элементы (пять меньших спиралей и три бета-листа).
VSG прикреплен к клеточной мембране через якорь гликофосфатидилинозитола (GPI) - нековалентная связь от С-конца, которая направляет его прямой транспорт от ER к мембране. Этот GPI-якорь специфически расщепляется GPI-фосфолипазой C, расщепляя VSG в виде мембраны и позволяя белку VSG и части GPI-якоря теряться во внеклеточной среде в виде растворимого VSG (sVSG, который можно распознать как перекрестно реагирующий). Детерминант, или CRD), сохраняя при этом две цепи 1,2-димиристолглицерина в мембране.
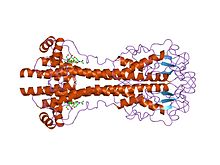
Антигенная вариация
VSG очень иммуногенный, и иммунная реакция поднятый против специфической оболочки VSG, быстро убивает трипаносомы, экспрессирующие этот вариант. Антитела -опосредованное убийство трипаносом также может наблюдаться in vitro по комплемент-опосредованный лизис проба. Однако с каждым деление клеток есть вероятность, что один или оба потомство переключит выражение, чтобы изменить выражаемый VSG. Измеренная частота переключения VSG составляет примерно 0,1% на деление,[24] хотя частота переключения действительно различается в зависимости от культуры и культуры. in vivo. В качестве Т. brucei численность населения может достигать 1011 внутри хоста[25] такая высокая скорость переключения гарантирует, что популяция паразитов постоянно разнообразна. Разнообразие оболочек, выраженных популяцией трипаносом, означает, что иммунная система всегда на шаг отстает: для развития иммунного ответа против данного VSG требуется несколько дней, что дает популяции время для диверсификации, поскольку люди подвергаются дальнейшим событиям переключения. Повторение этого процесса предотвращает исчезновение инфицированной популяции трипаносом, обеспечивая хроническое сохранение паразитов в организме хозяина, увеличивая возможности для передачи. Клинический эффект этого цикла - последовательные «волны» паразитемии (трипаносомы в крови).[3]
В других трипаносомах
Гликопротеины с переменной поверхностью также встречаются в других Трипаносома разновидность,
В Trypanosoma equiperdum, паразит, вызывающий прикрытие болезни у лошадей эти белки позволяют паразиту эффективно уклоняться от иммунной системы животного-хозяина.[26] Эти VSG позволяют организму постоянно манипулировать и изменять поверхностную структуру своих белков, что означает, что он постоянно представляется иммунной системе как новый чужеродный организм, и это не позволяет организму выработать достаточно сильный иммунный ответ, чтобы искоренить болезнь.[26] В этом смысле, Trypanosoma equiperdum очень работоспособный организм; он может инфицировать меньшее количество видов, чем другие болезни, но он заражает и выживает очень эффективно в пределах своих определенных хозяев. Белки VSG в T. equiperdum являются также фосфорилированный.[27]
Ген VSG из Трипаносома эванси, паразит, вызывающий форму Surra у животных, был клонирован в кишечная палочка. Экспрессированный белок иммунореактивный со всеми комбинациями SERA. Животные, иммунизированные цельноклеточным лизатом или рекомбинантным белком, демонстрируют аналогичные реакции антител в ELISA (Иммуноферментный анализ) и CATT (карточный тест на агглютинацию на трипаносомоз ).[28] Гликопротеин с переменной поверхностью RoTat 1.2 ПЦР может использоваться как специфический диагностический инструмент для обнаружения Т. эванси инфекции.[29]
Наименьший белок VSG (размером 40 кДа) на сегодняшний день (1996 г.) был обнаружен в Trypanosoma vivax, который содержит мало углеводов.[30]
В Трипаносома конголенская, in vitro анализ включенных сахаров после гидролиза гликопротеина показал, что глюкозамин и манноза используются в биосинтезе углеводной части непосредственно, тогда как галактоза, возможно, превращалась в другие промежуточные продукты перед включением в антиген. Негликозилированный VSG с молекулярной массой 47 кДа полностью утратил свою размерную гетерогенность.[31]
Смотрите также
- Белок оболочки (значения)
- Гликокаликс
- Список кодов MeSH (D23)
- Список кодов MeSH (D12.776.395)
- Список кодов MeSH (D12.776.543)
- Амастин, другой поверхностный (трансмембранный) гликопротеин у трипаносоматидных паразитов[32]
Рекомендации
- ^ Кросс GA (1975). «Идентификация, очистка и свойства клон-специфичных гликопротеиновых антигенов, составляющих поверхностную оболочку Trypanosoma brucei». Паразитология. 71 (3): 393–417. Дои:10,1017 / с003118200004717x. PMID 645.
- ^ Бак Г.А., Жакмот С., Бальц Т., Эйзен Х. (декабрь 1984 г.). «Повторная экспрессия гена инактивированного вариабельного поверхностного гликопротеина в Trypanosoma equiperdum». Ген. 32 (3): 329–36. Дои:10.1016/0378-1119(84)90008-8. PMID 6530143.
- ^ а б Барри Дж. Д., Маккалок Р. (2001). Антигенная изменчивость в трипаносомах: усиление фенотипической изменчивости у эукариотических паразитов. Достижения в паразитологии. 49. С. 1–70. Дои:10.1016 / S0065-308X (01) 49037-3. ISBN 978-0-12-031749-3. PMID 11461029.
- ^ Overath P, Chaudhri M, Steverding D, Ziegelbauer K (февраль 1994). «Инвариантные поверхностные белки в формах кровотока Trypanosoma brucei». Паразитология сегодня. 10 (2): 53–8. Дои:10.1016 / 0169-4758 (94) 90393-X. PMID 15275499.
- ^ Росс Р., Томсон Д. (июнь 1910 г.). "Случай сонной болезни, показывающий регулярное периодическое увеличение числа выявленных паразитов". Британский медицинский журнал. 1 (2582): 1544–5. Дои:10.1136 / bmj.1.2582.1544. ЧВК 2331906. PMID 20765166.
- ^ Руденко Г (2011-10-24). «Африканские трипаносомы: геном и приспособления для уклонения от иммунитета». Очерки биохимии. 51: 47–62. Дои:10.1042 / bse0510047. PMID 22023441.
- ^ Возьмите DJ, Verjee Y. «Локализация переменной поверхностной гликопротеин-фосфатидилинозитол-специфической фосфолипазы-C в Trypanosoma brucei brucei». Депозитарий корпоративных документов ФАО. Продовольственная и сельскохозяйственная организация Объединенных Наций.
- ^ Triggs VP, Bangs JD (февраль 2003 г.). «Гликозилфосфатидилинозитол-зависимый перенос белков на стадии кровотока Trypanosoma brucei». Эукариотическая клетка. 2 (1): 76–83. Дои:10.1128 / ec.2.1.76-83.2003. ЧВК 141176. PMID 12582124.
- ^ Шварц KJ, Пек RF, Tazeh NN, Bangs JD (декабрь 2005 г.). «Валентность GPI и судьба белков секреторной мембраны в африканских трипаносомах». Журнал клеточной науки. 118 (Pt 23): 5499–511. Дои:10.1242 / jcs.02667. PMID 16291721.
- ^ Pays E, Coquelet H, Pays A, Tebabi P, Steinert M (сентябрь 1989 г.). «Trypanosoma brucei: посттранскрипционный контроль сайта экспрессии гена вариабельного поверхностного гликопротеина». Молекулярная и клеточная биология. 9 (9): 4018–21. Дои:10.1128 / mcb.9.9.4018. ЧВК 362464. PMID 2779574.
- ^ Марчелло Л., Барри Д. Д. (сентябрь 2007 г.). «Анализ архива молчания гена VSG у Trypanosoma brucei показывает, что мозаичная экспрессия генов является важной в антигенной вариации и поддерживается субструктурой архива». Геномные исследования. 17 (9): 1344–52. Дои:10.1101 / гр.6421207. ЧВК 1950903. PMID 17652423.
- ^ Барбур А.Г., Рестрепо Б.И. (2000). «Антигенная изменчивость трансмиссивных патогенов». Возникающие инфекционные заболевания. 6 (5): 449–57. Дои:10.3201 / eid0605.000502. ЧВК 2627965. PMID 10998374.
- ^ Платит E (ноябрь 2005 г.). «Регулирование экспрессии гена антигена в Trypanosoma brucei». Тенденции в паразитологии. 21 (11): 517–20. Дои:10.1016 / j.pt.2005.08.016. PMID 16126458.
- ^ Моррисон Л.Дж., Марчелло Л., Маккалок Р. (декабрь 2009 г.). «Антигенная изменчивость африканской трипаносомы: молекулярные механизмы и фенотипическая сложность» (PDF). Клеточная микробиология. 11 (12): 1724–34. Дои:10.1111 / j.1462-5822.2009.01383.x. PMID 19751359.
- ^ Герц-Фаулер К., Фигейредо Л.М., Перепел М.А., Беккер М., Джексон А., Бейсон Н., Брукс К., Черчер К., Фахкро С., Гудхед I, Хит П., Картвелишвили М., Мунгалл К., Харрис Д., Хаузер Х., Сандерс М., Сондерс Д., Сигер К., Шарп С., Тейлор Дж. Э., Уокер Д., Уайт Б., Янг Р., Кросс Г. А., Руденко Г., Барри Дж. Д., Луи Э. Дж., Берриман М. (2008). «Сайты теломерной экспрессии высоко консервативны у Trypanosoma brucei». PLOS One. 3 (10): e3527. Bibcode:2008PLoSO ... 3.3527H. Дои:10.1371 / journal.pone.0003527. ЧВК 2567434. PMID 18953401.
- ^ Vanhamme L, Lecordier L, Pays E (май 2001 г.). «Контроль и функция участков экспрессии поверхностных гликопротеинов вариантов кровотока в Trypanosoma brucei». Международный журнал паразитологии. 31 (5–6): 523–31. Дои:10.1016 / S0020-7519 (01) 00143-6. PMID 11334937.
- ^ Станне Т.М., Руденко Г. (январь 2010). «Активные сайты экспрессии VSG в Trypanosoma brucei лишены нуклеосом». Эукариотическая клетка. 9 (1): 136–47. Дои:10.1128 / EC.00281-09. ЧВК 2805301. PMID 19915073.
- ^ Хатчинсон О.К., Пикоцци К., Джонс Н.Г., Мотт Х., Шарма Р., Велберн СК, Кэррингтон М. (июль 2007 г.). «Репертуар вариантов гена поверхностного гликопротеина у Trypanosoma brucei разошелся и стал штамм-специфичным». BMC Genomics. 8: 234. Дои:10.1186/1471-2164-8-234. ЧВК 1934917. PMID 17629915.
- ^ Молодой JR, Тернер MJ, Уильямс RO (1984). «Роль дупликации в экспрессии гена вариабельного поверхностного гликопротеина Trypanosoma brucei». Журнал клеточной биохимии. 24 (3): 287–95. Дои:10.1002 / jcb.240240309. PMID 6736139.
- ^ Мелерт А., Bond CS, Ferguson MA (октябрь 2002 г.). «Гликоформы поверхностного гликопротеина варианта Trypanosoma brucei и молекулярное моделирование гликозилированной поверхностной оболочки». Гликобиология. 12 (10): 607–12. Дои:10.1093 / glycob / cwf079. PMID 12244073.
- ^ Тиенгве К., Мураторе К.А., Bangs JD (ноябрь 2016 г.). «Поверхностные белки, ERAD и антигенная изменчивость у Trypanosoma brucei». Клеточная микробиология. 18 (11): 1673–1688. Дои:10,1111 / cmi.12605. ЧВК 5575760. PMID 27110662.
- ^ Фрейманн Д., Даун Дж., Кэррингтон М., Родити И., Тернер М., Уайли Д. (1990). «Структура разрешения 2,9 Å N-концевого домена варианта поверхностного гликопротеина из Trypanosoma brucei». Журнал молекулярной биологии. 216 (1): 141–60. Дои:10.1016 / S0022-2836 (05) 80066-X. PMID 2231728.
- ^ Блюм М.Л., Даун Дж. А., Гурнетт А. М., Кэррингтон М., Тернер М. Дж., Уайли, округ Колумбия (апрель 1993 г.). «Структурный мотив в варианте поверхностных гликопротеинов Trypanosoma brucei». Природа. 362 (6421): 603–9. Bibcode:1993Натура.362..603Б. Дои:10.1038 / 362603a0. PMID 8464512.
- ^ Тернер CM (август 1997 г.). «Скорость антигенной изменчивости при инфекциях, передаваемых мухами и через шприц, Trypanosoma brucei». Письма о микробиологии FEMS. 153 (1): 227–31. Дои:10.1111 / j.1574-6968.1997.tb10486.x. PMID 9252591.
- ^ Barry JD, Hall JP, Plenderleith L (сентябрь 2012 г.). «Гиперэволюция генома и успех паразита». Летопись Нью-Йоркской академии наук. 1267 (1): 11–7. Bibcode:2012НЯСА1267 ... 11Б. Дои:10.1111 / j.1749-6632.2012.06654.x. ЧВК 3467770. PMID 22954210.
- ^ а б Райбо А., Гайяр С., Лонгакр С., Хибнер Ю., Бак Дж., Бернарди Дж., Эйзен Х (июль 1983 г.). «Геномное окружение вариантных генов поверхностного антигена Trypanosoma equiperdum». Труды Национальной академии наук Соединенных Штатов Америки. 80 (14): 4306–10. Bibcode:1983PNAS ... 80.4306R. Дои:10.1073 / pnas.80.14.4306. ЧВК 384026. PMID 6308614.
- ^ Бальц Т., Жиру С., Бальц Д., Дювилье Г., Деган П., Демайль Дж, Паутризель Р. (1982). «Гликопротеины с переменной поверхностью Trypanosoma equiperdum фосфорилированы». Журнал EMBO. 1 (11): 1393–8. Дои:10.1002 / j.1460-2075.1982.tb01328.x. ЧВК 553222. PMID 6821334.
- ^ Сенгупта П.П., Балумахендиран М., Баламуруган В., Рудрамурти Г.Р., Прабхуда К. (июнь 2012 г.). «Экспрессированный усеченный N-концевой гликопротеин вариабельной поверхности (VSG) Trypanosoma evansi в E. coli проявляет иммунореактивность». Ветеринарная паразитология. 187 (1–2): 1–8. Дои:10.1016 / j.vetpar.2012.01.012. PMID 22277627.
- ^ Клас Ф., Радванска М., Уракава Т., Мадзива П.А., Годдирис Б., Бюшер П. (сентябрь 2004 г.). «ПЦР с переменным поверхностным гликопротеином RoTat 1.2 как специфический диагностический инструмент для обнаружения инфекций Trypanosoma evansi». Кинетопластид, биология и болезнь. 3 (1): 3. Дои:10.1186/1475-9292-3-3. ЧВК 521498. PMID 15377385.
- ^ Гардинер П.Р., Нене В., Барри М.М., Татти Р., Берли Б., Кларк М.В. (ноябрь 1996 г.). «Характеристика небольшого гликопротеина с переменной поверхностью из Trypanosoma vivax». Молекулярная и биохимическая паразитология. 82 (1): 1–11. Дои:10.1016/0166-6851(96)02687-4. PMID 8943146.
- ^ Рейнвальд Э., Гейдрих Ц., Рисе Х. Дж. (Май 1984 г.). «Исследования in vitro биосинтеза поверхностного гликопротеина Trypanosoma congolense». Журнал протозоологии. 31 (2): 300–6. Дои:10.1111 / j.1550-7408.1984.tb02966.x. PMID 6470988.
- ^ Джексон А.П. (январь 2010 г.). «Эволюция поверхностных гликопротеинов амастина у трипаносоматидных паразитов». Молекулярная биология и эволюция. 27 (1): 33–45. Дои:10.1093 / молбев / msp214. ЧВК 2794310. PMID 19748930.
внешняя ссылка
- Вариант поверхностных гликопротеинов, трипаносома в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- www.icp.ucl.ac.be
