Многоатомный ион - Polyatomic ion

3). Области, окрашенные в полупрозрачный красный цвет, вокруг самих красных атомов кислорода, обозначают области наиболее отрицательного электростатического потенциала.
А молекулярный ион это ковалентно связанный набор из двух или более атомов или металлический комплекс, который можно рассматривать как единое целое и имеющий сеть обвинять это не ноль. В отличие от молекула, который имеет нулевой чистый заряд, это химические вещества является ион. (Префикс поли- несет в себе греческое значение «многие», но даже ионы двух атомов обычно называют многоатомными.)
В более ранней литературе многоатомный ион может вместо этого называться радикальный (или реже, как радикальная группа). (В современном использовании термин радикальный относится к различным свободные радикалы, которые разновидность которые имеют неспаренный электрон и не нужно заряжать.)
Простым примером многоатомного иона является гидроксид ион, который состоит из одного атома кислорода и одного атома водорода, совместно несущих общий заряд −1; его химическая формула ОЧАС−
. Напротив, аммоний ион состоит из одного атома азота и «четырех» атомов водорода с зарядом +1; его химическая формула NЧАС+
4.
Многоатомные ионы часто используются в контексте кислотно-щелочная химия и в формировании соли.
Часто многоатомный ион можно рассматривать как конъюгированная кислота или основание нейтрального молекула. Например, сопряженное основание из серная кислота (ЧАС2ТАК4) является многоатомным сероводород анион (HSO−
4). Удаление другого ион водорода производит сульфат анион (ТАК2−
4).
Номенклатура многоатомных анионов
Есть два «правила», которые можно использовать для изучения номенклатуры многоатомных анионов. Во-первых, когда префикс би добавляется к имени, водород добавляется к формуле иона, и его заряд увеличивается на 1, последнее является следствием заряда +1 иона водорода. Альтернатива би- приставка состоит в том, чтобы использовать вместо него слово водород: анион, производный от ЧАС+
+ CO2−
3, HCO−
3, можно назвать бикарбонатом или гидрокарбонатом.
Большинство обычных многоатомных анионов оксианионы, сопряженные основания оксикислоты (кислоты, полученные из оксиды из неметаллические элементы ). Например, сульфат анион, SО2−
4, происходит от ЧАС
2ТАК
4, который можно рассматривать как ТАК
3 + ЧАС
2О.
Второе правило смотрит на количество атомов кислорода в ионе. Рассмотрим хлор оксианион семья:
| степень окисления | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| имя аниона | хлористый | гипохлорит | хлорит | хлорат | перхлорат |
| формула | Cl− | ClO− | ClO− 2 | ClO− 3 | ClO− 4 |
| структура |  |  | 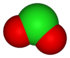 |  |  |
Во-первых, подумайте о -съел ion как "базовое" имя, и в этом случае добавление за- приставка добавляет кислород. Изменение -съел суффикс к -ite уменьшит количество кислорода на единицу, сохраняя суффикс -ite и добавив префикс гипо- снижает количество кислорода еще на один. Во всех ситуациях на зарядку не влияет. Шаблон именования следует во многих различных оксианионных сериях на основе стандартного корня для этой конкретной серии. В -ite имеет на один кислород меньше, чем -съел, но разные -съел анионы могут иметь разное количество атомов кислорода.
Эти правила не работают со всеми многоатомными анионами, но они работают с наиболее распространенными. В следующей таблице приведены примеры некоторых из этих распространенных анионных групп.
| бромид | гипобромит | бромит | бромат | пербромат |
| Br− | Братан− | Братан− 2 | Братан− 3 | Братан− 4 |
| Йодид | Гипойодит | Йодит | Йодат | периодировать |
| я− | IO− | IO− 2 | IO− 3 | IO− 4 или же IO5− 6 |
| сульфид | гипосульфит | сульфит | сульфат | персульфат |
| S2− | S 2О2− 2 | ТАК2− 3 | ТАК2− 4 | ТАК2− 5 |
| селенид | гипоселенит | селенит | селенат | |
| Se2− | Se 2О2− 2 | SeO2− 3 | SeO2− 4 | |
| теллурид | гипотеллурит | теллурит | теллурировать | |
| Te2− | TeO2− 2 | TeO2− 3 | TeO2− 4 | |
| нитрид | гипонитрит | нитрит | нитрат | |
| N3− | N 2О2− 2 | НЕТ− 2 | НЕТ− 3 | |
| фосфид | гипофосфит | фосфит | фосфат | перфосфат |
| п3− | ЧАС 2PO− 2 | PO3− 3 | PO3− 4 | PO3− 5 |
| арсенид | гипоарсенит | арсенит | арсенат | |
| В качестве3− | AsO3− 2 | AsO3− 3 | AsO3− 4 |
Другие примеры общих многоатомных ионов
В следующих таблицах приведены дополнительные примеры часто встречающихся многоатомных ионов. Приведены лишь несколько представителей, так как количество встречающихся на практике многоатомных ионов очень велико.
| Тетрагидроксиборат | В (ОН)− 4 |
| Ацетилид | C2− 2 |
| Этоксид или этанолат | C 2ЧАС 5О− |
| Ацетат или этаноат | CH 3COO− или же C 2ЧАС 3О− 2 |
| Бензоат | C 6ЧАС 5COO− или же C 7ЧАС 5О− 2 |
| Цитрат | C 6ЧАС 5О3− 7 |
| Карбонат | CO2− 3 |
| Оксалат | C 2О2− 4 |
| Цианид | CN− |
| Хромат | CrO2− 4 |
| Дихромат | Cr 2О2− 7 |
| Бикарбонат или гидрокарбонат | HCO− 3 |
| Фосфат водорода | HPO2− 4 |
| Дигидрофосфат | ЧАС 2PO− 4 |
| Сероводород или бисульфат | HSO− 4 |
| Манганат | MnO2− 4 |
| Перманганат | MnO− 4 |
| Азанид или амид | NH− 2 |
| Перекись | О2− 2 |
| Гидроксид | ОЙ− |
| Бисульфид | SH− |
| Тиоцианат | SCN− |
| Силикат | SiO2− 4 |
| Тиосульфат | S 2О2− 3 |
| Ионы ония | Ионы карбения | Другие | |||
|---|---|---|---|---|---|
| Гуанидиний | C (NH 2)+ 3 | Тропилий | C 7ЧАС+ 7 | Меркурий (I) | Hg2+ 2 |
| Аммоний | NH+ 4 | Трифенилкарбений | (C 6ЧАС 5) 3C+ | ||
| Фосфоний | PH+ 4 | циклопропений | C 3ЧАС+ 3 | ||
| Гидроний | ЧАС 3О+ | ||||
| Флуороний | ЧАС 2F+ | ||||
| Пирилий | C 5ЧАС 5О+ | ||||
