Изофорон - Isophorone
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 3,5,5-триметилциклогекс-2-ен-1-он | |
| Другие имена 3,5,5-триметил-2-циклогексен-1-он 1,1,3-триметил-3-циклогексен-5-он Изофорон Изоацетофорон IP | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.001.024 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C9ЧАС14О | |
| Молярная масса | 138.210 г · моль−1 |
| Внешность | От бесцветной до белой жидкости |
| Запах | Как мята[2] |
| Плотность | 0,9255 г / см3 |
| Температура плавления | -8,1 ° С (17,4 ° F, 265,0 К) |
| Точка кипения | 215,32 ° С (419,58 ° F, 488,47 К) |
| 1,2 г / 100 мл | |
| Растворимость | эфир, ацетон, гексан, дихлорметан, бензол, толуол, алкоголь |
| Давление газа | 0,3 мм рт. Ст. (20 ° C)[2] |
| 1.4766 | |
| Вязкость | 2,62 сП |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 43,4 кДж / моль |
| Опасности | |
| точка возгорания | 84 ° С (183 ° F, 357 К) |
| 460 ° С (860 ° F, 733 К) | |
| Пределы взрываемости | 0.8–3.8%[2] |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 2280 мг / кг (крыса, перорально)[нужна цитата ] 2330 мг / кг (крыса, перорально) 2690 мг / кг (мышь, перорально)[3] |
LC50 (средняя концентрация ) | 4600 частей на миллион (морская свинка, 8 часов)[3] |
LCLo (самый низкий опубликованный ) | 885 частей на миллион (крыса, 6 часов) 1840 частей на миллион (крыса, 4 часа)[3] |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 25 частей на миллион (140 мг / м3)[2] |
REL (Рекомендуемые) | TWA 4 частей на миллион (23 мг / м3)[2] |
IDLH (Непосредственная опасность) | 200 частей на миллион[2] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Изофорон является α, β-ненасыщенный циклический кетон. Это бесцветная жидкость с характерным запахом мяты, хотя коммерческие образцы могут иметь желтоватый оттенок. Используется как растворитель и как предшественник полимеров, он производится в промышленных масштабах.[4]
Структура и реакционная способность
Изофорон вступает в реакции, характерные для α, β-ненасыщенного кетона. Гидрирование дает производное циклогексанона. Эпоксидирование с основным пероксид водорода дает оксид.[5]
Изофорон разлагается под действием гидроксильные радикалы.[6]
Фотодимеризация
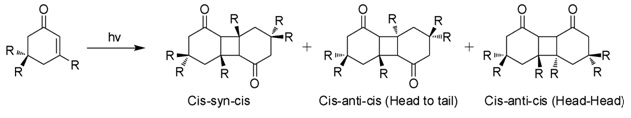
При воздействии солнечных лучей в водных растворах изофорон подвергается 2 + 2 фотоциклоприсоединение дать три изомерных фотодимера (рисунок). Эти «дикетомеры» представляют собой цис-син-цис, «голова к хвосту» (HT), цис-анти-цис (HT) и голова-голова (HH). Образование фотодимеров HH предпочтительнее фотодимеров HT с увеличением полярности среды.[7]
Естественное происхождение
Изофорон естественным образом встречается в клюква. [8]
Синтез
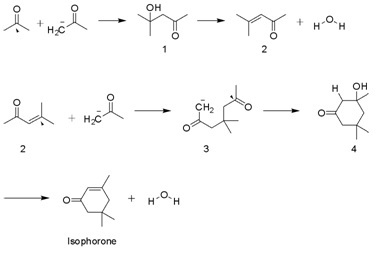
Изофорон производится в многотысячных тоннах. альдольная конденсация из ацетон с использованием КОН. Диацетоновый спирт, оксид мезитила, и 3-гидрокси-3,5,5-триметилциклогексан-1-он являются промежуточными соединениями. Побочный продукт бета-изофорон, где группа C = C не сопряжена с кетоном.[4]
Приложения
Частично гидрированное производное триметилциклогексанона используется в производстве поликарбонаты. Конденсируется с фенолом, образуя аналог бисфенол А. Поликарбонаты, полученные фосгенированием этих двух диолов, дают полимер с улучшенной термической стабильностью.[9] Триметиладипиновая кислота и 2,2,4-триметилгексаметилендиамин производятся из триметилциклогексанона и триметилциклогексанола. Их используют для изготовления фирменных блюд. полиамиды. Гидроцианирование дает нитрил с последующим восстановительным аминированием дает изофорон диамин. Этот диамин используется для производства изофорондиизоцианат который имеет определенные нишевые приложения.[4]

Полное гидрирование дает 3,3,5-триметилциклогексанол, предшественник как солнцезащитных кремов, так и химического оружия.
Безопасность
Значение LD50 изофорона у крыс и кроликов при пероральном воздействии составляет около 2,00 г / кг.[10] Аспекты безопасности изофорона были предметом нескольких исследований.[11]
История
Использование изофорона в качестве растворителя стало результатом поиска способов утилизации или переработки ацетон, который является отходом фенол синтез Скакательный метод.[12]
Смотрите также
Рекомендации
- ^ Индекс Merck, 13-е издание, 5215.
- ^ а б c d е ж Карманный справочник NIOSH по химической опасности. "#0355". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c «Изофорон». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c Хардо Сигель, Манфред Эггерсдорфер (2005). «Кетоны». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a15_077. ISBN 9783527306732.CS1 maint: использует параметр авторов (связь)
- ^ Ричард Л. Уоссон, Герберт О. Хаус (1957). «Оксид изофорона». Орг. Синтезатор. 37: 58. Дои:10.15227 / orgsyn.037.0058.CS1 maint: использует параметр авторов (связь)
- ^ «ТОКСНЕТ». toxnet.nlm.nih.gov. Архивировано из оригинал на 2017-10-24. Получено 2016-03-11.
- ^ Гонсалвес, Угетт; Робине, Жермен; Бартелат, Мишель; Латте, Арман (1998-01-28). «Супрамолекулярность и фотодимеризация изофорона: FTIR и молекулярно-механические исследования». Журнал физической химии A. 102 (8): 1279–1287. Дои:10.1021 / jp9729270.
- ^ [1]
- ^ Фолькер Серини (2000). «Поликарбонаты». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a21_207. ISBN 978-3527306732.CS1 maint: использует параметр авторов (связь)
- ^ «Эффекты токсичности». tools.niehs.nih.gov. Получено 2016-03-11.
- ^ В. Мортон Грант, Джоэл С. Шуман, доктор медицины (11 февраля 2016 г.). «Токсикология глаза: воздействие на глаза и зрительную систему химических веществ, лекарств, металлов и минералов, растений, токсинов и ядов; также системные побочные эффекты от глаз». Med (набор из 2 томов) 4-е издание, стр. 863.
- ^ История изофорона в Degussa
