Электролиз воды - Electrolysis of water


Электролиз воды это процесс использования электричества для разлагать воду в кислород и водород газ. Выделяемый таким образом водород можно использовать в качестве водородное топливо, или ремикс с кислород создавать кислородно-водород газ, который используется при сварке и других применениях.
Иногда называется расщепление воды, электролиз требует минимум разность потенциалов из 1,23 вольт.
История
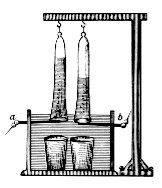
Ян Рудольф Дейман и Адриан Паэтс ван Троствейк использовали в 1789 году электростатическую машину для производства электричества, которое разряжалось на золотых электродах в лейденская банка с водой.[1] В 1800 г. Алессандро Вольта изобрел гальваническая свая, а несколько недель спустя английские ученые Уильям Николсон и Энтони Карлайл использовал его для электролиза воды. В 1806 г. Хэмфри Дэви сообщил о результатах обширных экспериментов по электролизу дистиллированной воды, сделав вывод, что азотная кислота был получен на аноде из растворенного атмосферного азота. Он использовал высоковольтную батарею и нереактивные электроды и сосуды, такие как конусы золотых электродов, которые дублировались как сосуды, перекрытые влажным асбестом.[2] Когда Зеноб Грамм изобрел Грамм машина в 1869 г. электролиз воды стал дешевым методом производства водорода. Метод промышленного синтеза водорода и кислорода электролизом был разработан Дмитрий Лачинов в 1888 г.[3]
Принцип
Источник питания постоянного тока подключается к двум электроды, или две пластины (обычно из инертного металла, например платина или же иридий ), которые помещены в воду. Водород появится в катод (куда электроны войти в воду), и кислород появится на анод.[4] Предполагая идеальный фарадеевская эффективность, то количество производимого водорода вдвое превышает количество кислорода, и оба пропорциональный в целом электрический заряд проведено решением.[5] Однако во многих клетках конкурирующие побочные реакции возникают, что приводит к разным продуктам и менее идеальной фарадеевской эффективности.
Электролиз из чистый вода требует избыточной энергии в виде перенапряжение преодолевать различные активационные барьеры. Без избыточной энергии электролиз чистый вода возникает очень медленно или совсем не происходит. Отчасти это связано с ограниченным самоионизация воды. Чистая вода имеет электрическая проводимость примерно в одну миллионную часть морской воды. Много электролитические ячейки может также не хватать необходимого электрокатализаторы. Эффективность электролиза увеличивается за счет добавления электролит (например, соль, кислота или основание ) и использование электрокатализаторы.
В настоящее время электролитический процесс редко используется в промышленности, так как водород в настоящее время может быть более доступным для производства из ископаемое топливо.[6]
Уравнения

В чистой воде на отрицательно заряженном катоде a снижение происходит реакция с электронами (e−) с катода передается катионам водорода с образованием газообразного водорода. В половина реакции в балансе с кислотой:
На положительно заряженном аноде окисление происходит реакция, генерируя газообразный кислород и отдавая электроны аноду, замыкая цепь:
- Окисление на аноде: 2 ч2O (л ) → O2(грамм) + 4 H+(водный) + 4e−
Те же полуреакции также могут быть уравновешены основанием, указанным ниже. Не все полуреакции необходимо уравновешивать кислотой или основанием. Многие из них, например, окисление или восстановление воды, перечисленные здесь. Чтобы добавить половину реакции, обе они должны быть сбалансированы кислотой или основанием. Кислотно-сбалансированные реакции преобладают в кислых (с низким pH) растворах, тогда как реакции со сбалансированным основанием преобладают в основных (с высоким pH) растворах.
| Катод (восстановление): | 2 ч2O (л) + 2e− | → | ЧАС2(грамм) + 2 ОН−(водный) |
| Анод (окисление): | 2 ОН−(водный) | → | 1/2 O2(грамм) + H2O (л) + 2 e− |
Объединение любой пары половин реакции приводит к одинаковому общему разложению воды на кислород и водород:
- Общая реакция: 2 ч.2O (л) → 2 H2(грамм) + O2(грамм)
Таким образом, количество образующихся молекул водорода в два раза превышает количество молекул кислорода. Если предположить, что температура и давление для обоих газов одинаковы, полученный газообразный водород, следовательно, в два раза превышает объем произведенного газообразного кислорода. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза больше количества генерируемых молекул кислорода.
Термодинамика
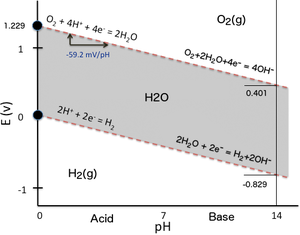
Разложение чистой воды на водород и кислород при стандартная температура и давление не благоприятен в термодинамический термины.
| Анод (окисление): | 2 ч2O (л) | → | О2(грамм) + 4 H+(водный) + 4e− | Eо = +1,23 В (для полууравнения приведения)[7] | |
| Катод (восстановление): | 2 ч+(водный) + 2e− | → | ЧАС2(грамм) | Eо = 0,00 В |
Таким образом, стандартный потенциал водной электролизной ячейки (Eоклетка = Eокатод - Eоанод) составляет -1,229 В при 25 ° C и pH 0 ([H+] = 1,0 млн). При 25 ° C и pH 7 ([H+] = 1.0×10−7 M) потенциал не меняется в зависимости от Уравнение Нернста. Термодинамический стандартный потенциал ячейки может быть получен из расчетов свободной энергии в стандартном состоянии, чтобы найти ΔG °, а затем с помощью уравнения: ΔG ° = −n F E ° (где E ° - потенциал ячейки, а F - Постоянная Фарадея, я. е. 96,485,3321233 С / моль). Для двух электролизованных молекул воды и, следовательно, образования двух молекул водорода n = 4, и ΔG ° = 474,48 кДж / 2 моль (вода) = 237,24 кДж / моль (вода). Однако расчеты потенциалов равновесия отдельных электродов требуют некоторых корректировок с учетом коэффициентов активности.[8] На практике, когда электрохимическую ячейку «доводят» до завершения путем приложения разумного потенциала, она контролируется кинетически. Следовательно, энергия активации, подвижность (диффузия) и концентрация ионов, сопротивление проволоки, поверхностное препятствие, включая образование пузырьков (вызывает закупорку площади электрода) и энтропия, требуют большего приложенного потенциала для преодоления этих факторов. Величина требуемого увеличения потенциала называется перенапряжение.
Выбор электролита

Если описанные выше процессы происходят в чистой воде, H+ катионы будет потребляться / уменьшаться на катоде и ОН− анионы будет потребляться / окисляться на аноде. Это можно проверить, добавив индикатор pH к воде: вода возле катода является щелочной, а вода около анода - кислой. Отрицательные ионы гидроксида, подходящие к аноду, в основном объединяются с положительными ионами гидроксония (H3О+) для образования воды. Положительные ионы гидроксония, которые приближаются к катоду, в основном объединяются с отрицательными ионами гидроксида с образованием воды. Относительно небольшое количество ионов гидроксония / гидроксида достигает катода / анода. Это может вызвать перенапряжение на обоих электродах.
Чистая вода - довольно хороший изолятор, так как у нее низкий автоионизация, Кш = 1.0×10−14 при комнатной температуре и, следовательно, чистая вода плохо проводит ток, 0,055 мкСм · см−1.[9] Если не применяется очень большой потенциал, вызывающий увеличение автоионизации воды, электролиз чистой воды протекает очень медленно, ограничиваясь общей проводимостью.
При добавлении водорастворимого электролита проводимость воды значительно возрастает. Электролит распадается на катионы и анионы; анионы устремляются к аноду и нейтрализуют накопление положительно заряженного H+ там; аналогично катионы устремляются к катоду и нейтрализуют накопление отрицательно заряженного OH.− там. Это обеспечивает непрерывный поток электричества.[10]
Электролит для электролиза воды
При выборе электролита необходимо проявлять осторожность, поскольку анион электролита конкурирует с ионами гидроксида, чтобы отказаться от электрон. Анион электролита с меньшим стандартный электродный потенциал чем гидроксид будет окисляться вместо гидроксида, и газообразный кислород не будет образовываться. А катион с большим стандартный электродный потенциал чем вместо этого будет восстановлен ион водорода, и газообразный водород не будет производиться.
Следующее катионы иметь более низкий электродный потенциал чем H+ и поэтому подходят для использования в качестве катионов электролитов: Ли+, Руб.+, K+, CS+, Ба2+, Sr2+, Ca2+, Na+, и Mg2+. Натрий и литий часто используются, так как они образуют недорогие растворимые соли.
Если кислота в качестве электролита используется катион H+, а у H+ создается разделением воды. Наиболее часто используемый анион - это сульфат (ТАК2−
4), так как он очень трудно окисляется, со стандартным потенциалом окисления этого иона до пероксидисульфат ion +2,010 вольт.[11]
Сильные кислоты, такие как серная кислота (ЧАС2ТАК4) и сильные основания, такие как гидроксид калия (КОН), и едкий натр (NaOH) часто используются в качестве электролитов из-за их сильной проводящей способности.
Также можно использовать твердый полимерный электролит, такой как Нафион и при нанесении специального катализатора на каждую сторону мембраны может эффективно расщеплять молекулу воды всего лишь с 1,5 вольт. Несколько других систем с твердыми электролитами были испытаны и разработаны с несколькими системами электролиза, которые сейчас коммерчески доступны, в которых используются твердые электролиты.[12]
Электролиз чистой воды
Безэлектролитный электролиз чистой воды был достигнут за счет использования нанощели глубокой субдебаевской длины. электрохимические ячейки. Когда зазор между катодом и анодом даже меньше, чем Длина Дебая (1 микрон в чистой воде, около 220 нм в дистиллированной воде), двухслойный области от двух электродов могут перекрываться друг с другом, что приводит к равномерно сильному электрическому полю, распределенному внутри всего зазора. Такое сильное электрическое поле может значительно усилить перенос ионов внутри воды (в основном за счет миграции), дополнительно увеличивая самоионизация воды и поддерживая продолжение всей реакции и показывая небольшое сопротивление между двумя электродами. В этом случае два полуреакции связаны вместе и ограничиваются этапами переноса электрона (ток электролиза насыщается при дальнейшем уменьшении расстояния между электродами).[13]
Методы
Фундаментальная демонстрация
Два ведет, идущие от клемм батареи, помещаются в чашку с водой с таким количеством электролита, чтобы установить проводимость в растворе. Использование NaCl (поваренной соли) в растворе электролита приводит к хлор газ, а не кислород из-за конкурирующая полуреакция. С правильными электродами и правильным электролитом, например пищевой содой (бикарбонат натрия ), водород и кислород будут течь из противоположно заряженных электроды. Кислород будет собираться на положительно заряженном электроде (анод ), а водород будет собираться на отрицательно заряженном электроде (катод ). Обратите внимание, что водород заряжен положительно в H2Молекула O, поэтому она попадает на отрицательный электрод. (И наоборот для кислорода.)
Обратите внимание, что водный раствор воды с ионами хлорида при электролизе приведет к образованию либо ОН− если концентрация Cl− низкий, или в газообразном хлоре, который предпочтительно выделяется, если концентрация Cl− составляет более 25% по массе в растворе.

Вольтаметр Гофмана
Вольтаметр Хофмана часто используется в качестве малогабаритной электролитической ячейки. Он состоит из трех соединенных вертикальных цилиндров. Внутренний цилиндр открыт вверху, что позволяет добавлять воду и электролит. А платина электрод помещается в нижней части каждого из двух боковых цилиндров, подключенных к положительной и отрицательной клеммам источника электричество. Когда ток проходит через вольтаметр Хофмана, газообразный кислород образуется в анод (положительный) и газообразный водород на катод (отрицательный). Каждый газ вытесняет воду и собирают в верхней части два наружных труб, где оно может быть отсасывают с запорным краном.
Промышленное
Многие промышленные электролизеры очень похожи на Вольтаметры Hofmann со сложными платиновыми пластинами или сотами в качестве электродов. Как правило, водород преднамеренно производится электролизом только для конкретной точки использования, например, в случае с кислородно-водород факелы или когда чрезвычайно водород высокой чистоты или кислород желателен. Подавляющее большинство водорода производится из углеводородов и, как следствие, содержит следовые количества монооксид углерода среди других примесей. Примесь окиси углерода может быть вредной для различных систем, включая многие топливные элементы.
Высокое давление
Электролиз под высоким давлением - это электролиз воды с сжатый водород мощность около 12–20 МПа (120–200 Бар, 1740–2900 psi ).[14] Путем повышения давления водорода в электролизере потребность во внешнем водородный компрессор устраняется; средний расход энергии на внутреннее сжатие составляет около 3%.[15]
Высокая температура
Высокотемпературный электролиз (также HTE или паровой электролиз) - это метод, который в настоящее время исследуется для электролиза воды с Тепловой двигатель. Высокотемпературный электролиз может быть предпочтительнее традиционного электролиза при комнатной температуре, потому что часть энергии поставляется в виде тепла, что дешевле, чем электричество, и потому, что реакция электролиза более эффективна при более высоких температурах.[16][17]
Алкалиновая вода
Полимерная электролитная мембрана
Никель / железо
В 2014 году исследователи объявили о системе электролиза, сделанной из недорогих и широко распространенных никеля и железа, а не из катализаторов из драгоценных металлов, таких как платина или иридий. Структура никель-металл / оксид никеля более активна, чем чистый металлический никель или чистый оксид никеля. Катализатор значительно снижает требуемую Напряжение.[18][19] Также никель-железные батареи исследуются для использования в качестве комбинированных батарей и электролизера для производства водорода. Эти «баттолизеры» можно было заряжать и разряжать, как обычные батареи, и они производили бы водород при полной зарядке.[20]
Электрохимические ячейки с нанозазором
В 2017 году исследователи сообщили об использовании нанощели. электрохимические ячейки для достижения высокоэффективного электролиза чистой воды без электролитов при комнатной температуре. В электрохимических ячейках с нанозазором два электрода расположены так близко друг к другу (даже меньше, чем Длина Дебая в чистой воде), что скорость массопереноса может быть даже выше, чем скорость переноса электрона, что приводит к двум полуреакции соединены вместе и ограничены шагом переноса электрона. Эксперименты показывают, что плотность электрического тока при электролизе чистой воды может быть даже больше, чем при 1 моль / л раствора гидроксида натрия. Механизм, «механизм виртуального пробоя», полностью отличается от общепринятой традиционной электрохимической теории из-за такого эффекта размера наноразмеров.[13]
Приложения
Около пяти процентов газообразного водорода, производимого во всем мире, создается путем электролиза. В настоящее время большинство промышленных методов производят водород из натуральный газ вместо этого в паровой риформинг процесс. Большая часть водорода, получаемого при электролизе, является побочным продуктом при производстве хлор и каустическая сода. Это яркий пример соревнуясь за побочную реакцию.
- 2NaCl + 2H2O → Cl2 + H2 + 2NaOH
в хлористо-щелочной процесс (электролиз рассола) смесь вода / хлорид натрия составляет только половину электролиза воды, так как хлористый ионы окисляются до хлор а не окисление воды до кислорода. С термодинамической точки зрения этого не следует ожидать, поскольку окислительный потенциал иона хлорида меньше, чем у воды, но скорость реакции хлорида намного выше, чем у воды, что приводит к ее преобладанию. Водород, полученный в результате этого процесса, либо сжигается (превращается обратно в воду), либо используется для производства специальные химикаты, или различные другие небольшие приложения.
Электролиз воды также используется для получения кислорода для Международная космическая станция.[21][22]
Впоследствии водород можно использовать в топливная ячейка как способ хранения энергии и воды.[23]
Эффективность
Промышленная продукция
Эффективность современных генераторов водорода измеряется энергия, расходуемая на стандартный объем водорода (МДж / м3), предполагая стандартная температура и давление H2. Чем ниже энергия, используемая генератором, тем выше будет его КПД; электролизер со 100% -ным КПД потребляет 39,4 киловатт-часов на килограмм (142 МДж / кг) водород,[24] 12749 джоулей на литр (12,75 МДж / м3). Практический электролиз (с использованием вращающегося электролизера при давлении 15 бар) может потреблять 50 кВт⋅ч / кг (180 МДж / кг) и еще 15 кВт⋅ч (54 МДж), если водород сжимается для использования в водородных автомобилях.[25]
Поставщики электролизеров обеспечивают эффективность на основе энтальпия. Чтобы оценить заявленный КПД электролизера, важно установить, как он был определен поставщиком (то есть какое значение энтальпии, какая плотность тока и т. Д.).
На рынке доступны две основные технологии: щелочной и протонообменная мембрана (PEM) электролизеры. Щелочные электролизеры дешевле с точки зрения капиталовложений (обычно в них используются никелевые катализаторы), но менее эффективны; Электролизеры PEM, наоборот, более дорогие (в них обычно используются дорогие катализаторы на основе металлов платиновой группы), но они более эффективны и могут работать при более высоких плотностях тока и, следовательно, могут быть дешевле, если производство водорода достаточно велико.
Обычный щелочной электролиз имеет эффективность около 70%.[26] С учетом приемлемого использования более высокой теплотворной способности (поскольку неэффективность из-за тепла может быть перенаправлена обратно в систему для создания пара, необходимого для катализатора), средняя эффективность работы для Электролиз ПЭМ составляют около 80%.[27][28] Ожидается, что этот показатель увеличится до 82–86%.[29] до 2030 г. Теоретическая эффективность электролизеров на основе ПЭМ прогнозируется до 94%.[30]

Учитывая промышленное производство водорода и использование лучших в настоящее время процессов электролиза воды (PEM или щелочной электролиз), которые имеют эффективный электрический КПД 70–80%,[31][32][33] производя 1 кг водорода (который имеет удельная энергия 143 МДж / кг) требует 50–55 кВт⋅ч (180–200 МДж) электроэнергии. При стоимости электроэнергии 0,06 долл. США / кВт · ч, как указано в целях производства водорода Министерством энергетики США на 2015 год,[34] стоимость водорода составляет 3 доллара за кг. С диапазоном цен на природный газ с 2016 года, как показано на графике (Дорожная карта технической группы по производству водорода, ноябрь 2017 г. Если говорить о стоимости водорода, подвергнутого конверсии паром в метан (SMR) в диапазоне от 1,20 до 1,50 доллара, то себестоимость водорода путем электролиза по-прежнему превышает вдвое целевые цены на водород DOE на 2015 год. Целевая цена Министерства энергетики США на водород в 2020 году составляет 2,3 доллара США / кг, при этом стоимость электроэнергии составляет 0,037 доллара США / кВт · ч, что является достижимым с учетом тендеров PPA 2018 года.[35] для ветра и солнца во многих регионах. Это ставит 4 доллара за галлон бензина в эквиваленте H2 Раздаваемая цель находится в пределах досягаемости и близка к немного завышенной стоимости добычи природного газа для SMR.
В других частях света цена водорода SMR составляет в среднем 1–3 долл. США / кг. Это делает производство водорода электролизом конкурентоспособным по стоимости уже во многих регионах, как отмечает Nel Hydrogen.[36] и другие, в том числе статью МЭА[37] изучение условий, которые могут привести к конкурентному преимуществу электролиза.
Перенапряжение
Настоящие водные электролизеры требуют более высокого напряжения для протекания реакции. Часть, превышающая 1,23 В[38] называется перенапряжение или перенапряжения, и представляет собой любые потери и неидеальность электрохимического процесса.
Для хорошо спроектированной ячейки самый большой перенапряжение это перенапряжение реакции для четырехэлектронного окисления воды до кислорода на аноде; электрокатализаторы может облегчить эту реакцию, и платина сплавы - это новейшие технологии для этого окисления. Разработка дешевого, эффективного электрокатализатора для этой реакции была бы большим достижением и является предметом текущих исследований; подходов много, среди них рецепт 30-летней давности сульфид молибдена,[39] графеновые квантовые точки,[40] углеродные нанотрубки,[19] перовскит,[41] и никель / оксид никеля.[42][43] Фосфид тримолибдена (Mo3P) недавно был обнаружен как многообещающий кандидат на недрагоценный металл и богатый землей с выдающимися каталитическими свойствами, который можно использовать в электрокаталитических процессах. Каталитические характеристики наночастиц Mo3P проверены в реакции выделения водорода (HER), что указывает на начальный потенциал всего 21 мВ, скорость образования H2 и плотность тока обмена 214,7 мкмоль с-1 г-1 кат (всего при 100 мВ). перенапряжение в мВ) и 279,07 мкА / см2, соответственно, которые являются одними из самых близких значений, наблюдаемых для платины.[44][45] Более простая двухэлектронная реакция для получения водорода на катоде может быть электрокатализирована почти без перенапряжения платиной или теоретически фермент гидрогеназа. Если для катода используются другие, менее эффективные материалы (например, графит ) появятся большие перенапряжения.
Термодинамика
Электролиз воды в стандартных условиях требует теоретического минимума 237 кДж подводимой электроэнергии для диссоциации каждого моля воды, что является стандартным. Свободная энергия Гиббса образования воды. Также требуется энергия, чтобы преодолеть изменение энтропии реакции. Следовательно, процесс не может продолжаться ниже 286 кДж на моль, если не добавляется внешнее тепло / энергия.
Поскольку на каждый моль воды требуется два моля электроны, и учитывая, что Постоянная Фарадея F представляет собой заряд моля электронов (96485 Кл / моль), из этого следует, что минимальное напряжение, необходимое для электролиза, составляет около 1,23 В.[46] Если электролиз проводится при высокой температуре, это напряжение снижается. Это позволяет электролизеру работать с электрическим КПД более 100%. В электрохимических системах это означает, что в реактор необходимо подавать тепло для поддержания реакции. Таким образом, тепловая энергия может использоваться для части потребности в энергии электролиза.[47] Подобным образом необходимое напряжение может быть уменьшено (ниже 1 В), если топливо (например, углерод, спирт, биомасса) вступает в реакцию с водой (электролизер на основе PEM при низкой температуре) или ионами кислорода (электролизер на основе твердого оксидного электролита при высокой температуре. ). Это приводит к тому, что часть энергии топлива используется для «помощи» процессу электролиза и может снизить общую стоимость производимого водорода.[48]
Однако, учитывая компонент энтропии (и другие потери), для протекания реакции при практических плотностях тока ( термонейтральное напряжение ).
В случае электролиза воды свободная энергия Гиббса представляет собой минимум работай необходимо для протекания реакции, а энтальпия реакции - это количество энергии (как работы, так и тепла), которое должно быть обеспечено, чтобы продукты реакции имели ту же температуру, что и реагент (т. е. стандартная температура для значений, указанных выше). Потенциально электролизер, работающий при 1,48 В, будет эффективен на 100%.[нужна цитата ]
Смотрите также
Рекомендации
- ^ Леви, Р. де (Октябрь 1999 г.). «Электролиз воды». Журнал электроаналитической химии. 476 (1): 92–93. Дои:10.1016 / S0022-0728 (99) 00365-4.[мертвая ссылка ]
- ^ Дэви, Джон, изд. (1839). «О некоторых химических предприятиях электроэнергетики». Собрание сочинений сэра Хэмфри Дэви. 5. С. 1–12.
- ^ Лачинов Дмитрий Александрович В архиве 26 июля 2011 г. Wayback Machine в большой Кирилл и Мефодий Энциклопедия (на русском)
- ^ Zumdahl, Steven S .; Зумдал, Сьюзан А. (1 января 2013 г.). Химия (9-е изд.). Cengage Learning. п. 866. ISBN 978-1-13-361109-7.
- ^ Кармо, М; Fritz D; Mergel J; Столтен Д. (2013). «Комплексный обзор электролиза воды PEM». Журнал водородной энергетики. 38 (12): 4901–4934. Дои:10.1016 / j.ijhydene.2013.01.151.
- ^ «Основы водорода - Производство». Флоридский центр солнечной энергии. 2007 г. В архиве из оригинала 18 февраля 2008 г.. Получено 5 февраля 2008.
- ^ стандартный электродный потенциал (страница данных)
- ^ Colli, A.N .; и другие. (2019). «Недрагоценные электроды для практического электролиза щелочной воды». Материалы. 12 (8): 1336. Дои:10.3390 / ma12081336. ЧВК 6515460. PMID 31022944.
- ^ Свет, Трумэн С .; Лихт, Стюарт; Bevilacqua, Anthony C .; Мораш, Кеннет Р. (1 января 2005 г.). «Основные проводимость и удельное сопротивление воды». Электрохимические и твердотельные буквы. 8 (1): E16 – E19. Дои:10.1149/1.1836121. ISSN 1099-0062. S2CID 54511887.
- ^ Полинг, Линус (1970) Общая химия, Раздел 15-2. Сан-Франциско.
- ^ Справочник по химии и физике CRC: готовый справочник химических и физических данных. Хейнс, Уильям М. (93-е изд., Изд. 2012-2013 гг.). Бока-Ратон, Флорида: CRC. 2012 г. ISBN 9781439880494. OCLC 793213751.CS1 maint: другие (связь)
- ^ Бадвал, СПС; Гиддей С; Маннингс С. (2012). «Производство водорода по твердым электролитическим путям». ПРОВОДА Энергия и окружающая среда. 2 (5): 473–487. Дои:10.1002 / wene.50. В архиве из оригинала от 2 июня 2013 г.. Получено 23 января 2013.
- ^ а б Ван, Ифэй; Narayanan, S. R .; Ву, Вэй (11 июля 2017 г.). "Полевое расщепление чистой воды на основе глубоко-субдебаевских наноразмерных электрохимических ячеек". САУ Нано. 11 (8): 8421–8428. Дои:10.1021 / acsnano.7b04038. ISSN 1936-0851. PMID 28686412.
- ^ 2001-Электролиз под высоким давлением - ключевая технология для повышения эффективности H.2[мертвая ссылка ]
- ^ Ghosh, P.C; Эмонтс, B; Janßen, H; Мергель, Дж; Столтен, Д. (2003). «Десятилетний опыт эксплуатации водородной системы возобновляемой энергии» (PDF). Солнечная энергия. 75 (6): 469–478. Bibcode:2003 SoEn ... 75..469G. Дои:10.1016 / j.solener.2003.09.006. Архивировано 27 марта 2009 года.CS1 maint: неподходящий URL (связь)
- ^ «Высокотемпературный электролиз с использованием СОЭК». Hi2h2. В архиве из оригинала 3 марта 2016 г.. Получено 5 мая 2016.
- ^ «WELTEMP Электролиз воды при повышенных температурах». Weltemp.eu. 31 декабря 2010 г. В архиве из оригинала 3 марта 2016 г.. Получено 5 мая 2016.
- ^ «Недорогой водоразделитель, работающий от обычной батарейки AAA». KurzweilAI. 22 августа 2014 г. В архиве из оригинала 16 апреля 2015 г.. Получено 11 апреля 2015.
- ^ а б Гонг, Мин; Чжоу, Ву; Цай, Мон-Че; Чжоу, Цзиган; Гуань, Минъюнь; Линь, Мэн-Чанг; Чжан, Бо; Ху, Юнфэн; Ван, Ди-Ян; Ян, Цзян; Pennycook, Стивен Дж .; Хван, Бинг-Джо; Дай, Хунцзе (2014). «Наноразмерные гетероструктуры оксид никеля / никель для активного электрокатализа выделения водорода». Nature Communications. 5: 4695. Bibcode:2014 НатКо ... 5,4695 г. Дои:10.1038 / ncomms5695. PMID 25146255.
- ^ Малдер, Ф. М .; и другие. (2017). «Эффективное хранение электроэнергии с баттолизером, интегрированной Ni-Fe-батареей и электролизером». Энергетика и экология. 10 (3): 756–764. Дои:10.1039 / C6EE02923J.
- ^ «Сделать космос более безопасным с помощью электролиза». КАК Я. В архиве из оригинала 15 мая 2012 г.. Получено 26 мая 2012.
- ^ "Дышать легко на космической станции". НАСА Наука. В архиве из оригинала 19 мая 2012 г.. Получено 26 мая 2012.
- ^ «Солнечный водородный водонагреватель на топливных элементах (Учебный стенд)». В архиве из оригинала от 8 августа 2016 г.. Получено 9 сентября 2017 - через Scribd.
- ^ Лука Бертуччиоли; и другие. (7 февраля 2014 г.). «Развитие электролиза воды в Европейском Союзе» (PDF). Заказчик Совместное предприятие по топливным элементам и водороду.
- ^ Стенсволд, Торе (26 января 2016 г.). «Coca-Cola-oppskrift» kan gjøre Hydrogen til nytt norsk Industrieventyr В архиве 5 марта 2016 г. Wayback Machine. Текниск Укеблад, .
- ^ Столтен, Детлеф (4 января 2016 г.). Водородная наука и инженерия: материалы, процессы, системы и технологии. Джон Вили и сыновья. п. 898. ISBN 9783527674299. В архиве из оригинала 22 апреля 2018 г.. Получено 22 апреля 2018.
- ^ Бернхольц, янв (13 сентября 2018 г.). «Предыдущие, текущие и возможные будущие приложения RWE для хранения энергии» (PDF). RWE. п. 10.
Общий КПД: 70% или 86% (использование отработанного тепла)
- ^ «ITM - Инфраструктура заправки водородом - февраль 2017» (PDF). level-network.com. В архиве (PDF) из оригинала 17 апреля 2018 г.. Получено 17 апреля 2018.
- ^ «Снижение затрат и повышение производительности электролизеров из ПЭМ» (PDF). Европа (веб-портал). В архиве (PDF) из оригинала 17 апреля 2018 г.. Получено 17 апреля 2018.
- ^ Бьёрнар Крузе; Сондре Гринна; Като Бух (13 февраля 2002 г.). «Водород - состояние и возможности» (PDF). Фонд Беллона. п. 20. Архивировано 16 сентября 2013 года.CS1 maint: неподходящий URL (связь)
- ^ Вернер Циттель; Райнхольд Вурстер (8 июля 1996 г.). «Глава 3: Производство водорода. Часть 4: Производство электроэнергии с помощью электролиза». HyWeb: Knowledge - Водород в энергетическом секторе. Ludwig-Bölkow-Systemtechnik GmbH. В архиве из оригинала 7 февраля 2007 г.. Получено 14 января 2006.
- ^ Бьёрнар Крузе; Сондре Гринна; Като Бух (13 февраля 2002 г.). «Водород - состояние и возможности». Фонд Беллона. Архивировано из оригинал (PDF) 2 июля 2011 г.
Прогнозируется КПД электролизеров на основе ПЭМ до 94%, но в настоящее время это только теоретически.
- ^ «высокоскоростной и высокоэффективный трехмерный электролиз воды». Grid-shift.com. Архивировано из оригинал 22 марта 2012 г.. Получено 13 декабря 2011.
- ^ «Технические цели Министерства энергетики по производству водорода путем электролиза». energy.gov. Министерство энергетики США. В архиве из оригинала 23 апреля 2018 г.. Получено 22 апреля 2018.
- ^ Соизволите, Джейсон. «Xcel привлекает« беспрецедентно »низкими ценами на солнечную и ветровую энергию в сочетании с накопителями». greentechmedia.com. Вуд Маккензи. В архиве из оригинала 4 февраля 2018 г.. Получено 22 апреля 2018.
- ^ «Широкое распространение конкурентоспособного водородного раствора» (PDF). nelhydrogen.com. Nel ASA. В архиве (PDF) из оригинала 22 апреля 2018 г.. Получено 22 апреля 2018.
- ^ Филибер, Седрик. «Комментарий: Производство промышленного водорода из возобновляемых источников энергии». iea.org. Международное энергетическое агентство. В архиве из оригинала 22 апреля 2018 г.. Получено 22 апреля 2018.
- ^ 1,23 В - стандартный потенциал; в нестандартных условиях он может быть разным, в частности, уменьшается с температурой.
- ^ Кибсгаард, Якоб; Харамилло, Томас Ф .; Безенбахер, Флемминг (2014). «Создание соответствующего мотива активного центра в катализаторе выделения водорода с помощью тиомолибдата [Mo3S13]2− кластеры ". Химия природы. 6 (3): 248–253. Bibcode:2014НатЧ ... 6..248K. Дои:10.1038 / nchem.1853. PMID 24557141.
- ^ Фэй, Хуйлун; Е, Руцюань; Е, Гунлань; Гонг, Юнцзи; Пэн, Чживэй; Фань, Сюцзюнь; Самуэль, Эррол Л.Г .; Ajayan, Pulickel M .; Тур, Джеймс М. (2014). "Квантовые точки графена, легированные бором и азотом / Гибридные нанопластинки графена как эффективные электрокатализаторы для восстановления кислорода". САУ Нано. 8 (10): 10837–43. Дои:10.1021 / nn504637y. PMID 25251218.
- ^ Luo, J .; Im, J.-H .; Mayer, M. T .; Schreier, M .; Назируддин, М.К .; Парк, Н.-Г .; Tilley, S.D .; Fan, H.J .; Гратцель, М. (2014). «Фотолиз воды с эффективностью 12,3% с помощью перовскитных фотоэлектрических элементов и катализаторов, доступных на Земле». Наука. 345 (6204): 1593–1596. Bibcode:2014Научный ... 345.1593L. Дои:10.1126 / science.1258307. PMID 25258076.
- ^ Шварц, Марк (22 августа 2014 г.). «Ученые из Стэнфорда разработали водоразделитель, работающий от обычной батареи AAA». News.stanford.edu. В архиве из оригинала 16 апреля 2016 г.. Получено 5 мая 2016.
- ^ «Ученые разработали водоразделитель, работающий от обычной батарейки AAA». Technology.org. 25 августа 2014 г.. Получено 5 мая 2016.
- ^ Кондори, Алиреза (2 мая 2019 г.). «Выявление каталитических активных центров тримолибдена фосфида (Mo3P) для электрохимического выделения водорода». Современные энергетические материалы. AdvancedEnergyMaterials. 9 (22): 1900516. Дои:10.1002 / aenm.201900516.
- ^ Ши, Яньмэй (25 января 2016 г.). «Последние достижения в области наноматериалов фосфидов переходных металлов: синтез и применение в реакции выделения водорода». Обзоры химического общества. ChemicalSocietyReviews. 45 (6): 1529–1541. Дои:10.1039 / C5CS00434A. PMID 26806563.
- ^ Хайман Д. Гессер (2002). Прикладная химия. Springer. С. 16–. ISBN 978-0-306-46700-4. Получено 18 декабря 2011.
- ^ Badwal, Sukhvinder P.S .; Гидди, Сарбджит; Маннингс, Кристофер (сентябрь 2013 г.). «Производство водорода твердыми электролитическими способами». Междисциплинарные обзоры Wiley: Энергия и окружающая среда. 2 (5): 473–487. Дои:10.1002 / wene.50. S2CID 135539661.
- ^ Badwal, Sukhvinder P. S .; Giddey, Sarbjit S .; Маннингс, Кристофер; Bhatt, Anand I .; Холленкамп, Энтони Ф. (24 сентября 2014 г.). «Новые технологии электрохимического преобразования и хранения энергии (открытый доступ)». Границы химии. 2: 79. Bibcode:2014ФрЧ .... 2 ... 79Б. Дои:10.3389 / fchem.2014.00079. ЧВК 4174133. PMID 25309898.
внешняя ссылка
- «Электролиз воды». Эксперименты по электрохимии. Получено 20 ноября 2005.
- «Электролиз воды». Do Chem 044. Архивировано из оригинал 14 марта 2006 г.. Получено 20 ноября 2005.
- EERE 2008 - Исследование торговли 100 кг H2 / день
- NREL 2006 - Технический отчет по электролизу
