Азид цезия - Caesium azide
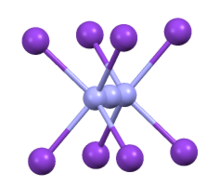 Координационная сфера азида в CsN 3 | |
| Имена | |
|---|---|
| Название ИЮПАК азид цезия | |
| Другие имена азид цезия | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.041.072 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики[1] | |
| CsN3 | |
| Молярная масса | 174,926 г / моль |
| Внешность | бесцветные иглы |
| Плотность | 3,5 г / см3 |
| Температура плавления | 310 ° С (590 ° F, 583 К) |
| 224,2 г / 100 мл (0 ° С) | |
| Структура[2] | |
| четырехугольный | |
| I4 / мкм, №140 | |
а = 6,5412 Å, c = 8,0908 Å | |
Формула единиц (Z) | 4 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Азид цезия или же азид цезия является неорганическое соединение из цезий и азид с формулой CsN
3.
Структура
CsN
3 принимает ту же структуру, что и КН
3, Руб.
3, и TlN
3 кристаллизации в тетрагональной искаженной структуре хлорида цезия, где каждый азид-ион координируется с восемью катионами металлов, а каждый катион металла координируется с восемью концевыми N-центрами.[2] При нагревании до 151 ° C, он переходит в кубическую структуру.[3]
Подготовка и реакции
Азид цезия можно получить из реакция нейтрализации между гидразойная кислота и гидроксид цезия:[4]
CsOH + HN
3 → CsN
3 + H
2О
Карбонат цезия также можно использовать в качестве основы:
CS
2CO
3 + HN
3 → CsN
3 + CO
2 + H
2О
Термическое разложение CsN
3 в вакууме может использоваться как метод получения металлического цезия высокой чистоты:[5]
2CsN
3 → 2Cs + 3N
2
Рекомендации
- ^ Перри, Дейл Л. (18 мая 2011 г.). Справочник неорганических соединений. CRC Press. п. 110. ISBN 978-1-4398-1461-1.
- ^ а б Мюллер, Ульрих (1972). "Verfeinerung der Kristallstrukturen von KN3, Руб.3, CsN3 и ИНН3". Zeitschrift für anorganische und allgemeine Chemie, 1972 г.. 392 (2): 159–166. Дои:10.1002 / zaac.19723920207.
- ^ Макинтайр, Дж. Э. (ред.). Словарь неорганических соединений, том 3: C46 - Zr. Чепмен и Хилл. п. 3096. ISBN 0-412-30120-2.
- ^ Steudel, R .; Шенк, П. В. (1975). «Стикстофф». В Брауэре, Георге (ред.). Handbuch der Präparativen Anorganischen Chemie, 3. Auflage, Band I. п. 458. ISBN 3-432-02328-6.
- ^ Блаттер, Фриц; Шумахер, Эрнст (15 января 1986 г.). «Производство цезия особой чистоты». Журнал менее распространенных металлов. 115 (2): 307–313. Дои:10.1016/0022-5088(86)90153-0.
Соли и ковалентные производные азид ион | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | Он | ||||||||||||||||||
| LiN3 | Бен3)2 | B (N3)3 | CH3N3, C (N3)4 | N (N3)3,ЧАС2N — N3 | О | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Si (N3)4 | п | ТАК2(N3)2 | ClN3 | Ar | ||||||||||||
| КН3 | Может3)2 | Sc (N3)3 | Банка3)4 | VO (N3)3 | Cr (N3)3, CrO2(N3)2 | Mn (N3)2 | Fe (N3)2, Fe (N3)3 | Против3)2, Против3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | В качестве | Se (N3)4 | BrN3 | Kr | ||
| Руб.3 | Sr (N3)2 | Y | Zr (N3)4 | Nb | Пн | Tc | Пробег3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (N3)2 | В | Sn | Sb | Te | В3 | Xe (N3)2 | ||
| CsN3 | Ba (N3)2 | Hf | Та | W | Re | Операционные системы | Ir (N3)63− | Pt (N3)62− | Au (N3)4− | Hg2(N3)2, Hg (N3)2 | TlN3 | Pb (N3)2 | Би (N3)3 | По | В | Rn | |||
| Пт | Ra (N3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла | Ce (N3)3, Ce (N3)4 | Pr | Nd | Вечера | См | Европа | Gd (N3)3 | Tb | Dy | Хо | Э | Тм | Yb | Лу | |||||
| Ac | Чт | Па | UO2(N3)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||
