Инактивация шара и цепи - Ball and chain inactivation

В нейробиология, инактивация шара и цепи модель, объясняющая механизм быстрой инактивации потенциалзависимые ионные каналы. Процесс также называют инактивация откидной крышки или же Инактивация N-типа. Потенциально-зависимый ионный канал может находиться в трех состояниях: открытом, закрытом или инактивированном. Инактивированное состояние в основном достигается за счет быстрой инактивации, при которой канал быстро переходит из открытого в неактивное состояние. Модель предполагает, что инактивированное состояние, которое является стабильным и непроводящим, вызвано физическим блокированием поры. Засорение вызвано "клубком" аминокислоты подключен к основному белок цепочкой остатков на цитоплазматический сторона мембраны. Мяч выходит в открытый канал и зацепляется за гидрофобный внутренний вестибюль внутри канала. Эта блокировка вызывает деактивацию канала, останавливая поток ионы.[1][2] Это явление в основном изучалось в калиевые каналы и натриевые каналы.[3]
Открытие
Электрофизиологические доказательства
Первые свидетельства инактивации шара и цепи появились в 1977 г. Клэй Армстронг и Франсиско Безанилья работа.[4] Предложение о физической основе непроводимости пришло из экспериментов в гигантские аксоны кальмаров, показывая, что внутреннее лечение с проназа нарушено явление инактивации. Это предполагало физический, связанный механизм инактивации, поскольку предполагалось, что проназа разрушает блокатор каналов и отменяет процесс инактивации. Эти эксперименты также показали, что инактивация может происходить только после открытия канала. Это было сделано гиперполяризующий мембрана, заставляя канал открываться и наблюдая задержку инактивации. Инактивация не наблюдалась, когда мембрана была деполяризованный (закрыто). Представляем тетраэтиламмоний (ЧАЙ) на внутриклеточный было обнаружено, что сторона канала имитирует инактивацию в неинактивирующих каналах.[5] Блокирование канала TEA является взаимоисключающим с пептидной блокадой, что позволяет предположить, что TEA конкурирует за инактивацию. сайт привязки.[6]
Молекулярные доказательства
Мутагенез эксперименты определили внутриклеточную цепочку аминокислот в качестве основных кандидатов на роль блокатора пор.[5] Точная последовательность аминокислот, которая составляет шар, блокирующий каналы в калиевых каналах, была идентифицирована путем создания синтетический пептид. Пептид был построен на основе последовательности из 20 аминокислотных остатков из Drosophila melanogaster с Шейкер ШБ белка и наносится на внутриклеточную сторону неинактивирующего канала в Xenopus ооциты. Пептид восстановил инактивацию канала, что еще раз подтвердило модель шара и цепи. В β2 белки, первые три остатка после начального метионин были определены как необходимые для инактивации. Исходные остатки имеют мотив последовательности фенилаланин, изолейцин и триптофан без которого инактивация не происходит. Изменение последующих остатков изменяет скорость и эффективность инактивации, не отменяя ее.[7]
Структурные доказательства
В последнее время, ядерный магнитный резонанс учеба в Xenopus ооцит BK каналы пролили дополнительный свет на структурные свойства области шара и цепи.[8] Внедрение KCNMB2 β субъединица на цитоплазматической стороне неинактивирующего канала восстанавливалась инактивация, что соответствовало ожидаемому поведению белка шарообразного и цепочечного типа. ЯМР Анализ показал, что шаровой домен состоит из остатков 1–17, а участок цепи - из остатков 20–45. Три аминокислоты в середине составляют гибкая линкерная область между двумя функциональными областями. Мяч находится в N-конец субъединицы β и состоит из неупорядоченной части (остатки 1–10) и мотива петля-спираль, образованного блоком аминокислот, охватывающим от серин в позиции 11 до аспартат в позиции 16. Структура цепного домена четырехвитковая. альфа спираль структура.
Структура
Шаровидный и цепной домены находятся на цитоплазматической стороне канала. Наиболее точные структурные исследования выполнены в Калиевые каналы шейкер, в котором были идентифицированы точные остатки, участвующие в процессе. Первые 19 аминокислоты из N-конец составляют область шара. Состоит из 11 гидрофобный аминокислоты, 8 гидрофильный один и 4 положительно заряженных.[9] Следующие 60 аминокислот составляют цепной домен. Модификация аминокислот мяча при сохранении их химические свойства не нарушает механизм инактивации. Это говорит о том, что мяч перекрывает канал, связывая электростатически скорее, чем ковалентно.[10] Структурные исследования показали, что внутренняя пора калиевого канала доступна только через боковые щели между цитоплазматическими доменами четырех α-субъединицы, а не с центрального маршрута, как считалось ранее.[11] Шаровой домен входит в канал через боковые прорези и прикрепляется к сайт привязки глубоко в центральная полость. Этот процесс включает конформационное изменение, что позволяет блокировщику шара и цепи удлиняться и достигать внутреннего центра канала.[12]
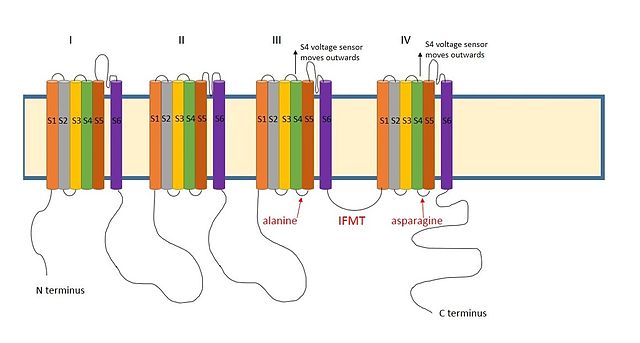
Положительно заряженная область между III и IV домены натриевых каналов считается, что действует аналогичным образом.[9] Существенная область для инактивации натриевых каналов - это четыре аминокислотные последовательности, состоящие из изолейцин, фенилаланин, метионин и треонин (IFMT).[13] В Т и F непосредственно взаимодействуют с местом стыковки в поре канала.[14] Когда потенциалзависимые натриевые каналы открыто, сегмент S4 перемещается из канала наружу во внеклеточную сторону. Это обнажает гидрофобные остатки в сегментах S4 и S5, которые взаимодействуют с шаром инактивации. Фенилаланин мяча взаимодействует саланин в сегментах S4-S5 домена III и аспарагин в сегментах S4-S5 домена IV.[15] Это объясняет, почему деактивация может произойти только после открытия канала.
Боковые щели также присутствуют в натриевых каналах,[16] предполагая, что маршрут доступа к мячу может быть аналогичным.
Существует различие между прямой и двухэтапной инактивацией. Прямая инактивация, возникающая в Шейкер Калиевые каналы возникают в результате прямой блокировки канала белком шара, в то время как двухступенчатая инактивация, как считается, происходит в BK каналы, требуется промежуточный этап привязки.[17]
Механизм шаровидной инактивации также отличается от механизма потенциал-зависимой блокады внутриклеточными молекулами или пептидными областями субъединиц бета4 в натриевые каналы.[18] Когда эти блоки способствуют инактивации натриевых каналов после открытия канала, реполяризация мембраны меняет положение блока и может вызвать возобновляющийся ток: поток ионов между разблокировкой и закрытием канала.[19]
Домен предотвращения инактивации
Калиевые каналы имеют дополнительную функцию на N-конце, которая не позволяет деактивировать каналы. Домен предотвращения инактивации N-типа (NIP) противодействует эффекту пептидного шара. Каналы, содержащие домен NIP, ведут себя как измененные не инактивирующие каналы, так как они не деактивируют.[20] Эффект считается стехиометрический, поскольку постепенное введение несвязанных синтетических шариков в цитоплазму в конечном итоге восстанавливает инактивацию.[21]
Влияние на возбуждение нейронов
Взаимодействие между открытием и отключением контролирует схема стрельбы из нейрон путем изменения скорости и количества потока ионов через каналы. Управляемые по напряжению ионные каналы открываются при деполяризация из клеточная мембрана. Это создает ток, вызванный потоком ионы через канал. Вскоре после открытия канал блокируется пептидным шариком. Субъединица β1 способствует восстановлению после инактивации,[22] а β2 ускоряет инактивацию.[23] Субъединицы β также могут вмешиваться в шаровые и цепочечные домены, блокируя их вход в канал. Это приводит к постоянным токам, вызванным продолжающимся притоком ионов. Субъединица β3 может увеличивать постоянный ток в определенных натриевых каналах.[13]
Последствия для болезни
Различия в стойких и возрождающихся токах были связаны с некоторыми человеческими неврологический и нервно-мышечный расстройства. В эпилепсия мутации в генах натриевых каналов задерживают инактивацию. Это приводит к тому, что канал остается открытым дольше и, следовательно, более длительное возбуждение нейронов.[24] Более высокий уровень стойкого тока наблюдается при эпилепсии. Этот постоянный, низкоуровневый нейрональная стимуляция был связан с припадки типично для этого расстройства.[25]
Аномалии инактивации также были связаны с Синдром Бругада. Мутации в генах, кодирующих субъединица α в сердечные натриевые каналы влияют на инактивацию. Они увеличивают постоянный ток, препятствуя инактивации, хотя разные мутации имеют противоположные эффекты в скорости инактивации.[26]
Мутации в субъединица α из скелетные мышцы также связаны с миотония. Характерное мышечное гипервозбуждение миотонии в основном вызвано наличием натриевых каналов, которые не инактивируются, вызывая высокий уровень постоянного тока в мышцах.[27]
Рекомендации
- ^ Николлс Дж. Г., Мартин А. Р., Уоллес Б. Г., Фукс П. А. (2011). От нейрона к мозгу (8-е изд.). Сандерленд, Массачусетс: Sinauer Associates. С. 123–124. ISBN 978-0878936090.
- ^ Брэди С., Сигель Г., Альберс Р. В., Прайс Д. (2012). Базовая нейрохимия: молекулярные, клеточные и медицинские аспекты (8-е изд.). Амстердам; Лондон: Academic Press. стр.106 –107. ISBN 978-0080959016.
- ^ Олдрич Р.В. (2001). «Пятьдесят лет инактивации». Природа. Издательская группа "Природа". 411 (6838): 643–644. Дои:10.1038/35079705.
- ^ Армстронг К.М. и Безанилла, Ф (1977). «Инактивация натриевого канала. II. Эксперименты с управляющим током». Журнал общей физиологии. Издательство Рокфеллерского университета. 70 (5): 567–590. Дои:10.1085 / jgp.70.5.567. ЧВК 2228472. PMID 591912.
- ^ а б Заготта В. Н., Хоши Т., Олдрич Р. В. (1990). «Восстановление инактивации мутантов шейкерных калиевых каналов пептидом, полученным из ShB». Наука. Американская ассоциация развития науки. 250 (4980): 568–571. Дои:10.1126 / science.2122520.
- ^ Чой К.Л., Олдрич Р.В., Йеллен Г. (1991). «Блокада тетраэтиламмония различает два механизма инактивации в активируемых напряжением K + каналах». Труды Национальной академии наук. Национальная академия наук. 88 (12): 5092–5095. Дои:10.1073 / pnas.88.12.5092. ЧВК 51817. PMID 2052588.
- ^ Ся XM, Ding JP, Lingle CJ (2003). «Инактивация BK-каналов NH2-концом вспомогательной бета-субъединицы. Важная роль концевого пептидного сегмента из трех гидрофобных остатков». Журнал общей физиологии. Издательство Рокфеллерского университета. 121 (2): 125–148. Дои:10.1085 / jgp.20028667. ЧВК 2217327. PMID 12566540.
- ^ Бентроп Д., Бейерманн М., Виссманн Р., Факлер Б. (2001). «ЯМР-структура« шарообразного »домена KCNMB2, бета2-субъединицы Са2 + -а и калиевых каналов с высокой проводимостью». Журнал биологической химии. Американское общество биохимии и молекулярной биологии. 276 (45): 42116–42121. Дои:10.1074 / jbc.M107118200. PMID 11517232.
- ^ а б Зал ZW (1992). Введение в молекулярную нейробиологию (1-е изд.). Сандерленд, Массачусетс: Sinauer Associates. стр.113. ISBN 978-0878933075.
- ^ Холмгрен М., Юрман М.Э., Йеллен Г. (1996). «Инактивация N-типа и область S4-S5 канала Shaker K +». Журнал общей физиологии. Издательство Рокфеллерского университета. 108 (3): 195–206. Дои:10.1085 / jgp.108.3.195. ЧВК 2229322. PMID 8882863.
- ^ Соколова О, Колмакова-Партенский Л, Григорьев Н (2001). «Трехмерная структура потенциалзависимого калиевого канала при разрешении 2,5 нм». Структура. Эльзевир. 9 (3): 215–220. Дои:10.1016 / s0969-2126 (01) 00578-0.
- ^ Чжоу М., Мораис-Кабрал Дж. Х., Манн С., Маккиннон Р. (2002). «Рецепторный сайт калиевого канала для ворот инактивации и ингибиторов четвертичного амина». Природа. Издательская группа "Природа". 411 (6838): 657–661. Дои:10.1038/35079500. PMID 11395760.
- ^ а б c Гольдин А.Л. (2003). «Механизмы инактивации натриевых каналов». Текущее мнение в нейробиологии. Эльзевир. 13 (3): 284–290. Дои:10.1016 / S0959-4388 (03) 00065-5.
- ^ Миямото К., Накагава Т., Курода Ю. (2001). «Структура раствора цитоплазматического линкера между доменом III-S6 и доменом IV-S1 (линкер III - IV) натриевого канала мозга крысы в мицеллах SDS». Биополимеры. Интернет-библиотека Wiley. 59 (5): 380–393. Дои:10.1002 / 1097-0282 (20011015) 59: 5 <380 :: AID-BIP1035> 3.0.CO; 2-T.
- ^ Миямото К., Накагава Т., Курода Ю. (2001). «Структуры раствора цитоплазматических линкеров между сегментами S4 и S5 (S4-S5) в доменах III и IV натриевых каналов мозга человека в мицеллах SDS». Журнал исследований пептидов. Интернет-библиотека Wiley. 58 (3): 193–203. Дои:10.1034 / j.1399-3011.2001.00912.x.
- ^ Пайанде Дж., Шойер Т., Чжэн Н., Каттералл В.А. (2011). «Кристаллическая структура потенциалозависимого натриевого канала». Природа. Издательская группа "Природа". 475 (7356): 353–358. Дои:10.1038 / природа10238. ЧВК 3266868. PMID 21743477.
- ^ Гонсалес-Перес В., Зенг XH, Хенцлер-Вильдман К., Лингл С.Дж. (2012). «Стереоспецифическое связывание неупорядоченного пептидного сегмента опосредует инактивацию BK-канала». Природа. Издательская группа "Природа". 485 (7396): 133–136. Дои:10.1038 / природа10994. ЧВК 3348258. PMID 22522931.
- ^ Льюис А.Х., Раман И.М. (2014). «Возобновляемый ток напряженно-управляемых Na (+) каналов». J Physiol. 592 (22): 4825–38. Дои:10.1113 / jphysiol.2014.277582. ЧВК 4259529. PMID 25172941.
- ^ Бант Дж. С., Раман И. М. (2010). «Контроль преходящего, возобновляющегося и постоянного тока путем блокады открытого канала с помощью Na-канала бета4 в культивируемых нейронах гранул мозжечка». Труды Национальной академии наук. Национальная академия наук. 107 (27): 12357–12362. Дои:10.1073 / pnas.1005633107. ЧВК 2901465. PMID 20566860.
- ^ Roeper J, Sewing S, Zhang Y, Sommer T., Wanner SG, Pongs O (1998). «Домен NIP предотвращает инактивацию N-типа в потенциалозависимых калиевых каналах». Природа. Издательская группа "Природа". 391 (6665): 390–393. Дои:10.1038/34916. PMID 9450755.
- ^ Йеллен Дж. (1998). «Подвижные части потенциалозависимых ионных каналов». Ежеквартальные обзоры биофизики. Издательство Кембриджского университета. 31 (3): 239–295. Дои:10.1017 / s0033583598003448. PMID 10384687.
- ^ Циммер Т., Бенндорф К. (2002). «Каналы Na + IIA человеческого сердца и мозга крысы взаимодействуют с различными молекулярными областями бета-субъединицы». Журнал общей физиологии. Издательство Рокфеллерского университета. 120 (6): 887–895. Дои:10.1085 / jgp.20028703. ЧВК 2229568. PMID 12451056.
- ^ Маккормик К.А., Исом Л.Л., Рэгсдейл Д., Смит Д., Шойер Т., Каттералл В.А. (1998). «Молекулярные детерминанты функции Na + канала во внеклеточном домене субъединицы бета1». Журнал биологической химии. Американское общество биохимии и молекулярной биологии. 273 (7): 3954–3962. Дои:10.1074 / jbc.273.7.3954.
- ^ Алеков А.К., Рахман М.М., Митрович Н., Леманн-Хорн Ф., Лерче Х. (2000). «Мутация натриевого канала, вызывающая эпилепсию у человека, демонстрирует тонкие дефекты быстрой инактивации и активации in vitro». Журнал физиологии. Интернет-библиотека Wiley. 529 (3): 533–540. Дои:10.1111 / j.1469-7793.2000.00533.x. ЧВК 2270215. PMID 11118488.
- ^ Stafstrom CE (2007). «Стойкий натриевый ток и его роль при эпилепсии». Течение эпилепсии. Интернет-библиотека Wiley. 7 (1): 15–22. Дои:10.1111 / j.1535-7511.2007.00156.x. ЧВК 1797888. PMID 17304346.
- ^ Риволта I, Абриэль Х, Татеяма М, Лю Х., Мемми М, Вардас П., Наполитано С., Приори С.Г., Касс Р.С. (2001). «Унаследованные мутации синдрома Бругада и длинного QT-3 одного остатка сердечного натриевого канала придают отдельный канал и клинические фенотипы». Журнал биологической химии. Американское общество биохимии и молекулярной биологии. 276 (33): 30623–30630. Дои:10.1074 / jbc.M104471200.
- ^ Lerche H, Heine R, Pika U, George AL, Mitrovic N, Browatzki M, Weiss T, Rivet-Bastide M, Franke C, Lomonaco M (1993). «Миотония натриевых каналов человека: замедленная инактивация каналов из-за замен на глицин в линкере III-IV». Журнал физиологии. Интернет-библиотека Wiley. 470 (1): 113–120. Дои:10.1113 / jphysiol.1993.sp019843. ЧВК 1143902. PMID 8308722.
