Ацетилацетон - Acetylacetone
 | |||
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Пентан-2,4-дион | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 741937 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.214 | ||
| Номер ЕС |
| ||
| 2537 | |||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2310 | ||
| |||
| |||
| Характеристики | |||
| C5ЧАС8О2 | |||
| Молярная масса | 100.117 г · моль−1 | ||
| Плотность | 0,975 г / мл[1] | ||
| Температура плавления | -23 ° С (-9 ° F, 250 К) | ||
| Точка кипения | 140 ° С (284 ° F, 413 К) | ||
| 16 г / 100 мл | |||
| -54.88·10−6 см3/ моль | |||
| Опасности | |||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H226, H302, H311, H320, H331, H335, H341, H370, H402, H412 | |||
| P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P281, P301 + 312, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P307 + 311, P308 + 313, P311, P312 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 34 ° С (93 ° F, 307 К) | ||
| 340 ° С (644 ° F, 613 К) | |||
| Пределы взрываемости | 2.4–11.6% | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
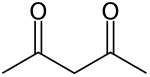
Ацетилацетон является органическое соединение с формулой CH3COCH2COCH3. Это бесцветная жидкость, относящаяся к 1,3-дикетон. Он существует в равновесии с таутомер CH3С (О) СН = С (ОН) СН3. Эти таутомеры взаимопревращаются так быстро в большинстве условий, что в большинстве случаев они рассматриваются как единое соединение.[2] Это бесцветная жидкость, которая является предшественником ацетилацетонат-аниона (обычно сокращенно acac−), а двузубый лиганд. Это также строительный блок для синтеза гетероциклические соединения.
Характеристики
Таутомерия
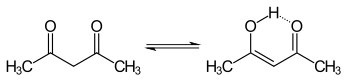
В кето и энол таутомеры ацетилацетона сосуществуют в растворе. В енольной форме C2v симметрия, что означает, что атом водорода делится поровну между двумя атомами кислорода.[3] В газовой фазе константа равновесия, Kкето → енол, составляет 11,7, в пользу енольной формы. Две таутомерные формы можно различить по ЯМР-спектроскопия, ИК-спектроскопия и другие методы.[4][5]
| Растворитель | Kкето → енол |
|---|---|
| Газовая фаза | 11.7 |
| Циклогексан | 42 |
| Толуол | 10 |
| THF | 7.2 |
| ДМСО | 2 |
| Вода | 0.23 |
Константа равновесия имеет тенденцию быть высокой в неполярных растворителях; кето-форма становится более предпочтительной в полярных растворителях, связывающих водород, таких как вода.[6] Форма енола - это винилогичный аналог карбоновая кислота.
Кислотно-основные свойства
| растворитель | Т / ° C | пKа[7] |
|---|---|---|
| 40% этиловый спирт /воды | 30 | 9.8 |
| 70% диоксан /воды | 28 | 12.5 |
| 80% ДМСО /воды | 25 | 10.16 |
| ДМСО | 25 | 13.41 |
Ацетилацетон - это слабая кислота:
- C5ЧАС8О2 ⇌ C
5ЧАС
7О−
2 + H+
ИЮПАК рекомендуемые пKа значения этого равновесия в водном растворе при 25 ° C составляют 8,99 ± 0,04 (я = 0), 8.83 ± 0.02 (я = 0,1 М NaClO4) и 9,00 ± 0,03 (я = 1,0 М NaClO4; я = Ионная сила ).[8] Доступны значения для смешанных растворителей. Очень сильные основания, такие как литийорганический соединения, будет дважды депротонировать ацетилацетон. Полученные дилитио-частицы затем можно алкилировать по C-1.
Подготовка
Ацетилацетон получают промышленным способом путем термической перегруппировки изопропенилацетат.[9]
- CH2(CH3) COC (O) Me → MeC (O) CH2Приехать
Лабораторные пути к ацетилацетону начинаются также с ацетон. Ацетон и уксусный ангидрид при добавлении трифторид бора (BF3) катализатор:[10]
- (CH3CO)2O + CH3C (O) CH3 → CH3C (O) CH2C (O) CH3
Второй синтез включает катализируемую основанием конденсацию ацетона и ацетат этила с последующим подкислением:[10]
- NaOEt + EtO2CCH3 + CH3C (O) CH3 → NaCH3C (O) CHC (O) CH3 + 2 EtOH
- NaCH3C (O) CHC (O) CH3 + HCl → CH3C (O) CH2C (O) CH3 + NaCl
Из-за простоты этих синтезов известно много аналогов ацетилацетонатов. Некоторые примеры включают C6ЧАС5C (O) CH2С (О) С6ЧАС5 (dbaH) и (CH3)3CC (O) CH2C (O) CC (CH3)3. Гексафторацетилацетонат также широко используется для образования летучих комплексов металлов.
Реакции
Конденсата
Ацетилацетон является универсальным бифункциональным предшественником гетероциклов, поскольку обе кетогруппы подвергаются конденсация. Гидразин реагирует на производство пиразолы. Мочевина дает пиримидины. Конденсация с двумя арил- и алкиламинами с образованием NacNacs, где атомы кислорода в ацетилацетоне заменены на NR (R = арил, алкил).
Координационная химия

Ацетилацетонат анион, acac−, образует комплексы со многими переходный металл ионы. Общий метод синтеза заключается в обработке соли металла ацетилацетоном в присутствии основание:[11]
- МБz + z Hacac ⇌ M (acac)z + z BH
Оба атома кислорода связываются с металлом с образованием шестичленного хелатного кольца. В некоторых случаях хелатный эффект настолько прочен, что для образования комплекса не требуется никакой дополнительной основы.
Биоразложение
Фермент ацетилацетондиоксигеназа расщепляет углерод-углеродную связь ацетилацетона с образованием ацетата и 2-оксопропаналь. Фермент зависит от железа (II), но было доказано, что он также связывается с цинком. Распад ацетилацетона был охарактеризован у бактерии Acinetobacter johnsonii.[12]
- C5ЧАС8О2 + O2 → С2ЧАС4О2 + C3ЧАС4О2
Рекомендации
- ^ «05581: Ацетилацетон». Сигма-Олдрич.
- ^ Томас М. Харрис (2001). «2,4-Пентандион». 2,4 ‐ пентандион. Энциклопедия реагентов для органического синтеза e-EROS. Дои:10.1002 / 047084289X.rp030. ISBN 0471936235.
- ^ Caminati, W .; Грабов, Ж.-У. (2006). "The C2v Структура энольного ацетилацетона ». Варенье. Chem. Soc. 128 (3): 854–857. Дои:10.1021 / ja055333g. PMID 16417375.
- ^ Manbeck, Kimberly A .; Вооз, Николай С .; Bair, Nathaniel C .; Sanders, Allix M. S .; Марш, Андерсон Л. (2011). «Влияние заместителей на кето-енольные равновесия с использованием ЯМР-спектроскопии». J. Chem. Educ. 88 (10): 1444–1445. Bibcode:2011JChEd..88.1444M. Дои:10.1021 / ed1010932.
- ^ Yoshida, Z .; Ogoshi, H .; Токумицу, Т. (1970). «Внутримолекулярная водородная связь в енольной форме 3-замещенного 2,4-пентандиона». Тетраэдр. 26 (24): 5691–5697. Дои:10.1016/0040-4020(70)80005-9.
- ^ Райхард, Кристиан (2003). Растворители и их действие в органической химии (3-е изд.). Wiley-VCH. ISBN 3-527-30618-8.
- ^ База данных ИЮПАК SC Обширная база данных опубликованных данных о константах равновесия комплексов металлов и лигандов.
- ^ Stary, J .; Лильензин, Дж. О. (1982). «Критическая оценка констант равновесия ацетилацетона и его хелатов металлов» (PDF). Чистая и прикладная химия. 54 (12): 2557–2592. Дои:10.1351 / pac198254122557.
- ^ Сигель, Хардо; Эггерсдорфер, Манфред (2002). «Кетоны». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a15_077. ISBN 9783527306732.
- ^ а б К. Э. Денун, мл. «Ацетилацетон». Органический синтез.; Коллективный объем, 3, п. 16
- ^ О'Брайен, Брайан. "Co (tfa)3 & Co (acac)3 Рекламный проспект" (PDF). Колледж Густава Адольфа.
- ^ Straganz, G.D .; Glieder, A .; Brecker, L .; Ribbons, D.W .; Штайнер, В. (2003). "Фермент, расщепляющий ацетилацетон Dke1: новый фермент, расщепляющий C – C-связь. Acinetobacter johnsonii". Biochem. J. 369 (3): 573–581. Дои:10.1042 / BJ20021047. ЧВК 1223103. PMID 12379146.





