Агрегация белков - Protein aggregation

Агрегация белков это биологический феномен, в котором внутренне неупорядоченные белки или неправильно сложенный белки агрегировать (т. е. накапливать и слипаться) внутри- или внеклеточно.[1][2] Неправильно свернутые белковые агрегаты часто коррелируют с заболеваниями. Фактически, белковые агрегаты вызывают широкий спектр заболеваний, известных как амилоидозы, в том числе ALS, Болезнь Альцгеймера, Болезнь Паркинсона и прион болезнь.[3][4]
После синтеза белки обычно складываются в особую трехмерную конформацию, которая является наиболее термодинамически благоприятной: их нативное состояние.[5] Этот процесс складывания обусловлен гидрофобный эффект: тенденция гидрофобных (водобоязненных) частей белка защищаться от гидрофильной (водоотталкивающей) среды клетки, погружаясь внутрь белка. Таким образом, внешняя часть белка обычно гидрофильна, тогда как внутренняя часть обычно гидрофобна.
Белковые структуры стабилизированы нековалентные взаимодействия и дисульфидные связи между двумя цистеин остатки. К нековалентным взаимодействиям относятся ионные взаимодействия и слабые Ван-дер-Ваальсовы взаимодействия. Ионные взаимодействия образуются между анионом и катионом и образуют солевые мостики, которые помогают стабилизировать белок. Ван-дер-Ваальсовы взаимодействия включают неполярные взаимодействия (т.е. Лондонская дисперсионная сила ) и полярные взаимодействия (т. е. водородные связи, диполь-дипольная связь ). Они играют важную роль во вторичной структуре белка, например, в образовании альфа-спираль или бета-лист, и третичная структура. Взаимодействия между аминокислотными остатками в конкретном белке очень важны для окончательной структуры этого белка.
Когда происходят изменения в нековалентных взаимодействиях, как это может происходить при изменении аминокислотной последовательности, белок подвержен неправильной укладке или разворачиванию. В этих случаях, если клетка не способствует повторной укладке белка или не разрушает развернутый белок, развернутый / неправильно свернутый белок может агрегироваться, в результате чего открытые гидрофобные части белка могут взаимодействовать с открытыми гидрофобными участками других белков. .[6][7] Есть три основных типа белковых агрегатов, которые могут образовываться: аморфные агрегаты, олигомеры, и амилоид фибриллы.[8]
Причины
Агрегация белков может происходить по разным причинам. Эти причины можно разделить на четыре класса, которые подробно описаны ниже.
Мутации
Мутации которые встречаются в последовательности ДНК, могут влиять или не влиять на аминокислотную последовательность белка. Когда последовательность изменяется, другая аминокислота может изменить взаимодействия между боковыми цепями, которые влияют на укладку белка. Это может привести к появлению открытых гидрофобных областей белка, которые агрегируются с тем же неправильно свернутым / развернутым белком или с другим белком.
Помимо мутаций в самих затронутых белках, агрегация белков также может быть вызвана косвенно через мутации белков в регуляторных путях, таких как путь рефолдинга (молекулярный шапероны ) или убиквитин-протеасомный путь (убиквитинлигазы).[9] Шапероны помогают с рефолдингом белка, обеспечивая безопасную среду для сворачивания белка. Убиквитин лигазирует целевые белки для деградации посредством модификации убиквитина.
Проблемы с синтезом белка
Агрегация белков может быть вызвана проблемами, возникающими во время транскрипция или перевод. Во время транскрипции ДНК копируется в мРНК, образуя цепь пре-мРНК, которая подвергается Обработка РНК с образованием мРНК.[10] Во время перевода рибосомы и тРНК помочь перевести последовательность мРНК в аминокислотную последовательность.[10] Если на любом этапе возникают проблемы, связанные с получением неправильной цепи мРНК и / или неправильной аминокислотной последовательности, это может привести к неправильной укладке белка, что приведет к его агрегации.
Экологические стрессы
Экологические стрессы, такие как экстремальные температуры и pH или окислительный стресс также может привести к агрегации белков.[11] Одно из таких заболеваний - криоглобулинемия.
Экстремальные температуры могут ослабить и дестабилизировать нековалентные взаимодействия между аминокислотными остатками. pH за пределами диапазона pH белка может изменить состояние протонирования аминокислот, что может увеличить или уменьшить нековалентные взаимодействия. Это также может привести к менее стабильным взаимодействиям и к разворачиванию белков.
Окислительный стресс может быть вызван такими радикалами, как активные формы кислорода (ROS). Эти нестабильные радикалы могут атаковать аминокислотные остатки, что приводит к окислению боковых цепей (например, ароматный боковые цепи, метионин боковые цепи) и / или разрыв полипептидных связей.[12] Это может повлиять на нековалентные взаимодействия, которые правильно удерживают белок вместе, что может вызвать дестабилизацию белка и может вызвать его разворачивание.[11]
Старение
Клетки имеют механизмы, которые могут повторно складывать или разрушать агрегаты белка. Однако по мере старения клетки эти механизмы контроля ослабевают, и клетка становится менее способной к разделению агрегатов.[11]
Гипотеза о том, что агрегация белков является причиной старения, теперь может быть проверена, поскольку существуют некоторые модели замедленного старения. Если развитие белковых агрегатов было процессом, не зависящим от старения, замедление старения со временем не повлияет на уровень протеотоксичности. Однако если старение связано со снижением активности защитных механизмов против протеотоксичности, модели медленного старения покажут снижение агрегации и протеотоксичности. Для решения этой проблемы было проведено несколько анализов токсичности. C. elegansЭти исследования показали, что снижение активности передачи сигналов инсулина / IGF (IIS), важного регуляторного пути старения, защищает от связанной с нейродегенерацией агрегации токсичных белков. Обоснованность этого подхода была проверена и подтверждена на млекопитающих, поскольку снижение активности сигнального пути IGF-1 защищало мышей с моделями болезни Альцгеймера от поведенческих и биохимических нарушений, связанных с этим заболеванием.[13]
Агрегатная локализация
Несколько исследований показали, что клеточные ответы на агрегацию белков хорошо регулируются и организованы. Белковые агрегаты локализуются в определенных областях клетки, и были проведены исследования этих локализаций у прокариот (кишечная палочка) и эукариот (дрожжи, клетки млекопитающих).
Бактерии
Агрегаты у бактерий асимметрично заканчиваются на одном из полюсов клетки, «старом полюсе». После деления клетки дочерние клетки со старшим полюсом получают белковый агрегат и растут медленнее, чем дочерние клетки без агрегата. Это обеспечивает механизм естественного отбора для уменьшения белковых агрегатов в бактериальной популяции.[14]
Дрожжи
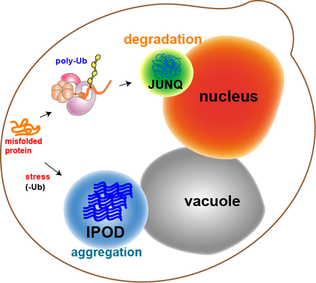
Большинство белковых агрегатов в дрожжевых клетках подвергаются рефолдингу молекулярными шаперонами. Однако некоторые агрегаты, такие как окислительно поврежденные белки или белки, предназначенные для деградации, не могут быть повторно свернуты. Скорее, есть два отсека, в которые они могут попасть. Белковые агрегаты могут быть локализованы в юкстаноуклеарном отсеке контроля качества (JUNQ ), который находится рядом с ядерной мембраной, или в отложении нерастворимого белка (IPOD ), около вакуоли в дрожжевых клетках.[11] Белковые агрегаты локализуются в JUNQ, когда они убиквитинируются и нацелены на деградацию. Агрегированные и нерастворимые белки локализуются на IPOD в виде более постоянного отложения. Есть свидетельства того, что белки здесь могут быть удалены путем аутофагии.[15] Эти два пути работают вместе, поскольку белки имеют тенденцию поступать в IPOD, когда протеасомный путь перегружен.[15]
Клетки млекопитающих
В клетках млекопитающих эти белковые агрегаты называются «агресомами», и они образуются при заболевании клетки. Это потому, что агрегаты имеют тенденцию формироваться, когда есть гетерологичные белки присутствует в клетке, что может возникнуть при мутации клетки. Убиквитинлигаза E3 способна распознавать неправильно свернутые белки и убихинировать их. HDAC6 может затем связываться с убиквитином и моторным белком. динеин для доставки меченых агрегатов к центру организации микротрубочек (MTOC ). Там они собираются вместе в сферу, окружающую MTOC. Они переносят шапероны и протеасомы и активируют аутофагию.[16]
Устранение
В клетке есть две основные системы контроля качества белка, которые отвечают за устранение агрегатов белка. Неправильно свернутые белки могут подвергаться повторной укладке под действием бишапероновой системы или разрушаться под действием убиквитиновой протеасомной системы или аутофагии.[17]
Рефолдинг
Система бишаперонов использует шапероны Hsp70 (DnaK-DnaJ-GrpE в E. coli и Ssa1-Ydj1 / Sis1-Sse1 / Fe1 в дрожжах) и Hsp100 (ClpB в E. coli и Hsp104 в дрожжах) шапероны для дезагрегации и рефолдинга белков .[18]
Hsp70 взаимодействует с белковыми агрегатами и рекрутирует Hsp100. Hsp70 стабилизирует активированный Hsp100. Белки Hsp100 имеют ароматические петли пор, которые используются для распутывания отдельных полипептидов. Эта нитевидная активность может быть инициирована на N-конце, C-конце или в середине полипептида. Полипептид перемещается через Hsp100 в несколько этапов, используя АТФ на каждом этапе.[18] Полипептид разворачивается, а затем ему дают возможность свернуться либо самостоятельно, либо с помощью белков теплового шока.[19]
Деградация
Неправильно свернутые белки могут быть устранены через систему убиквитин-протеасома (UPS ). Он состоит из пути E1-E2-E3, который убихинирует белки, чтобы пометить их для деградации. У эукариот белки расщепляются протеасомой 26S. В клетках млекопитающих лигаза E3, карбоксиконцевой белок, взаимодействующий с Hsp70 (CHIP), нацелен на белки, связанные с Hsp70. В дрожжах лигазы E3 Doa10 и Hrd1 имеют сходные функции в эндоплазматический ретикулум белки.[20]

Неправильно свернутые белки также могут быть устранены посредством аутофагии, при которой агрегаты белка доставляются в лизосому.[20]
Токсичность
Хотя считалось, что сами зрелые белковые агрегаты токсичны, недавние данные свидетельствуют о том, что на самом деле наиболее токсичными являются незрелые белковые агрегаты.[21][22] Гидрофобные участки этих агрегатов могут взаимодействовать с другими компонентами клетки и повреждать их. Гипотезы состоят в том, что токсичность белковых агрегатов связана с механизмами секвестрации клеточных компонентов, генерации активных форм кислорода и связывания со специфическими рецепторами в мембране или через разрушение мембран.[23] Количественный анализ был использован для определения того, что частицы с более высокой молекулярной массой ответственны за проникновение через мембрану.[24] Известно, что белковые агрегаты in vitro могут дестабилизировать искусственные бислои фосфолипидов, что приводит к пермеабилизации мембраны.
Смотрите также
использованная литература
- ^ Агуцци, А .; О'Коннор, Т. (март 2010 г.). «Заболевания агрегации белков: патогенность и терапевтические перспективы». Обзоры природы Drug Discovery. 9 (3): 237–48. Дои:10.1038 / nrd3050. PMID 20190788. S2CID 5756683.
- ^ Стефани, М .; Добсон, СМ. (Ноябрь 2003 г.). «Агрегация белков и совокупная токсичность: новое понимание сворачивания белков, болезней неправильной укладки и биологической эволюции». Дж Мол Мед (Берл). 81 (11): 678–99. Дои:10.1007 / s00109-003-0464-5. PMID 12942175. S2CID 23544974.
- ^ De Felice, FG .; Виейра, Миннесота; Meirelles, MN .; Морозова-Рош, Л.А. .; Добсон, СМ .; Феррейра, ST. (Июль 2004 г.). «Формирование амилоидных агрегатов из лизоцима человека и его вариантов, связанных с заболеванием, с использованием гидростатического давления». FASEB J. 18 (10): 1099–101. Дои:10.1096 / fj.03-1072fje. PMID 15155566. S2CID 13647147.
- ^ Tanzi, RE .; Бертрам, Л. (февраль 2005 г.). «Двадцать лет гипотезы амилоида болезни Альцгеймера: генетическая перспектива». Ячейка. 120 (4): 545–55. Дои:10.1016 / j.cell.2005.02.008. PMID 15734686. S2CID 206559875.
- ^ Брюнинг, Ансгар; Юкшток, Юлия (01.01.2015). «Неправильно свернутые белки: от маленьких злодеев до маленьких помощников в борьбе с раком». Границы онкологии. 5: 47. Дои:10.3389 / fonc.2015.00047. ЧВК 4338749. PMID 25759792.
- ^ Гетинг, MJ .; Самбрук, Дж. (Январь 1992 г.). «Сворачивание белков в клетке». Природа. 355 (6355): 33–45. Bibcode:1992 Натур. 355 ... 33G. Дои:10.1038 / 355033a0. PMID 1731198. S2CID 4330003.
- ^ Робертс, CJ. (Декабрь 2007 г.). «Кинетика агрегации ненативных белков». Биотехнология Биоенг. 98 (5): 927–38. Дои:10.1002 / бит. 21627. PMID 17705294. S2CID 21787377.
- ^ Кокс, Дэвид Л .; Нельсон, Майкл М. (2013). Принципы биохимии Ленингера. Нью-Йорк: W.H. Фримен. п. 143. ISBN 978-1-4292-3414-6.
- ^ Берке, Сара Дж. Обувьмит; Полсон, Генри Л. (2003-06-01). «Агрегация белков и путь убиквитина протеасомы: получение UPPer руки на нейродегенерации». Текущее мнение в области генетики и развития. 13 (3): 253–261. Дои:10.1016 / S0959-437X (03) 00053-4. PMID 12787787.
- ^ а б Уивер, Роберт Ф. (2012). Молекулярная биология. Нью-Йорк: Макгроу-Хилл. С. 122–156, 523–600. ISBN 978-0-07-352532-7.
- ^ а б c d Тайдмерс, Йенс; Могк, Аксель; Букау, Бернд (ноябрь 2010 г.). «Клеточные стратегии для контроля агрегации белков». Обзоры природы Молекулярная клеточная биология. 11 (11): 777–788. Дои:10.1038 / nrm2993. PMID 20944667. S2CID 22449895.
- ^ Stadtman, E. R .; Левин, Р. Л. (29 июля 2003 г.). «Свободнорадикальное окисление свободных аминокислот и аминокислотных остатков в белках». Аминокислоты. 25 (3–4): 207–218. Дои:10.1007 / s00726-003-0011-2. ISSN 0939-4451. PMID 14661084. S2CID 26844881.
- ^ Морли Дж. Ф., Бриннул Х. Р., Вейерс Дж. Дж., Моримото Р. И. (2002). «Порог агрегации полиглутаминового белка и клеточной токсичности является динамичным и зависит от старения у Caenorhabditiselegans». PNAS. 99 (16): 10417–10422. Bibcode:2002ПНАС ... 9910417М. Дои:10.1073 / pnas.152161099. ЧВК 124929. PMID 12122205.
- ^ Беднарская, Наталья Г .; Шимковиц, Йост; Руссо, Фредерик; Ван Элдере, Йохан (01.01.2013). «Агрегация белков в бактериях: тонкая граница между функциональностью и токсичностью». Микробиология. 159 (9): 1795–1806. Дои:10.1099 / мик ..0.069575-0. PMID 23894132.
- ^ а б Такало, Мари; Салминен, Антеро; Сойнинен, Хилкка; Хилтунен, Микко; Хаапасало, Аннакайса (08 марта 2013). «Механизмы агрегации и деградации белков при нейродегенеративных заболеваниях». Американский журнал нейродегенеративных заболеваний. 2 (1): 1–14. ISSN 2165-591X. ЧВК 3601466. PMID 23516262.
- ^ Гарсия-Мата, Рафаэль; Гао, Я-Шэн; Штуль, Элизабет (2002-06-01). «Проблемы с вывозом мусора: усугубляющие агресомы». Движение. 3 (6): 388–396. Дои:10.1034 / j.1600-0854.2002.30602.x. ISSN 1600-0854. PMID 12010457. S2CID 305786.
- ^ Грегерсен, Нильс; Болунд, Ларс; Бросс, Питер (01.10.2005). «Неправильная упаковка, агрегация и деградация белков при болезни». Молекулярная биотехнология. 31 (2): 141–150. Дои:10.1385 / МБ: 31: 2: 141. ISSN 1073-6085. PMID 16170215. S2CID 36403914.
- ^ а б Могк, Аксель; Куммер, Ева; Букау, Бернд (01.01.2015). «Сотрудничество шаперонов Hsp70 и Hsp100 в дезагрегации белков». Границы молекулярных биологических наук. 2: 22. Дои:10.3389 / fmolb.2015.00022. ISSN 2296-889X. ЧВК 4436881. PMID 26042222.
- ^ Либерек, Кшиштоф; Левандовска, Агнешка; Зенткевич, Шимон (23 января 2008 г.). «Шапероны в контроле дезагрегации белков». Журнал EMBO. 27 (2): 328–335. Дои:10.1038 / sj.emboj.7601970. ISSN 0261-4189. ЧВК 2234349. PMID 18216875.
- ^ а б Чен, Брайан; Рецлафф, Марко; Роос, Томас; Фридман, Джудит (01.08.2011). «Клеточные стратегии контроля качества белка». Перспективы Колд-Спринг-Харбор в биологии. 3 (8): а004374. Дои:10.1101 / cshperspect.a004374. ISSN 1943-0264. ЧВК 3140689. PMID 21746797.
- ^ Zhu, YJ .; Lin, H .; Лал, Р. (июнь 2000 г.). «Свежий и нефибриллярный бета-амилоидный белок (1-40) вызывает быструю клеточную дегенерацию в старых фибробластах человека: доказательства клеточной токсичности, опосредованной AbetaP-каналом». FASEB J. 14 (9): 1244–54. Дои:10.1096 / fasebj.14.9.1244. PMID 10834946. S2CID 42263619.
- ^ Nilsberth, C .; Westlind-Danielsson, A .; Eckman, CB .; Кондрон, ММ .; Аксельман, К .; Forsell, C .; Stenh, C .; Luthman, J .; Теплов, ДБ .; и другие. (Сентябрь 2001 г.). «Арктическая мутация APP (E693G) вызывает болезнь Альцгеймера за счет усиленного образования протофибрилл Abeta». Nat Neurosci. 4 (9): 887–93. Дои:10.1038 / nn0901-887. PMID 11528419. S2CID 13516479.
- ^ Сото C (2003). «Раскрытие роли неправильного свертывания белков в нейродегенеративных заболеваниях». Nat. Преподобный Neurosci. 4 (1): 49–60. Дои:10.1038 / nrn1007. PMID 12511861. S2CID 205499427.
- ^ Флагмайер П., Де С, Виртенсон, округ Колумбия, Ли С.Ф., Винке С., Мюлдерманс С., Ноулз Т.П.Д., Ганди С., Добсон С.М., Кленерман Д. (2017). «Сверхчувствительное измерение притока Са2 + в липидные везикулы, индуцированного белковыми агрегатами». Энгью. Chem. Int. Эд. Англ.. 56 (27): 7750–7754. Дои:10.1002 / anie.201700966. ЧВК 5615231. PMID 28474754.
