Галогениды галлия - Gallium halides
Есть три набора галогениды галлия, тригалогениды, где галлий имеет степень окисления +3, промежуточные галогениды, содержащие галлий в состояния окисления +1, +2 и +3 и некоторые нестабильные моногалогениды, где галлий имеет степень окисления +1.
Тригалогениды
Все четыре тригалогенида известны. Все они содержат галлий в степени окисления +3. Их собственные названия - фторид галлия (III), хлорид галлия (III), бромид галлия (III) и йодид галлия (III).
- GaF3
- GaF3 представляет собой белое твердое вещество, которое сублимируется перед плавлением, с расчетной температурой плавления выше 1000 ° C. Он содержит 6 координатных атомов галлия с трехмерной сеткой из GaF.6 октаэдры разделяя общие углы.
- GaCl3, GaBr3 и GaI3
- Все они имеют более низкие температуры плавления, чем GaF.3, (GaCl3 Т.пл.78 ° C, GaBr3 Т.пл.122 ° C, GaI.3 т.пл. 212 ° C), что отражает тот факт, что все их структуры содержат димеры с 4-мя координационными атомами галлия и 2-мя мостиковыми атомами галогена. Они все Кислоты Льюиса, образуя в основном 4-х координатные аддукты. GaCl3 является наиболее часто используемым тригалогенидом.
Промежуточные галогениды
Существуют промежуточные хлориды, бромиды и йодиды. Они содержат галлий в степенях окисления +1, +2 и +3.
- Ga3Cl7
- Это соединение содержит Ga2Cl7− ион, который имеет структуру, аналогичную дихромат, Cr2О72−, ион с двумя тетраэдрически координированными атомами галлия, разделяющими угол. Соединение может быть составлено в виде гептахлородигаллата (III) галлия (I), Gaя GaIII2Cl7.[1]
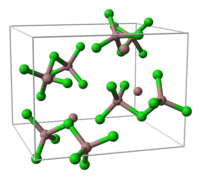


ячейка Га3Cl7 часть Кристальная структура структура [Ga2Cl7]−
- GaCl2, GaBr2 и GaI2
- Это наиболее известные и наиболее изученные промежуточные галогениды. Они содержат галлий в степени окисления +1 и +3 и имеют формулу GaяGaIIIИкс4. Дигалогениды нестабильны в присутствии воды. непропорциональный металлическому галлию и соединениям галлия (III). Они растворимы в ароматических растворителях, где были выделены ареновые комплексы и арен η6 согласовано с Ga+ ион. С некоторыми лигандами L, например диоксан, нейтральный комплекс, Ga2Икс2L2, с галлиево-галлиевой связью. Эти соединения использовались в качестве пути получения галлиевых цепных и кластерных соединений.
- Ga2Br3 и Ga2я3
- Они сформулированы Gaя2 GaII2Br6 и Gaя2 GaII2я6 соответственно. Оба аниона содержат связь галлий-галлий, причем галлий имеет формальную степень окисления +2. Га2Br62− анион затмевается как In2Br62− анион в2Br3 тогда как Ga2я62− анион изоструктурен Si2Cl6 с шахматным строением.
Моногалогениды
Ни один из моногалогенидов не стабилен при комнатной температуре. Ранее сообщалось, что GaBr и GaI, полученные из сплавления галлия с тригалогенидом, представляют собой смеси металлического галлия, соответственно, с Ga2Br3 и Ga2я3.
- GaCl и GaBr
- GaCl и GaBr были получены в газовой форме в результате реакции HX и расплавленного галлия с использованием специального реактора. Они были изолированы путем закалки высокотемпературного газа при 77 К. GaCl представлен в виде красного твердого вещества, которое непропорционально выше 0 ° C. Полученные таким образом GaCl и GaBr могут быть стабилизированы в подходящих растворителях. Образующиеся таким образом метастабильные растворы используются как предшественники многих кластерных соединений галлия.
- в HVPE изготовление GaN, GaCl получается путем пропускания газообразного HCl над расплавленным галлием, который затем реагирует с NH.3 газ.[2]
- GaI
- GaI производится в виде реактивного зеленого порошка, который был провозглашен «универсальным реагентом для химиков-синтетиков».[3] Химическая структура реагента, называемого «GaI», полученного в результате реакции металлического галлия с йодом в толуоле с использованием ультразвука, только недавно была исследована с использованием твердотельного ЯМР 69 / 71Ga и предполагаемой структуры, которая включает атомы металлического галлия, [Ga0]2[Ga]+[GaI4]−.[4]
Анионные галогенидные комплексы
Соли, содержащие GaCl4−, GaBr4− и GaI4− все известны. Галлий сильно отличается от индий в том, что известно только 6 координационных комплексов с фторид-ионом. Это можно объяснить меньшим размером галлия (ионные радиусы Ga (III) 62 мкм, In (III) 80 мкм).
Соли, содержащие Ga2Cl62− анион, у которого галлий имеет степень окисления +2.
Общие ссылки
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
Сноски
- ^ Die Kristallstruktur von Ga3Cl7 Франк В., Хёнле В., Саймон А., З. Натурфорш. Группа B (1990) 45B 1
- ^ Куеч Т.Ф., Шулин Гу, Рамчандра Вате, Лин Чжан, Цзинси Сун, Дж. А. Dumesic, J.M. Redwing Mat. Res. Soc. Symp. Proc. Vol. 639 G 1.1.1
- ^ Бейкер Р.Дж., Джонс К. Далтон Пер. 2005 21 апреля; (8): 1341-8
- ^ Widdifield, Cory M .; Юрка, Тител; Richeson, Darrin S .; Брайс, Дэвид Л. (2012). «Использование твердотельного ЯМР 69 / 71Ga и ЯКР 127I в качестве зондов для выяснения состава» GaI"". Многогранник. 35 (1): 96–100. Дои:10.1016 / j.poly.2012.01.003. ISSN 0277-5387.



