Гексахлориридат аммония (IV) - Ammonium hexachloroiridate(IV)
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.037.264 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| ЧАС8N2Cl6Ir | |
| Молярная масса | 441.01 |
| Внешность | коричневые кристаллы |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
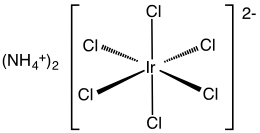
Гексахлориридат аммония (IV) это неорганическое соединение с формулой (NH4)2[IrCl6]. Это темно-коричневое твердое вещество - аммоний соль комплекса иридия (IV) [IrCl6]2−. Это коммерчески важное соединение иридия.[1] один из самых распространенных комплексов иридия (IV). Родственное, но не определенное соединение - тетрахлорид иридия, который часто используется как синонимы.[2]
Структура
Соединение охарактеризовано Рентгеновская кристаллография. Соль кристаллизуется в кубическом мотиве, как у гексахлороплатинат аммония. [IrCl6]2− центры принимают октаэдрическая молекулярная геометрия.[3]
Использует
Это ключевой промежуточный продукт при выделении иридия из руд. Большинство других металлов образуют нерастворимые сульфиды при обработке водных растворов их хлоридов сероводород, но [IrCl6]2− сопротивляется замене лиганда. При нагревании в водороде твердая соль превращается в металл:[1]
- (NH4)2[IrCl6] + 2 H2 → Ir + 6 HCl + 2 NH3
Склеивание
Электронная структура гексахлориридата (IV) аммония привлекла большое внимание. Его магнитный момент меньше расчетного для одного электрона. Этот результат интерпретируется как результат антиферромагнитного взаимодействия между центрами Ir, опосредованного взаимодействиями Cl --- Cl. Электронный спиновой резонанс, исследования показывают, что более половины спиновой плотности приходится на хлорид, поэтому описание комплекса как Ir (IV) является чрезмерным упрощением.[4]
Рекомендации
- ^ а б Renner, H .; Schlamp, G .; Kleinwächter, I .; Drost, E .; Lüschow, H.M .; Tews, P .; Panster, P .; Diehl, M .; и другие. (2002). «Металлы и соединения платиновой группы». Энциклопедия промышленной химии Ульмана. Вайли. Дои:10.1002 / 14356007.a21_075.
- ^ Томас Р. Б. Митчелл (2001). «Хлорид иридия (IV)». Энциклопедия реагентов для органического синтеза e-EROS. Дои:10.1002 / 047084289X.ri050.
- ^ Бокий, Г.Б .; Усиков, П. "Roentgenographische Untersuchung der Struktur des Ammonium-Chlor-Iridats (N H4)2IrCl6 Доклады Академии Наук СССР 1940, т. 26, p782-p784.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 1121. ISBN 978-0-08-037941-8.
