Аллотропы кислорода - Allotropes of oxygen
Есть несколько известных аллотропы кислорода. Самый знакомый - это молекулярный кислород (O2), присутствующие на значительном уровне в Атмосфера Земли и также известный как диоксид кислорода или триплетный кислород. Другой - очень реактивный озон (O3). Другие:
- Атомарный кислород (O1), а свободный радикал.
- Синглетный кислород (O2*), один из двух метастабильные состояния молекулярного кислорода.
- Тетраоксиген (O4), другая метастабильная форма.
- Твердый кислород, состоящий из шести разноцветных фаз, одна из которых О
8 и еще один металлический.
Атомарный кислород
Атомарный кислород, обозначаемый O (3P) или O (3P),[1] очень реакционноспособен, поскольку отдельные атомы кислорода стремятся быстро связываться с соседними молекулами. На поверхности Земли он существует не очень долго в природе, но в космическое пространство, наличие большого количества ультрафиолетовая радиация приводит к низкая околоземная орбита атмосфера, в которой 96% кислорода находится в атомарной форме.[1][2]
Атомарный кислород обнаружен на Марс к Моряк, Викинг, а СОФИЯ обсерватория.[3]
Диоксид
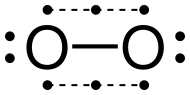
Обычный аллотроп элементарного кислорода на Земле, О
2, обычно известен как кислород, но может называться дикислород, двухатомный кислород, молекулярный кислород, или же кислородный газ отличить его от самого элемента и от трехатомного аллотропа озон, О
3. Как основной компонент (около 21% по объему) Земли атмосфера, элементарный кислород чаще всего встречается в двухатомной форме. Аэробные организмы высвободить химическую энергию, хранящуюся в слабой сигма-связи атмосферного кислорода, конечного окислителя в клеточное дыхание.[4] В основное состояние дикислорода известен как триплетный кислород, 3О2, потому что в нем два неспаренных электрона. Первое возбужденное состояние, синглетный кислород, 1О2, не имеет неспаренных электронов и является метастабильный. В дублет состояние требует нечетного числа электронов, и поэтому не может возникать в кислороде без получения или потери электронов, например, в кислороде. супероксид ион (О−
2) или диоксигенил ион (О+
2).
Основное состояние О
2 имеет длину облигации 121вечера и энергия связи 498 кДж / моль.[5] Это бесцветный газ с температурой кипения -183 ° C (90 K; -297 ° F).[6] Его можно конденсировать из воздуха путем охлаждения жидким азотом, который имеет точку кипения -196 ° C (77 K; -321 ° F). Жидкий кислород имеет бледно-голубой цвет и довольно заметно парамагнитный из-за неспаренных электронов; жидкий кислород, содержащийся в колбе, подвешенной на веревке, притягивается к магниту.
Синглетный кислород
Синглетный кислород это общее имя, используемое для двух метастабильные состояния молекулярных кислород (O2) с большей энергией, чем основное состояние триплетный кислород. Из-за различий в их электронных оболочках синглетный кислород имеет другие химические и физические свойства, чем триплетный кислород, включая поглощение и испускание света на разных длинах волн. Он может быть получен в процессе фотосенсибилизации путем передачи энергии от молекул красителя, таких как роза бенгальская, метиленовый синий или же порфирины, или химическими процессами, такими как спонтанное разложение триоксид водорода в воде или реакция пероксид водорода с гипохлорит.
Озон
Трехатомный кислород (озон, O3), представляет собой очень реактивный аллотроп кислорода, разрушающий такие материалы, как резинка и ткани а также вредит легкое ткань.[7] Его следы можно обнаружить по резкому запаху хлора,[6] приходящий из электродвигатели, лазерные принтеры, и копировальные аппараты. Он был назван «озоном» в 1840 г. Кристиан Фридрих Шёнбейн,[8] от древнегреческого ὄζειν (ozein: «нюхать») плюс суффикс -на (по-английски -один) обычно использовался в то время для обозначения производного соединения.[9]
Озон термодинамически нестабильный к более распространенной форме дикислорода, и образуется в результате реакции O2 с атомарным кислородом, полученным расщеплением O2 УФ-излучением в верхняя атмосфера.[10] Озон сильно поглощает ультрафиолет и действует как щит для биосфера против мутагенный и другие повреждающие эффекты солнечный УФ-излучение (видеть озоновый слой ).[10] Озон образуется у поверхности Земли в результате фотохимического распада диоксид азота из выхлопа автомобили.[11] Озон приземного уровня является загрязнитель воздуха это особенно вредно для пожилых людей, детей и людей с заболеваниями сердца и легких, такими как эмфизема, бронхит, и астма.[12] В иммунная система производит озон как противомикробное средство (см. ниже).[13] Жидкий и твердый O3 имеют более глубокий синий цвет, чем обычный кислород, и они нестабильны и взрывоопасны.[10][14]
Озон - это бледно-голубой газ, конденсирующийся в темно-синюю жидкость. Он образуется всякий раз, когда воздух подвергается электрическому разряду, и имеет характерный резкий запах свежескошенного сена или метро - так называемый «электрический запах».
Циклический озон
Тетраоксиген
Предполагалось, что тетраоксиген существует с начала 1900-х годов, когда он был известен как оксозон. Он был обнаружен в 2001 году группой под руководством Фульвио Какаче из Римского университета.[15] Молекула О
4 считалось, что это одна из фаз твердый кислород позже идентифицированный как О
8. Команда Cacace предположила, что О
4 вероятно состоит из двух гантелей О
2 молекулы слабо удерживаются вместе наведенными дипольными дисперсионными силами.
Фазы твердого кислорода
Есть шесть известных различных фаз твердого кислорода. Один из них темно-красный О
8 кластер. Когда кислород подвергается давлению 96 ГПа, он становится металлический, аналогично водород,[16] и становится более похожим на более тяжелый халькогены, Такие как теллур и полоний, оба имеют значительный металлический характер. При очень низких температурах эта фаза также становится сверхпроводящий.
Рекомендации
- ^ а б Райан Д. МакКалла, Университет Сент-Луиса (2010 г.). «Атомарный кислород O (3P): фотогенерация и реакции с биомолекулами».
- ^ "Из воздуха". NASA.gov. 17 февраля 2011 г.
- ^ [1]
- ^ Шмидт-Рор, Клаус (2020). «Кислород - это высокоэнергетическая молекула, питающая сложную многоклеточную жизнь: фундаментальные поправки к традиционной биоэнергетике». СКУД Омега. 5 (5): 2221–2233. Дои:10.1021 / acsomega.9b03352. ЧВК 7016920. PMID 32064383.
- ^ Чие, Чанг. «Связь длины и энергии». Университет Ватерлоо. Архивировано из оригинал 14 декабря 2007 г.. Получено 16 декабря 2007.
- ^ а б Учебник по химии: аллотропы с AUS-e-TUTE.com.au
- ^ Stwertka 1998, стр.48
- ^ Кристиан Фридрих Шёнбейн, Über die Erzeugung des Ozons auf chemischen Wege, п. 3, Базель: Schweighauser'sche Buchhandlung, 1844.
- ^ "озон", Оксфордский словарь английского языка online, получено 29 июня 2020 г.
- ^ а б c Меллор 1939
- ^ Stwertka 1998, стр.49
- ^ «Кто больше всего подвержен риску воздействия озона?». airnow.gov. Архивировано из оригинал 17 января 2008 г.. Получено 2008-01-06.
- ^ Пол Вентворт-младший; Джонатан Э. Макданн; Анита Д. Вентворт; Синди Такеучи; Хорхе Ниева; Тереза Джонс; Кристина Баутиста; Джули М. Руеди; Абель Гутьеррес; Ким Д. Джанда; Бернар М. Бабиор; Альберт Эшенмозер; Ричард А. Лернер (2002-12-13). «Доказательства катализированного антителами образования озона при уничтожении бактерий и воспалении». Наука. 298 (5601): 2195–2199. Bibcode:2002Sci ... 298.2195W. Дои:10.1126 / science.1077642. PMID 12434011. S2CID 36537588.
- ^ Коттон, Ф. Альберт и Уилкинсон, Джеффри (1972). Продвинутая неорганическая химия: подробный текст. (3-е издание). Нью-Йорк, Лондон, Сидней, Торонто: Interscience Publications. ISBN 0-471-17560-9.
- ^ Какаче, Фульвио (2001). «Экспериментальное обнаружение тетраоксигена». Angewandte Chemie International Edition. 40 (21): 4062–4065. Дои:10.1002 / 1521-3773 (20011105) 40:21 <4062 :: AID-ANIE4062> 3.0.CO; 2-X. PMID 12404493.
- ^ Питер П. Эдвардс; Фридрих Хензель (14 января 2002). «Металлический кислород». ХимФисХим. 3 (1): 53–56. Дои:10.1002 / 1439-7641 (20020118) 3: 1 <53 :: AID-CPHC53> 3.0.CO; 2-2. PMID 12465476.
дальнейшее чтение
- Парки, Г. Д .; Меллор, Дж. У. (1939). Современная неорганическая химия Меллора (6-е изд.). Лондон: Longmans, Green and Co.
- Ствертка, Альберт (1998). Путеводитель по элементам (Пересмотренная ред.). Издательство Оксфордского университета. ISBN 0-19-508083-1.
