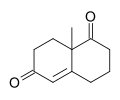
Кетон Виланда-Мишера - Wieland–Miescher ketone
 | |
| Имена | |
|---|---|
| Название ИЮПАК 8a-Метил-3,4,8,8a-тетрагидронафталин-1,6 (2ЧАС,7ЧАС) -диона | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.039.497 |
PubChem CID | |
| |
| |
| Характеристики | |
| C11ЧАС14О2 | |
| Молярная масса | 178,23 г / моль |
| Температура плавления | От 47 до 50 ° C (от 117 до 122 ° F; от 320 до 323 K) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В Кетон Виланда-Мишера [2] рацемический бициклический дикетон (эндион) и представляет собой универсальный синтон, который до сих пор использовался в общем синтезе более 50 натуральных продуктов, преимущественно сесквитерпеноиды, дитерпены и стероиды обладающие возможными биологическими свойствами, включая противораковые, противомикробные, противовирусные, антинейродегенеративные и иммуномодулирующие свойства. Реагент назван в честь двух химиков из Сиба Гейги, Карл Мишер и Питер Виланд (не путать с Генрих Отто Виланд ). Примерами синтезов, выполняемых с использованием оптически активного энантиомера этого дикетона в качестве исходного материала, являются синтез анцистрофурана. [3] и Данишефский тотальный синтез таксола.[4]
Большинство достижений в методах тотального синтеза, начиная с кетона Виланда-Мишера, было вызвано поиском альтернативных методов промышленного синтеза противозачаточных средств и других медицинских стероидов, область исследований, которая процветала в 1960-х и 1970-х годах.[5] Кетон Виланда-Мишера содержит структуру AB-кольца стероидов и по этой причине является привлекательным исходным материалом для стероидного скелета, подход, использованный в одном успешном синтезе адреностерон.[6]
Исходный кетон Виланда-Мишера является рацемическим и получают в Аннулирование Робинсона 2-метил-1,3-циклогександиона и метилвинилкетон. Промежуточный алкоголь не изолирован.[7] Требуемый 2-метил-1,3-циклогександион может быть получен из резорцин[8] к гидрирование над Никель Ренея дигидрорезорцину в качестве энолировать с последующим алкилирование с метилиодид.
An энантиоселективный синтез использует L-пролин как органокатализатор:[9]
Эта реакция появилась в 1971 г. в патентной литературе З. Г. Хаджоса и Д. Р. Пэрриша. В этом патенте также описано выделение и характеристика изображенного выше оптически активного промежуточного бициклического кетола (в скобках), поскольку они работали при температуре окружающей среды в безводных диметилформамид (ДМФ) растворитель. Работа в растворителе ДМСО не позволяет выделить промежуточный бициклический кетол, это приводит непосредственно к оптически активному бициклическому диону.[10] Реакция называется Реакция Хаджоса-Пэрриша или Реакция Хайоса-Пэрриша-Эдера-Зауэра-Вихерта.[11]
Эта реакция также была проведена в одну стадию, что привело к 49% урожай и 76% Энантиомерный избыток (ее):[12]
Были исследованы другие катализаторы на основе пролина. [13]
Рекомендации
- ^ (±) -8a-Метил-3,4,8,8a-тетрагидро-1,6 (2H, 7H) -нафталиндион в Сигма-Олдрич
- ^ Wieland, P .; Мишер, К. Über die Herstellung mehrkerniger Ketone., Helv. Чим. Acta 1950, 33, 2215. Дои:10.1002 / hlca.19500330730
- ^ Чичери, Паола, Демниц, Ф.В. Иоахим, Соуза, Марсия К.Ф. де, Леманна, Майк. Общий подход к синтезу моноциклофарнезил-сесквитерпенов. J. Braz. Chem. Soc. 1998, 9, 409-414. ISSN 0103-5053. (Статья )
- ^ Сэмюэл Дж. Данишефски, Джон Дж. Мастерс, Венди Б. Янг, JT Link, Лоуренс Б. Снайдер, Томас В. Маги, Дэвид К. Юнг, Ричард К. А. Айзекс, Уильям Г. Борнманн, Шерил А. Алаймо, Крейг А. Коберн и Мартин Дж. Ди Гранди (1996). «Полный синтез баккатина III и таксола». Варенье. Chem. Soc. 118 (12): 2843-2859. Дои:10.1021 / ja952692a
- ^ Вихерт, Р. Роль контроля над рождаемостью в выживании человечества. Энгью. Chem. Int. Эд. 1977, 16, 506-513.
- ^ Dzierba, C.D .; Занди, К. С .; Moellers, T .; Ши, К. Дж. Восходящий синтез адреналькортикостероидов. Полный синтез (+) - адреностерона. Варенье. Chem. Soc. 1996, 118, 4711-4712.
- ^ Синтез Виланда-Мишера: а) вода, уксусная кислота, гидрохинон (стабилизирует EVK) б)L-пролин, ДМСО г) водород, Никель Ренея, едкий натр д) метилиодид, диоксан. удельное вращение 68°.
- ^ А. Б. Меклер, С. Рамачандран, С. Сваминатан и Мелвин С. Ньюман Органический синтез, Сб. Vol. 5, стр. 743 (1973); Vol. 41, стр.56 (1961). (Статья )
- ^ 1,6 (2H, 7H) -нафталиндион, 3,4,8,8a-тетрагидро-8a-метил-, (S) - Paul Buchschacher, A. Fürst, and J. Gutzwiller Organic Syntheses, Coll. Vol. 7, стр. 368 (1990); Vol. 63, стр.37 (1985). (Статья )
- ^ Z. G. Hajos, D. R. Parrish, патент Германии DE 2102623 (29 июля 1971 г.) и USP 3 975 440 (17 августа 1976 г.), пример 21.
- ^ 1 H-Инден-1,5 (6 H) -дион, 2,3,7,7a-тетрагидро-7a-метил-, (S) - Золтан Г. Хаджос и Дэвид Р. Пэрриш Органический синтез, Сб. Vol. 7, стр.363 (1990); Vol. 63, стр.26 (1985) Статья Идентичная реакция с 2-метил-1,3-циклопентандионом (5-членное кольцо вместо 6-членного кольца)
- ^ Катализируемая пролином асимметричная реакция аннулирования Робинсона Буквы Тетраэдра, Том 41, Выпуск 36, Сентябрь 2000, Страницы 6951-6954 Томми Буй и Карлос Ф. Барбас Дои:10.1016 / S0040-4039 (00) 01180-1
- ^ Орг. Synth. 2011, 88, 330-341 Связь


