Адсорбция белков - Protein adsorption
Адсорбция (не путать с поглощение ) представляет собой накопление и адгезию молекул, атомов, ионов или более крупных частиц к поверхности, но без проникновения через поверхность. Адсорбция более крупных биомолекул, таких как белки, имеет большое физиологическое значение, и поэтому они адсорбируются с помощью других механизмов, чем их молекулярные или атомные аналоги. Некоторые из основных движущих сил адсорбция белка включают: поверхностную энергию, межмолекулярные силы, гидрофобность и ионное или электростатическое взаимодействие. Зная, как эти факторы влияют на адсорбцию белка, ими можно управлять с помощью механической обработки, легирования и других инженерных методов для выбора наиболее оптимальных характеристик в биомедицинских или физиологических приложениях.
Актуальность
Многие медицинские устройства и изделия контактируют с внутренними поверхностями тела, такими как хирургические инструменты и имплантаты. Когда чужеродный материал попадает в тело, первый шаг иммунная реакция происходит и происходит агрегация внеклеточного матрикса и белков плазмы хозяина с материалом в попытках сдержать, нейтрализовать или изолировать повреждающий агент.[1] Эти белки могут способствовать прикреплению различных типов клеток, таких как остеобласты и фибробласты которые могут способствовать восстановлению тканей.[2] Сделав еще один шаг вперед, имплантируемые устройства могут быть покрыты биоактивный материал для стимулирования адсорбции определенных белков, образования фиброзных капсул и заживления ран. Это снизит риск отторжения имплантата и ускорит выздоровление за счет выбора необходимых белков и клеток, необходимых для эндотелиализации. После образования эндотелий, тело больше не будет подвергаться воздействию инородного материала и остановит иммунный ответ.
Белки, такие как коллаген или же фибрин часто служат каркасом для клеточной адгезии и роста клеток. Это неотъемлемая часть структурной целостности клеточных листов и их дифференциации в более сложные структуры тканей и органов. Свойства адгезии белков к небиологическим поверхностям сильно влияют на то, могут ли клетки косвенно прикрепляться к ним через каркасы. Имплант, такой как замена тазобедренного стержня, требует интеграции с тканями хозяина, и адсорбция белка облегчает эту интеграцию.
Хирургические инструменты могут быть сконструированы так, чтобы их было легче стерилизовать, чтобы белки не оставались адсорбированными на поверхности, что могло бы вызвать перекрестное загрязнение. Некоторые болезни, такие как Болезнь Крейтцфельдта-Якоба и Куру (оба связаны с коровье бешенство ) вызваны передачей прионы, которые представляют собой ошибочные или неправильно свернутые формы обычно нативного белка. Хирургические инструменты, загрязненные прионами, требуют специальный метод стерилизации полностью уничтожить все микроэлементы неправильно свернутого белка, поскольку они устойчивы ко многим из обычно используемых методов очистки.
Однако в некоторых случаях адсорбция белка на биоматериалах может быть крайне неблагоприятным событием. Адгезия факторы свертывания может побудить тромбоз, что может привести к Инсульт или другие засоры.[3] Некоторые устройства предназначены для взаимодействия с внутренней средой тела, например, сенсоры или средства доставки лекарств, и адсорбция белка может снизить их эффективность.
Основы адсорбции белков
Белки биомолекулы, состоящие из аминокислота субъединицы. Каждая аминокислота имеет боковую цепь, которая приобретает или теряет заряд в зависимости от pH окружающей среды, а также от ее собственных индивидуальных полярных / неполярных свойств.[4]
Заряженные области могут во многом способствовать тому, как этот белок взаимодействует с другими молекулами и поверхностями, а также его собственной третичной структурой (сворачиванием белка). В результате своей гидрофильности заряженные аминокислоты обычно располагаются снаружи белков, где они могут взаимодействовать с поверхностями.[5] Это уникальное сочетание аминокислот, которое придает белку его свойства. С точки зрения химия поверхности, белок адсорбция это критическое явление, которое описывает агрегацию этих молекул на внешней стороне материала. Склонность белков оставаться прикрепленными к поверхности во многом зависит от свойств материала, таких как поверхностная энергия, текстура и относительное распределение заряда. Более крупные белки с большей вероятностью адсорбируются и остаются прикрепленными к поверхности из-за большего количества участков контакта между аминокислотами и поверхностью (рис. 1).

Энергия адсорбции белков
Фундаментальная идея спонтанной адсорбции белка заключается в том, что адсорбция происходит, когда выделяется больше энергии, чем получается в соответствии с законом Гиббса о свободной энергии.
Это видно в уравнении:
куда:
- ∆Объявления чистое изменение параметров
- грамм является Свободная энергия Гиббса
- Т это температура (Единица СИ: кельвин )
- S это энтропия (Единица СИ: джоуль на кельвин)
- ЧАС это энтальпия (Единица СИ: джоуль)
Чтобы адсорбция белка происходила спонтанно, ∆Объявленияграмм должно быть отрицательным числом.
Эффект Вромана
Белки и другие молекулы постоянно конкурируют друг с другом за участки связывания на поверхности. Эффект Вромана, разработанный Лео Вроманом, предполагает, что маленькие и многочисленные молекулы будут первыми, кто покроет поверхность. Однако со временем молекулы с более высоким сродством к этой конкретной поверхности заменят их. Это часто наблюдается в материалах, которые контактируют с кровью, где фибрин, которого обычно много, сначала связывается с поверхностью и со временем замещается более крупными белками.[6]
Скорость адсорбции
Чтобы белки адсорбировались, они должны сначала войти в контакт с поверхностью через один или несколько из этих основных транспортных механизмов: распространение, тепловая конвекция, объемный поток, или их комбинация. При рассмотрении транспорта белков ясно, как градиенты концентрации, температура, размер белка и скорость потока будут влиять на прибытие белков на твердую поверхность. В условиях низкого потока и минимальных температурных градиентов скорость адсорбции может быть смоделирована по уравнению скорости диффузии.[5]
Уравнение скорости диффузии
куда:
- D коэффициент диффузии
- п это поверхностная концентрация белка
- Co это объемная концентрация белков
- т время
Более высокая объемная концентрация и / или более высокий коэффициент диффузии (обратно пропорциональный размеру молекулы) приводит к большему количеству молекул, прибывающих на поверхность. Последующие взаимодействия белков на поверхности приводят к высоким локальным концентрациям адсорбированного белка, достигающим в 1000 раз более высоких, чем в основном растворе.[5] Однако тело гораздо более сложное, оно содержит поток и конвективную диффузию, и это необходимо учитывать при оценке скорости адсорбции белка.
Течение в тонком канале
и
куда:
- C это концентрация
- D коэффициент диффузии
- V скорость потока
- Икс это расстояние по каналу
- γ скорость сдвига стенки
- б высота канала
Это уравнение[5] особенно применимо для анализа адсорбции белка на биомедицинских устройствах в артериях, например стенты.
Силы и взаимодействия, влияющие на адсорбцию белка
Четыре основных класса сил и взаимодействий при адсорбции белка: 1) ионное или электростатическое взаимодействие, 2) водородная связь, 3) гидрофобный взаимодействие (в значительной степени обусловленное энтропией) и 4) взаимодействия с переносом заряда или типа электронодонорного / акцепторного электронов.[7]
Ионные или электростатические взаимодействия
Заряд белков определяется pKa своего аминокислота боковые цепи, а также концевую аминокислоту и карбоновую кислоту. Белки с изоэлектрическая точка (pI) выше физиологических условий имеют положительный заряд, а белки с pI ниже физиологических условий имеют отрицательный заряд. Чистый заряд белка, определяемый суммарным зарядом его составляющих, дает электрофоретический миграция в физиологическом электрическом поле. Эти эффекты кратковременны из-за высокой диэлектрической постоянной воды, однако, как только белок приближается к заряженной поверхности, электростатическая связь становится доминирующей силой.[8]
Водородная связь
Вода имеет такую же склонность к образованию водородных связей, как и любая группа в полипептид. Во время процесса сворачивания и ассоциации пептидные и аминокислотные группы обмениваются водородными связями с водой. Таким образом, водородная связь не оказывает сильного стабилизирующего действия на адсорбцию белка в водной среде.[9]
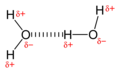
Иллюстрация двух молекул воды, взаимодействующих с образованием водородной связи
Гидрофобные взаимодействия
Гидрофобный взаимодействия по сути энтропийный взаимодействия в основном из-за явлений порядка / беспорядка в водной среде. Свободная энергия, связанная с минимизацией межфазных поверхностей, отвечает за минимизацию площади поверхности водяных капель и пузырьков воздуха в воде. Этот же принцип является причиной того, что боковые цепи гидрофобных аминокислот ориентированы от воды, что сводит к минимуму их взаимодействие с водой. В гидрофильный группы на внешней стороне молекулы приводят к растворимости белка в воде. Охарактеризовать это явление можно, рассматривая эти гидрофобные отношения с концепцией межфазной свободной энергии. Соответственно, можно рассматривать движущую силу этих взаимодействий как минимизацию полной межфазной свободной энергии, то есть минимизацию площади поверхности.[10]

Взаимодействие с переводом заряда
Взаимодействия с переносом заряда также важны для стабилизации белков и поверхностного взаимодействия. В общих донорно-акцепторных процессах можно думать о наличии избыточной электронной плотности, которая может быть передана электрофильным частицам. В водных средах эти взаимодействия растворенных веществ в первую очередь обусловлены эффектами пи-орбитальных электронов.[11]
Другие факторы, влияющие на адсорбцию белка
Температура
Температура оказывает влияние как на состояние равновесия, так и на кинетику адсорбции белка. Количество белка, адсорбированного при высокой температуре, обычно выше, чем при комнатной температуре. Изменение температуры вызывает конформационные изменения белка, влияющие на адсорбцию. Эти конформационные перестройки в белках приводят к увеличению энтропии, которое действует как основная движущая сила адсорбции белка. Влияние температуры на адсорбцию белка можно увидеть в процессах производства пищевых продуктов, особенно жидких пищевых продуктов, таких как молоко, которое вызывает тяжелые обрастание на стеновых поверхностях оборудования, где проводится термообработка.[12][13]
Ионная сила
Ионная сила определяет Длина Дебая что коррелирует с расстоянием затухания электрического потенциала фиксированного заряда в электролите. Таким образом, чем выше ионная сила, тем короче электростатические взаимодействия между заряженными объектами. В результате адсорбция заряженных белков на противоположно заряженные субстраты затрудняется, тогда как адсорбция на одинаково заряженных субстратах усиливается, тем самым влияя на кинетику адсорбции. Кроме того, высокая ионная сила увеличивает склонность белков к агрегации.[12]
Мультибелковая система
Когда поверхность подвергается воздействию мультибелкового раствора, адсорбция одних белковых молекул предпочтительнее, чем других. Молекулы белка, приближающиеся к поверхности, конкурируют за сайты связывания. В мультибелковой системе может происходить притяжение между молекулами, тогда как в однобелковых растворах преобладают межмолекулярные отталкивающие взаимодействия. Кроме того, происходит зависящее от времени распространение белка, когда молекулы белка первоначально контактируют с минимальными участками связывания на поверхности. С увеличением времени пребывания белка на поверхности белок может разворачиваться для взаимодействия с дополнительными сайтами связывания. Это приводит к зависящему от времени увеличению точек контакта между белком и поверхностью. Это дополнительно делает десорбция менее вероятно.[5]
Экспериментальные подходы к изучению адсорбции белков
Техника истощения раствора
Этот метод измеряет изменение концентрации белков в нерасфасованном растворе до и после адсорбция, Δcп. Любое изменение концентрации белка связано с адсорбированным слоем Γп.
Γп = Δcп В / Амалыш
куда:
- V = общий объем белкового раствора
- Амалыш = Общая площадь, доступная для адсорбция
Для этого метода также требуется материал с большой площадью поверхности, такой как адсорбенты в виде частиц и шариков.[14]
Эллипсометрия
Эллипсометрия широко используется для измерения адсорбции белка кинетика а также структура адсорбированного белкового слоя. Это оптический метод, который измеряет изменение поляризация света после отражения от поверхности. Для этого метода требуются плоские отражающие поверхности, предпочтительно кварц, кремний или кремнезем, и сильное изменение показатель преломления при адсорбции белка.[12]
Атомно-силовая микроскопия
Атомно-силовая микроскопия (AFM) - мощный микроскопия метод, используемый для исследования образцов в наномасштабе и часто используется для изображения распределения белков на поверхности. Он состоит из консоль с наконечником для сканирования по поверхности. Это ценный инструмент для измерения взаимодействия белок-белок и белок-поверхность. Однако ограничивающим фактором многих исследований АСМ является то, что визуализация часто выполняется после высыхания поверхности, что может повлиять на укладку белка и структуру белкового слоя. Более того, кончик кантилевера может вытеснять белок или гофрировать белковый слой.[12][15]
Поверхностный плазмонный резонанс
Поверхностный плазмонный резонанс (SPR) широко используется для измерения адсорбции белка с высокой чувствительностью. Этот метод основан на возбуждении поверхностных плазмонов, продольных электромагнитных волн, возникающих на границе раздела металлов и диэлектриков. Осаждение на проводящую поверхность молекул и тонких слоев в пределах 200 нм изменяет диэлектрик свойства системы и, следовательно, отклик ППР, сигнализирующий о присутствии молекул на поверхности металла.[16]
Кварцевые микровесы
Кварцевые микровесы (QCM) - акустический датчик, построенный вокруг диска в форме кварц кристалл. Он использует обратное пьезоэлектрический эффект. QCM и расширенные версии, такие как QCM-D, широко используется для исследований адсорбции белков, особенно для мониторинга в реальном времени адсорбции белков без меток. В дополнение к исследованиям адсорбции QCM-D также предоставляет информацию о модулях упругости, вязкость, и конформационные изменения [17]
Оптическая волноводная световая спектроскопия
Оптическая волноводная световая спектроскопия (OWLS) - это устройство, основанное на тонкопленочном оптическом волноводе, содержащем дискретное количество направленных электромагнитных волн. Наведение осуществляется при помощи решетчатой муфты. Он основан на измерениях эффективного показателя преломления тонкопленочного слоя над волноводом. Этот метод работает только на очень прозрачных поверхностях. [17]
Другие методы, широко используемые для измерения количества белка, адсорбированного на поверхности, включают радио-мечение, Анализ Лоури, рефлектометрия угла сканирования, флуоресценция полного внутреннего отражения, анализ бицинхониновой кислоты и Т. Д.
Адсорбция белков на металлах
Химический состав
Металлическое соединение относится к особой связи между положительными ионами металлов и окружающими облаками валентных электронов.[18] Эта межмолекулярная сила относительно велика и приводит к повторяющимся кристаллический ориентация атомов, также называемая ее решетчатая система. Есть несколько типов общих решетчатых образований, и каждый имеет свою уникальную плотность упаковки и атомную близость. Отрицательно заряженные электронные облака из ионов металлов будут стерически препятствовать адгезии отрицательно заряженных областей белка из-за отталкивание заряда, тем самым ограничивая доступные сайты связывания белка с поверхностью металла.
Формирование решетки может привести к соединению с открытыми потенциальными сайтами адгезии, зависящими от ионов металлов (MIDAS), которые являются сайтами связывания коллагена и других белков.[19] Поверхность металла имеет свойства, отличные от основной, так как нормальные кристаллические повторяющиеся субъединицы оканчиваются на поверхности. Это оставляет поверхностные атомы без соседнего атома с одной стороны, что по своей сути изменяет распределение электронов. Это явление также объясняет, почему поверхностные атомы имеют более высокую энергию, чем основная масса, которую часто просто называют поверхностная энергия. Это состояние с более высокой энергией неблагоприятно, и поверхностные атомы будут пытаться уменьшить ее, связываясь с доступными реактивными молекулами.[20]

Это часто достигается за счет адсорбции белка, когда поверхностные атомы восстанавливаются до более выгодного энергетического состояния.
Внутренняя среда тела часто моделируется как водная среда при 37 ° C и pH 7,3 с большим количеством растворенного кислорода, электролитов, белков и клеток.[5] Под воздействием кислорода в течение длительного периода времени многие металлы могут стать окисленный и увеличить их поверхность степень окисления теряя электроны.[21] Этот новый катионный состояние оставляет поверхность с чистым положительным зарядом и более высоким сродством к отрицательно заряженным боковым группам белка. Среди огромного разнообразия металлов и металлических сплавов многие из них подвержены коррозии при имплантации в тело. Более электроотрицательные элементы корродируют быстрее при воздействии водной среды, богатой электролитом, такой как человеческое тело.[22] И окисление, и коррозия снизят свободную энергию, таким образом влияя на адсорбцию белка, как видно из уравнения. 1.[23]
Влияние топографии
Шероховатость и текстура поверхности оказывают неоспоримое влияние на адсорбцию белка на всех материалах, но с учетом повсеместного распространения процессов обработки металлов полезно рассмотреть, как они влияют на поведение белков. Важна начальная адсорбция, а также поддержание адгезии и целостности. Исследования показали, что шероховатость поверхности может способствовать адгезии белков каркаса и остеобластов и приводит к увеличению минерализации поверхности.[24] Поверхности с более топографическими особенностями и шероховатостью будут иметь большую открытую поверхность для взаимодействия белков.[5] Что касается приложений биомедицинской инженерии, микрообработка часто используются техники для увеличения адгезии белков к имплантатам в надежде сократить время восстановления. Техника лазерного рисунка создает бороздки и шероховатость поверхности, которые влияют на адгезию, перемещение и совмещение. Пескоструйная очистка, метод, аналогичный пескоструйной очистке, и химическое травление оказались успешными методами придания шероховатости поверхности, которые способствуют долговременной стабильности титановых имплантатов.[25] Повышение стабильности является прямым результатом наблюдаемого увеличения внеклеточного матрикса и прикрепления коллагена, что приводит к увеличению прикрепления и минерализации остеобластов по сравнению с негрубыми поверхностями.[26] Однако адсорбция не всегда желательна. Адсорбция может отрицательно повлиять на оборудование, особенно с Адсорбция белка в пищевой промышленности.
Адсорбция белков на полимерах[27]
Полимеры имеют большое значение при рассмотрении адсорбции белка в биомедицинской сфере. Полимеры состоят из одного или нескольких типов «меров», повторно связанных вместе, обычно направленными ковалентными связями. По мере того как цепь растет за счет добавления мер, химические и физические свойства материала определяются молекулярной структурой мономера. Путем тщательного выбора типа или типов мер в полимере и процесса его производства химические и физические свойства полимера могут быть адаптированы для адсорбции определенных белков и клеток для конкретного применения.
Эффекты конформации
Адсорбция белка часто приводит к значительным конформационным изменениям, которые относятся к изменениям в вторичный, высшее, и четвертичная структура белков. В дополнение к скорости и количеству адсорбции решающее значение имеют ориентация и конформация. Эти конформационные изменения могут влиять на взаимодействие белков с лиганды, субстраты, и антигены которые зависят от ориентации интересующего сайта связывания. Эти конформационные изменения в результате адсорбции белка также могут денатурировать белок и изменить его нативные свойства.
Адсорбция на полимерных каркасах
Тканевая инженерия это относительно новая область, в которой используется строительные леса в качестве платформы, на которой пролиферируют желаемые клетки. Неясно, что определяет идеальный каркас для конкретного типа ткани. Соображения сложны, и адсорбция белка только усложняет задачу. Хотя архитектура, структурная механика и свойства поверхности играют ключевую роль, понимание деградации и скорости адсорбции белка также имеет ключевое значение. В дополнение к основам механики и геометрии подходящая конструкция каркаса будет обладать свойствами поверхности, оптимизированными для прикрепления и миграции типов клеток, представляющих особый интерес.
Как правило, было обнаружено, что наиболее успешными являются каркасы, которые очень похожи на естественную среду создаваемой ткани. В результате было проведено много исследований по изучению природных полимеров, которые можно адаптировать с помощью методологии обработки к конкретным критериям проектирования. Хитозан в настоящее время является одним из наиболее широко используемых полимеров, поскольку он очень похож на встречающиеся в природе гликозаминогликан (ГАГ) и разлагается человеком ферменты.[28]
Хитозан
Хитозан представляет собой линейный полисахарид, содержащий связанные остатки, полученные из хитина, и широко изучается в качестве биоматериала из-за его высокой совместимости с многочисленными белками в организме. Хитозан является катионным и поэтому электростатически реагирует с многочисленными протеогликаны, анионные ГАГ и другие молекулы, обладающие отрицательным зарядом. Поскольку многие цитокины и факторы роста связаны с GAG, каркасы с комплексами хитозан-GAG способны удерживать эти белки, секретируемые прикрепленными клетками. Еще одно качество хитозана, которое придает ему хороший потенциал биоматериала, - это высокая плотность заряда в растворах. Это позволяет хитозану образовывать ионные комплексы со многими водорастворимыми анионными полимерами, расширяя диапазон белков, которые способны связываться с ним, и тем самым расширяя его возможные применения.[29]
| Полимер | Строение лесов | Целевая ткань | Тип ячейки приложения | Ссылка |
|---|---|---|---|---|
| Хитозан | 3D пористые блоки | Кость | Остеобластоподобные АФК | [30] |
| Хитозан-полиэстер | 3D волоконная сетка | Кость | MSC человека | [31] |
| Хитозан-альгинат | Инъекционный гель | Кость | Остеобластоподобный MG63 | [32] |
| Хитозан-желатин | 3D пористые цилиндры | Хрящ | Хондроциты | [33] |
| Хитозан-ГП | Инъекционный гель | Хрящ | Хондроциты | [34] |
| Хитозан-коллаген | Пористые мембраны | Кожа | Совместное культивирование фибробластов и кератиноцитов | [35] |
Прогноз адсорбции белка
Адсорбция белка имеет решающее значение для многих промышленных и биомедицинских приложений. Точный прогноз адсорбции белка позволит добиться прогресса в этих областях.
База данных биомолекулярной адсорбции
База данных биомолекулярной адсорбции (BAD) - это свободно доступная онлайн-база данных с экспериментальными данными адсорбции белка, собранными из литературы. База данных может использоваться для выбора материалов для изготовления микрофлюидных устройств и для выбора оптимальных рабочих условий лаборатория на кристалле устройств. Количество белка, адсорбированного на поверхности, можно предсказать, используя нейронные сети прогноз на основе BAD. Было подтверждено, что этот прогноз имеет ошибку менее 5% для всех данных, доступных в BAD. Другие параметры, такие как толщина белковых слоев и поверхностное натяжение покрытых белком поверхностей, также можно оценить.[нужна цитата ]
Рекомендации
- ^ Рехендорф, Кристиан. «Влияние шероховатости поверхности на адсорбцию белка» (PDF). Тезис. Междисциплинарный центр нанонаук Орхусского университета, Дания. Получено 23 мая 2011.
- ^ Маддикери, Р.Р .; С. Тосатти; М. Шулер; С. Чессари; М. Текстор; R.G. Ричардс; L.G. Харрис (февраль 2008 г.). «Снижение адгезии бактериальных штаммов, связанных с медицинской инфекцией, на биоактивных титановых поверхностях, модифицированных RGD: первый шаг к селективным поверхностям». Журнал исследований биомедицинских материалов, часть A. 84A (2): 425–435. Дои:10.1002 / jbm.a.31323. PMID 17618480.
- ^ Горбет, МБ; М. В. Сефтон (ноябрь 2004 г.). «Тромбоз, связанный с биоматериалом: роль факторов свертывания, комплемента, тромбоцитов и лейкоцитов». Биоматериалы. 25 (26): 5681–5703. Дои:10.1016 / j.biomaterials.2004.01.023. PMID 15147815.
- ^ Purdue. "Аминокислоты". Получено 17 мая 2011.
- ^ а б c d е ж грамм Ди, Кей C (2002). Введение во взаимодействие ткани и биоматериала. Библиотека Калифорнийского Поли Кеннеди: Джон Уайли и сыновья. С. 1–50. ISBN 978-0-471-25394-5.
- ^ Розенгрен, Аса (2004). «Взаимодействие клетка-белок-материал на биокерамике и модельных поверхностях». Комплексные конспекты диссертаций Уппсальского факультета науки и технологий.
- ^ Ghosh, S; H.B. Бык (1966). «Адсорбированные пленки бычьего сывороточного альбумина». Биохим. Биофиз. Acta. 66: 150–157. Дои:10.1016/0006-3002(63)91178-8. PMID 13947535.
- ^ Андраде, Джозеф Д. (1985). Поверхностные и межфазные аспекты биомедицинских полимеров. Нью-Йорк и Лондон: Пленум. стр.10–21. ISBN 978-0-306-41742-9.
- ^ Купер, А. (1980). «Конформационные колебания и изменение биологических макромолекул». Научный прогресс. 66: 473–497.
- ^ Танфорд, К. (1981). Гидрофобный эффект. Нью-Йорк: Вили.
- ^ Порат Дж. (1979). «Адсорбция с переносом заряда в водных средах». Чистая и прикладная химия. 51 (7): 1549–1559. Дои:10.1351 / pac197951071549.
- ^ а б c d Рабе М. (2011). «Понимание адсорбции белка на твердых поверхностях» (PDF). Достижения в области коллоидной и интерфейсной науки. 162 (1–2): 87–106. Дои:10.1016 / j.cis.2010.12.007. PMID 21295764.
- ^ Наканиши, К. (2001). «Об адсорбции белков на твердых поверхностях - обычном, но очень сложном явлении». Журнал биологии и биоинженерии. 91 (3): 233–244. Дои:10.1016 / с 1389-1723 (01) 80127-4.
- ^ Хлади, В. (1999). «Методы изучения адсорбции белков». Методы Энзимол. 309: 402–429. Дои:10.1016 / S0076-6879 (99) 09028-X. ЧВК 2664293. PMID 10507038.
- ^ Lea, AS. (1992). «Манипуляции с белками слюды с помощью атомно-силовой микроскопии». Langmuir. 8 (1): 68–73. Дои:10.1021 / la00037a015. ЧВК 4137798. PMID 25147425.
- ^ Серволи, Э. (2009). «Сравнительные методы оценки адсорбции белков». Макромолекулярная бионаука. 9 (7): 661–670. Дои:10.1002 / mabi.200800301. HDL:10261/55283. PMID 19226562.
- ^ а б Фульга, Ф .; Д. В. Николау (2006). Биомолекулярные слои: количественная оценка массы и толщины. Энциклопедия биомедицинской инженерии Wiley. Дои:10.1002 / 9780471740360.ebs1351. ISBN 978-0471740360.
- ^ Копелиович, Дмитрий. «Кристаллическая структура металлов». SubsTech. Получено 17 мая 2011.
- ^ «Кристаллическая структура сигнатурного домена белка олигомерного матрикса хряща: последствия для связывания коллагена, гликозаминогликанов и интегрина».
- ^ Такеда, Сатоши; Макото Фукава; Ясуо Хаяси; Киёси Мацумото (8 февраля 1999 г.). «Поверхностная группа ОН, определяющая адсорбционные свойства пленок оксидов металлов». Тонкие твердые пленки. 339 (1–2): 220–224. Bibcode:1999TSF ... 339..220T. Дои:10.1016 / S0040-6090 (98) 01152-3.
- ^ Over, H .; Зейтсонен (20 сентября 2002 г.). "А.П.". Наука. 5589. 297 (5589): 2003–2005. Дои:10.1126 / science.1077063. PMID 12242427.
- ^ Сюй, Липин; Гуонин Ю; Эрлин Чжан; Фэн Пан; Кэ Ян (4 июня 2007 г.). «Коррозионные свойства сплава Mg-Mn-Zn для применения в костных имплантатах». Журнал исследований биомедицинских материалов, часть A. 83A (3): 703–711. Дои:10.1002 / jbm.a.31273. PMID 17549695.
- ^ Пак, Джун Бу (1984). Биоматериалы наука и техника. Библиотека Калифорнийского Поли: подразделение издательской корпорации Plenum. С. 171–181. ISBN 978-0-306-41689-7.
- ^ Делигианни, DD; Кацала Н; Ladas S; Sotiropoulou D; Amedee J; Миссирлис Ю.Ф. (2001). «Влияние шероховатости поверхности титанового сплава Ti-6Al-4V на реакцию клеток костного мозга человека и на адсорбцию белка». Биоматериалы. 22 (11): 1241–1251. Дои:10.1016 / s0142-9612 (00) 00274-х. PMID 11336296.
- ^ Взлом, SA; Харви Э.Дж.; Танзер М; Krygier JJ; Бобынь JD (2003). «Протравленная кислотой микротекстура для улучшения роста кости в имплантаты с пористым покрытием». Хирургический сустав J Bone. 85B (8): 1182–1189. Дои:10.1302 / 0301-620X.85B8.14233. PMID 14653605.
- ^ Ян, SX; Л. Сальвати; П Су (23–25 сентября 2007 г.). «Как пескоструйная обработка кремнеземом влияет на минерализацию сплава Ti6Al4V в системе культивирования клеток костного мозга крыс». Материалы медицинского оборудования. IV: 182–187.
- ^ Фирковска-Боден, И .; Чжан, X .; Jandt, Клаус. Д. (2017). «Контроль адсорбции белка через наноструктурированные полимерные поверхности». Передовые медицинские материалы. 7 (1): 1700995. Дои:10.1002 / adhm.201700995. PMID 29193909.
- ^ Drury, J.L .; Муни, Д.Дж. (2003). «Гидрогели для тканевой инженерии: переменные конструкции и области применения каркаса». Биоматериалы. 24 (24): 4337–4351. Дои:10.1016 / s0142-9612 (03) 00340-5.
- ^ Ван Блиттерсвейк, Клеменс (2008). Тканевая инженерия. Эльзевир.
- ^ Хо, Куо; и другие. (2004). «Изготовление пористых матриксов методами замораживания-экстракции и замораживания-желатина». Биоматериалы. 25 (1): 129–138. Дои:10.1016 / s0142-9612 (03) 00483-6.
- ^ Коррело, Витор; Лучано Ф. Бозель; Мринал Бхаттачарья; Жоао Ф. Мано; Нуно М. Невес; Руис Л. Рейс (2005). «Усиленные гидроксиапатитом смеси хитозана и полиэфира для биомедицинских применений». Выпуск Макромолекулярные материалы и инженерия Макромолекулярные материалы и инженерия. 290 (12): 1157–1165. Дои:10.1002 / мама.200500163. HDL:1822/13819.
- ^ Ли, Z; Х. Рамай; К. Хаух; Д. Сяо; М. Чжан (2005). «Хитозано-альгинатные гибридные скаффолды для инженерии костной ткани». Биоматериалы. 26 (18): 3919–3928. Дои:10.1016 / j.biomaterials.2004.09.062. PMID 15626439.
- ^ Ся, Вт; Лю, В. (2004). «Тканевая инженерия хряща с использованием хитозан-желатиновых сложных матриксов». Журнал исследований биомедицинских материалов, часть B: Прикладные биоматериалы. 71B (2): 373–380. Дои:10.1002 / jbm.b.30087. PMID 15386401.
- ^ Ченит, А; К. Чапут; Д. Ван; C. гребни; M.D. Buschmann; CD. Hoemann; и другие. (2000). «Новые нейтральные растворы хитозана для инъекций образуют биоразлагаемые гели in situ». Биоматериалы. 21 (21): 2155–2161. Дои:10.1016 / s0142-9612 (00) 00116-2. PMID 10985488.
- ^ Черный, B; Bouez, C .; и другие. (2005). «Оптимизация и характеристика искусственного эквивалента кожи человека». Тканевая инженерия. 11 (5–6): 723–733. Дои:10.1089 / десять.2005.11.723. PMID 15998214.





