Раствор пираньи - Piranha solution
Эта статья нужны дополнительные цитаты для проверка. (Декабрь 2014 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |

Раствор пираньи, также известный как пиранья травка, представляет собой смесь серная кислота (ЧАС2ТАК4), вода и пероксид водорода (ЧАС2О2), используется для очистки органический остатки от основания. Потому что смесь крепкая окислитель, он удалит большинство органическая материя, и это также будет гидроксилат большинство поверхностей (добавить группы ОН), что делает их очень гидрофильный (совместим с водой). Это означает, что решение может легко растворяться ткань и кожа вызывают тяжелые химические ожоги в процессе.
Приготовление и использование
Обычно используется много различных соотношений смеси, и все они называются пираньями. Типичная смесь - это 3 части концентрированной серной кислоты и 1 часть 30% раствора перекиси водорода; другие протоколы могут использовать смесь 4: 1 или даже 7: 1. Близкая смесь, иногда называемая «базовой пираньей», представляет собой смесь 3: 1 аммиачная вода с перекисью водорода.
Раствор пираньи нужно готовить с особой тщательностью. Это очень коррозионный и чрезвычайно мощный окислитель. Перед контактом с раствором поверхности должны быть достаточно чистыми и полностью свободными от органических растворителей от предыдущих этапов мойки. Раствор пираньи очищает, растворяя органические загрязнители, и большое количество загрязнителей вызовет бурное пузырение и выброс газа, который может вызвать взрыв.[1]
Раствор пираньи всегда следует готовить, медленно добавляя перекись водорода к серной кислоте, а не наоборот.[2][3] Смешивание раствора чрезвычайно экзотермический. Если раствор приготовить быстро, он мгновенно закипит, выпустив большое количество едких паров. Даже при осторожном приготовлении возникающее тепло может привести к температуре раствора выше 100 ° C. Перед использованием необходимо дать ему остыть. Внезапное повышение температуры также может привести к бурному кипению чрезвычайно кислого раствора. Растворы, приготовленные с использованием перекиси водорода с концентрацией более 50%, могут вызвать взрыв. Как только смесь стабилизируется, ее можно дополнительно нагреть для поддержания ее реакционной способности.[4] Горячий (часто пузырящийся) раствор очищает органические соединения с субстратов и окисляет или гидроксилатирует большинство металл поверхности. Для очистки обычно требуется от 10 до 40 минут, после чего подложки можно удалить из раствора.
Раствор можно смешать перед нанесением или нанести непосредственно на материал, сначала нанеся серную кислоту, а затем пероксид. Из-за саморазложения перекиси водорода раствор пираньи следует использовать в свежеприготовленном виде. Раствор нельзя хранить, так как он выделяет газ и поэтому его нельзя хранить в закрытом контейнере.[2] Поскольку раствор бурно реагирует со многими предметами, которые обычно утилизируются как химические отходы, если раствор не нейтрализован, его необходимо оставить в четко обозначенных контейнерах.
Приложения
Раствор пираньи часто используется в микроэлектроника промышленность, например чистить фоторезист остаток от кремний вафли.
Несмотря на то, что существуют более безопасные и дешевые варианты, решение можно использовать для травления самодельных печатных плат. На пустую медную плату накладывается маска, и раствор пираньи быстро удаляет открытую медь, не покрытую маской.[5]
В лаборатории этот раствор иногда используют для очистки изделия из стекла, хотя это не рекомендуется во многих учреждениях, и его не следует использовать регулярно из-за его опасности.[6] В отличие от хромовая кислота растворов пиранья не загрязняет стеклянную посуду ионами тяжелых металлов.
Раствор пираньи особенно полезен при очистке спеченная (или "фриттованная") посуда. Размер пор в спеченной стеклянной посуде имеет решающее значение для ее функции, поэтому ее не следует чистить сильными основаниями, которые постепенно растворяют агломерат. Спеченное стекло также имеет тенденцию захватывать материал глубоко в структуре, что затрудняет его удаление. Если менее агрессивные методы очистки не дают результата, можно использовать раствор пираньи, чтобы вернуть агломерату чистую белую, сыпучую форму без чрезмерного повреждения размеров пор. Обычно это достигается путем пропускания раствора через спеченное стекло. Хотя очистка посуды из спеченного стекла сделает ее максимально чистой, не повредив посуду, это делать не рекомендуется из-за риска взрыва. [7]
Раствор пираньи используется для изготовления стекла гидрофильный путем гидроксилирования поверхности, таким образом увеличивая количество силанол группы на поверхности.[8]
Механизм
Эффективность раствора пираньи в удалении органических остатков обусловлена двумя различными процессами, которые работают с заметно разными скоростями. Первый и более быстрый процесс - удаление водорода и кислорода как единиц воды концентрированной серной кислотой. Это происходит потому, что гидратация концентрированной серной кислоты термодинамически очень благоприятный, с ΔH −880 тыс.J /моль. Именно это свойство быстрого обезвоживания, а не сама кислотность, делает концентрированную серную кислоту и, следовательно, раствором пираньи очень опасным в обращении.
- ЧАС2ТАК4 + H2О2 → H2ТАК5 (Кислота Каро ) + H2О
Процесс дегидратации проявляется в быстрой карбонизации обычных органических материалов, особенно углеводы, при погружении в раствор пираньи. Раствор пираньи был назван частично в связи с энергичностью этого первого процесса, поскольку большие количества органических остатков, погруженных в раствор, обезвоживаются настолько сильно, что процесс напоминает процесс пиранья с жадностью есть. Второе и более определенное объяснение названия, однако, это способность раствора пираньи «есть что угодно», в частности, элементалей. углерод в виде сажа или же char.
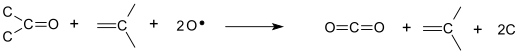
Этот второй и гораздо более интересный процесс можно понять как усиленное серной кислотой превращение пероксида водорода из относительно мягкого окислитель в достаточно агрессивный, чтобы растворить элементарный углерод, материал, который, как известно, устойчив к реакциям с водой при комнатной температуре. Это превращение можно рассматривать как энергетически выгодную дегидратацию пероксида водорода с образованием гидроксоний ионы, бисульфат ионы, и временно атомарный кислород:
- ЧАС2ТАК4 + H2О2 → H3О+ + HSO4− + O
Именно эта чрезвычайно реактивная форма атомарного кислорода позволяет раствору пираньи растворять элементарный углерод. Углерод аллотропы трудно поддаются химическому воздействию из-за высокой стабильности и, как правило, графитоподобного гибридизированные облигации что поверхностные атомы углерода имеют тенденцию к образованию друг с другом. Наиболее вероятный путь, по которому раствор разрушает эти стабильные углерод-углеродные поверхностные связи, состоит в том, что атомарный кислород первым присоединяется непосредственно к поверхностному углероду с образованием карбонил группа:
В описанном выше процессе атом кислорода фактически «крадет» пару электронных связей у центрального углерода, образуя карбонильную группу и одновременно разрушая связи целевого атома углерода с одним или несколькими его соседями. Результатом является каскадный эффект, при котором одиночная реакция атомарного кислорода инициирует значительное «распутывание» локальной связывающей структуры, что, в свою очередь, позволяет широкому диапазону водных реакций воздействовать на ранее непроницаемые атомы углерода. Дальнейшее окисление, например, может преобразовать исходную карбонильную группу в диоксид углерода и создать новую карбонильную группу на соседнем углероде, связи которого были разорваны:
Уголь, удаляемый раствором пираньи, может быть либо исходным остатком, либо углем на стадии дегидратации. Процесс окисления идет медленнее, чем процесс обезвоживания, и занимает несколько минут. Окисление углерода проявляется в постепенном очищении от взвешенной сажи и угля, оставшихся в результате начального процесса дегидратации. Со временем растворы пираньи, в которые были погружены органические материалы, обычно возвращаются к полной прозрачности, без видимых следов исходных органических материалов.
Последним незначительным вкладом в очистку раствора пираньи является его высокая кислотность, которая растворяет отложения, такие как металл. оксиды и карбонаты. Однако, поскольку такие отложения безопаснее и легче удалять с помощью более мягких кислот, раствор чаще используется в ситуациях, когда высокая кислотность облегчает очистку, а не усложняет ее. Для субстратов с низкой толерантностью к кислотности предпочтителен щелочной раствор, состоящий из гидроксида аммония и перекиси водорода, известный как основная пиранья.
Безопасность и утилизация
Раствор пираньи очень опасен, так как он является одновременно сильным кислотным и сильным окислителем. Горячий раствор, который больше не используется, никогда не следует оставлять без присмотра. Не следует хранить в закрытой таре. Раствор пираньи не следует утилизировать вместе с органическими растворителями (например, с отработанным растворителем. бутыли ), так как это вызовет бурную реакцию и значительный взрыв, и любой контейнер для отходов, содержащий даже слабый или обедненный раствор пираньи, должен иметь соответствующую маркировку, чтобы предотвратить это.[2]
Перед утилизацией раствору необходимо дать остыть, а газообразный кислород - рассеяться. При чистке стеклянной посуды разумно и практично позволить раствору пираньи реагировать в течение ночи. Это позволяет отработанному раствору разлагаться перед утилизацией, что особенно важно, если при приготовлении использовалась большая часть пероксида. В то время как некоторые учреждения считают, что использованный раствор пираньи следует собирать как опасные отходы, другие считают, что его можно нейтрализовать и слить в канализацию с большим количеством воды.[2][9][10] Неправильная нейтрализация может вызвать быстрое разложение с выделением чистого кислорода.
Одна процедура нейтрализации включает в себя выливание раствора в стеклянный контейнер, наполненный по крайней мере в пять раз превышающим массу раствора льда, затем медленное добавление гидроксида натрия или калия до нейтрализации. Если льда нет, то раствор пираньи можно очень медленно добавлять к насыщенному раствору бикарбоната натрия в большом стеклянном контейнере с большим количеством нерастворенного бикарбоната на дне, которое обновляется, если он истощается. Бикарбонатный метод не является предпочтительным, так как он может переполняться пеной, если добавление происходит недостаточно медленно, и без охлаждения раствор становится очень горячим.[11]
Смотрите также
- Пероксимоносерная кислота или кислота Каро
- Пероксидисерная кислота
- RCA чистый
- Супергидрофильность
- Ультрагидрофобность
- Реактив Фентона
- Царская водка
Рекомендации
- ^ «Пиранья». Пенсильванский университет. Архивировано из оригинал 18 июля 2010 г.. Получено 4 мая 2011.
- ^ а б c d «Раздел 10: Информация о конкретных химических веществах - Растворы пираньи». Руководство по безопасности в лаборатории. Университет Принстона.
- ^ «Стандартная рабочая процедура для решений Piranha - MIT» (ДОК). Получено 12 мая 2016.
- ^ «Порядок обращения и использования раствора Acid Piranha» (PDF). Кембриджский университет. Архивировано из оригинал (PDF) 15 июня 2015 г.. Получено 12 июн 2015.
- ^ «Травление печатной платы H2SO4 + H2O2 - YouTube».
- ^ «16. Лабораторные процедуры». Sci.chem FAQ. Получено 2008-01-11.
- ^ "Взрывы решения пираханы". Зона безопасности от C&EN.
- ^ К. Дж. Сеу; А. П. Панди; Ф. Хак; Э. А. Проктор; А. Э. Риббе; Дж. С. Ховис (2007). «Влияние обработки поверхности на диффузию и образование доменов в поддерживаемых липидных бислоях». Биофизический журнал. 92 (7): 2445–2450. Bibcode:2007BpJ .... 92.2445S. Дои:10.1529 / biophysj.106.099721. ЧВК 1864818. PMID 17218468.
- ^ "Информационный бюллетень по отходам пираньи, Иллинойсский университет в Урбане-Шампейн" (PDF).
- ^ «Политика использования решений Pirana, Иллинойсский университет в Урбана-Шампейн» (PDF).
- ^ "- Отдел безопасности исследований | Иллинойс". drs.illinois.edu. Получено 2020-11-08.
внешняя ссылка
- Растворы для очистки Piranha
- Как приготовить раствор пираньи на YouTube (ответственно)
- Раствор пираньи растворяет куриное сердце на YouTube (очевидно)
- Как настоящее травление в плакированной меди H2SO4 + H2O2 + Cu на YouTube (очевидно)