Абрамов реакция - Abramov reaction
| Абрамов реакция | |
|---|---|
| Названный в честь | Василий Сергеевич Абрамов |
| Тип реакции | Реакция сцепления |
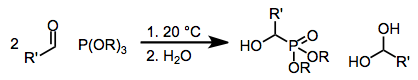
В Абрамов реакция представляет собой связанные превращения триалкила в α-гидроксифосфонаты путем присоединения к карбонильным соединениям. С точки зрения механизма реакция включает атаку нуклеофильного атома фосфора на карбонильный углерод.[1] Он был назван в честь русского химика Василия Семеновича Абрамова (1904–1968) в 1957 году.[2]
Вступление
Богатые электронами источники фосфора, такие как фосфиты, фосфониты и фосфиниты, могут подвергаться нуклеофильному присоединению к атомам углерода в простых карбонильных соединениях. Когда используются полностью этерифицированные фосфиты (реакция Абрамова), нейтрализация образовавшегося тетраэдрического промежуточного соединения обычно происходит посредством переноса алкильной или силильной группы от кислорода, присоединенного к фосфору, к вновь созданному алкоксидному центру. Также возможно сопряженное добавление,[3] и дает γ-функционализированные карбонильные соединения или простые енольные эфиры после группового переноса. Использование силоксисодержащих источников фосфора значительно расширило рамки этой реакции, так как полученные α-силоксисоединения могут быть превращены в соответствующие α-гидроксипроизводные в присутствии спиртового растворителя.[4]
(1)

Механизм и стереохимия
Преобладающий механизм
Фосфиты обратимо присоединяются к карбонильному углероду простых карбонильных соединений. В мягких условиях возврат к исходным веществам происходит быстрее, чем перенос как меж-, так и внутримолекулярной алкильной группы - четырехцентровое переходное состояние для внутримолекулярного переноса демонстрирует плохое перекрытие орбиталей.[5] Перенос может быть облегчен в условиях высокой температуры или давления. Если используются два эквивалента альдегида, добавление тетраэдрического промежуточного соединения ко второй молекуле альдегида приводит либо к циклическим фосфоранам 1 или продукты переноса линейного алкила 2.
Более практичным является использование источников силилированного фосфора, которые претерпевают внутримолекулярный перенос силильной группы фронтальным образом, обеспечивая соединения α-силоксифосфора. 3.[6]
(3)

Объем и ограничения
Фосфорные реагенты
Фосфиты обычно используются для получения α-гидроксифосфонатов. В присутствии двух эквивалентов альдегидциклических фосфоранов 1 (уравнение 3) преобладают, но они могут быть легко гидролизованы с образованием соответствующих гидроксифосфонатов.[7]
(6)
Когда фосфоновые кислоты используются в присутствии каталитических количеств основания, могут образовываться оксиды фосфина. Натриевые соли фосфоновых кислот исторически хорошо работали в этом контексте, а такие основания, как амид натрия был использован.[8] Однако асимметричная индукция и селективное прямое добавление (для конъюгированных карбонильных соединений) могут быть достигнуты в присутствии хиральных аминовых оснований.[9]
(7)

Открытие и использование силилированных фосфорных реагентов в этой реакции явилось прогрессом в методологии. Селективный перенос силильной группы происходит в смешанных реагентах, и разрыв образующихся кремний-кислородных связей часто может осуществляться гидролитически, обеспечивая доступ к α-гидроксипроизводным. Алкилирование α-силоксигрупп обеспечивает удобный путь к другим труднодоступным соединениям α-алкоксифосфора. Они могут действовать как эквиваленты ацильных анионов при депротонировании и давать кетоны после элиминирования в основных условиях.[10]
(8)

Карбонильные субстраты
Простые кетоны и альдегиды легко подвергаются присоединению фосфитов к карбонильному углероду. В одном интересном приложении добавление кетенов дает продукты, идентичные Арбузов реакция галогенангидридов.[11]
(9)

α, β-Ненасыщенные кетоны и альдегиды также претерпевают реакцию. Диенилкарбонильные субстраты могут подвергаться 1,6-присоединению, как в примере ниже.[12]
(10)

Имин также может подвергаться реакции (Пудовик реакция ), предоставляя α-алкиламинофосфонаты.[13] Первичные амины могут быть получены только после кислотного гидролиза промежуточного продукта. терт-бутиламин;[14] использование незамещенных иминов требует очень жестких условий и дает низкие выходы.
(11)

Синтетическая утилита
Полученные этим способом α-гидроксиалкилфосфонаты можно использовать для дополнительных превращений. Исходный карбонильный углерод подкисляется из-за его близости к фосфонатной группе. Депротонирование в этом положении приводит к образованию замаскированного ацильного аниона, так как фосфонатная функциональность может быть удалена после реакции аниона. Фосфонат-анионы могут подвергаться алкилированию и олефинированию ( Реакция Хорнера-Уодсворта-Эммонса ).[15] Когда α-аминоалкилфосфонаты используются при олефинизации, полученные енамины могут быть гидролизованы до кетонов.
(12)
Добавление к ненасыщенным карбонильным соединениям и депротонирование дает гомоенолятные эквиваленты.
Сравнение с другими методами
Силилированные фосфитные реагенты являются одними из самых эффективных для получения α-гидроксифосфонатов. Однако существует несколько других способов получения этих соединений. Например, фосфат-фосфонатная перегруппировка дает α-гидроксифосфонаты через трехчленный циклический промежуточный продукт.[16]
(13)

Условия и процедуры экспериментов
Обычно реакции присоединения фосфора просты в эксплуатации. Растворы реагентов в полярных (ацетонитрил, этиловый спирт, терт-бутанол) и неполярные (бензол ) можно использовать растворители. Кислотный катализ может потребоваться для добавления сложных диэфиров фосфита или для на месте образование иминов. В первом случае можно также использовать основной катализ. Дистилляция обычно достаточно для выделения чистых продуктов.
Смотрите также
- Реакция Михаэлиса – Арбузова - реакция триалкилфосфита и алкилгалогенида с образованием фосфоната.
Рекомендации
- ^ Энгель Р. (2004). «Добавление фосфора на sp² Углерод ». Органические реакции: 175–248. Дои:10.1002 / 0471264180.or036.02. ISBN 0471264180.
- ^ Аркадий Николаевич Пудовик. iopc.ru
- ^ Секин, М .; Ямамото, I .; Hashizume, A .; Хата, Т. (1977). «Силилфосфиты V. Реакции трис (триметилсилил) фосфита с карбонильными соединениями». Chem. Латыш. 6 (5): 485–488. Дои:10.1246 / класс.1977.485.
- ^ Ranganathan, D .; Rao, B .; Ранганатан, С. (1979). «Нитроэтилен: синтез новых 2-нитроэтилфосфонатов». J. Chem. Soc., Chem. Commun. (21): 975. Дои:10.1039 / c39790000975.
- ^ Гинзберг, А .; Якубович, Ю. (1960). Ж. Общ. Хим. 30: 3979.CS1 maint: журнал без названия (связь)
- ^ Зоммер, Х. Стереохимия, механизм и кремний, McGraw-Hill, New York, 1965, стр. 176–178.
- ^ Рамирес, Ф .; Bhatia, B .; Смит, П. (1967). «Реакция триалкилфосфитов с ароматическими альдегидами». Тетраэдр. 23 (5): 2067. Дои:10.1016/0040-4020(67)80040-1.
- ^ Пудовик, А .; Арбузов, А. (1950). Докл. Акад. АН СССР. 73: 327.CS1 maint: журнал без названия (связь)
- ^ Wynberg, H .; Smaardijk, A. (1983). «Асимметричный катализ в образовании углерод-фосфорной связи». Tetrahedron Lett. 24 (52): 5899. Дои:10.1016 / S0040-4039 (00) 94232-1.
- ^ Хорнер, H .; Родер, Х. (1970). "Phosphororganische Verbindungen, 67. Notiz über die reduktive Umwandlung von Carbonsäuren in ihre Aldehyde". Chem. Бер. 103 (9): 2984. Дои:10.1002 / cber.19701030936.
- ^ Мирсалихова, М .; Баранова, А .; Туницкая, Л .; Гуляев, Н. (1981). Биохимия. 46: 258.CS1 maint: журнал без названия (связь)
- ^ Арбузов, А .; Фуженкова, В .; Рожкова, Ф. (1982). J. Gen. Chem. СССР. 52: 10.CS1 maint: журнал без названия (связь)
- ^ Тыка, Р. (1970). «Новый синтез α-аминофосфоновых кислот». Tetrahedron Lett. 11 (9): 677–680. Дои:10.1016 / S0040-4039 (01) 97800-1.
- ^ Моэдрицер, К. (1970). «Новый синтез аминометилфосфоновой кислоты». Synth. Реагировать. Неорг. Металл-Орг. Chem. 2 (4): 317–327. Дои:10.1080/00945717208069617.
- ^ Уодсворт, В. (1977). «Синтетические применения анионов, стабилизированных фосфорилом». Орг. Реагировать. 25: 73–253. Дои:10.1002 / 0471264180.or025.02. ISBN 0471264180.
- ^ Sturtz, G .; Corbel, B .; Погам, Ж.-П. (1976). "Nouveaux synthons phosphores: Bianions d'hydroxy-1 propene-2 YL фосфонамиды, карбанионы и β d'acides карбоксильные потенциалы". Tetrahedron Lett. 17: 47–50. Дои:10.1016 / S0040-4039 (00) 71319-0.
