Псевдоптерозин А - Pseudopterosin A
 | |
| Имена | |
|---|---|
| Название ИЮПАК (3S,7р,9S, 9ар) -5-Гидрокси-3,6,9-триметил-7- (2-метил-1-пропен-1-ил) -2,3,7,8,9,9a-гексагидро-1ЧАС-фенален-4-ил β-D-ксилопиранозид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C25ЧАС36О6 | |
| Молярная масса | 432.557 г · моль−1 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Псевдоптерозин А это дитерпен гликозид Изолированный от морского хлыста горгонарии Псевдоптерогоргия elisabethae, найденный на Багамах и Флорида-Кис.[1] Псевдоптерозины A-D, которые различаются степенью ацетилирования сахарного кольца, были впервые выделены и описаны в 1986 году.[2] Из этого вида морских животных выделено не менее 25 уникальных дитерпенов.[1] Образцы P. elisabethae с Багамских островов обнаружены более высокие концентрации псевдоптерозинов, чем в популяциях с островов Флорида-Кис, которые имеют большее разнообразие дитерпеновых структур.[3]
Использует
Псевдоптерозины обладают противовоспалительной и анальгетической активностью, их механизм действия отличается от обычных нестероидных противовоспалительных препаратов. НПВП.[4] В коммерческих целях псевдоптерозины обнаруживаются в кремах для кожи в качестве местных противовоспалительных средств.[5]
Биосинтез
Элизабетатриена (2) был идентифицирован как ключевой промежуточный продукт для синтеза класса псевдоптерозинов и seco-псевдоптерозины. Предлагаемый механистический путь синтеза элизабетатриена из геранилгеранилпирофосфат (GGPP, 1), описывается ниже. Элизабетатриен-синтаза, фермент дитерпенциклаза, катализирует превращение дитерпенового GGPP в 10-членный углеродный скелет с последующей миграцией гидрида в направлении бициклической кольцевой системы.[1][6] Этот фермент циклаза был идентифицирован как ключевой фермент в формировании углеродного скелета псевдоптерозинов за один этап. Был предложен альтернативный механизм, в котором сначала образуется шестичленное кольцо, а затем замыкается второе кольцо для бициклической системы.[6]

Биосинтез псевдоптерозинов продолжается ароматизацией до эрогиоргиена (3), два окисления до дигироксиэрогиоргиена (4, тогда 5) и еще одно окисление до орто-гидроксихинона (6). Закрытие кольца (7), повторная ароматизация до (8) и гликозилирование дает псевдоптерозин A (9). Это вероятный путь биосинтеза, и промежуточные звенья 2, 3, 6, 7, и 8 были идентифицированы с помощью радиоизотопных исследований.[1] Был предложен альтернативный механизм без промежуточного гидроксихинона (6). Скорее молекула 3 подвергается двум последующим окислениям на С-6 и С-7 до структуры, напоминающей 8, затем гликозилирование до псевдоптерозина.[6]

Точка ветвления биосинтеза трициклических псевдоптерозинов по сравнению с бициклическими seco-псевдоптерозины встречаются в соединении 11, ароматизированный велосипедный эрогиоргиен. 11 окисляется один раз, затем гидроксилируется с последующим гликолсилированием, чтобы сделать бициклический seco-псевдоптерозины.
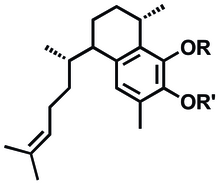
Предлагаемый синтез искусственных противовоспалительных метаболитов смоделирован на основе псевдоптерозинов и основан на бициклическом seco-псевдоптерозиновая структура 6.[1]
Рекомендации
- ^ а б c d е А. Коль, А. Ата, Р. Керр. J. Ind Microbiol Biotechnol (2003) 30: 495-499.
- ^ С. Лук, В. Феникал, Г. Мацумото и Дж. Кларди. J. Org. Chem. (1986) 51: 5140-5145
- ^ А. Коль и Р. Керр. Март Наркотики (2003) 1: 54-65.
- ^ А. Коль, Р. Керр. Arch. Биохим. и Biophys. (2004) 424: 97-104.
- ^ A. Mayer, P. Jacobson, W. Fenical, R. Jabocs и K. Glaser. Науки о жизни (1998) 62: 401-407.
- ^ а б c Р. Керр, А. Коль и Т. Фернс. J. Ind Microbiol Biotech (2006) 33: 532-538.
