Фениллитий - Phenyllithium
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК Фениллитий[1] | |
| Другие имена Фениллитий[нужна цитата ] | |
| Идентификаторы | |
3D модель (JSmol ) | |
| Сокращения | LiPh, PhLi |
| 506502 | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.008.838 |
| Номер ЕС |
|
| 2849 | |
| MeSH | фениллитий |
PubChem CID | |
| |
| |
| Характеристики | |
| LiC 6ЧАС 5 | |
| Молярная масса | 84,045 г моль−1 |
| Внешность | Бесцветные кристаллы |
| Плотность | 828 мг · см−3 |
| Точка кипения | От 140 до 143 ° C (от 284 до 289 ° F, от 413 до 416 K) |
| Реагирует | |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 48,3-52,5 кДж моль−1 |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| R-фразы (устарело) | R14, R17, R23 / 24/25, R48 |
| S-фразы (устарело) | (S1 / 2), S8, S9, S16, S26, S30, S46, S36 / 37/39, S45 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фениллитий или литобензол - это металлоорганический агент с эмпирической формулой C6ЧАС5Ли. Чаще всего он используется в качестве металлирующего агента в органическом синтезе и вместо Реактивы Гриньяра для введения фенильных групп в органический синтез.[2] Кристаллический фениллитий бесцветен; однако растворы фениллития имеют различные оттенки коричневого или красного в зависимости от используемого растворителя и примесей, присутствующих в растворенном веществе.[3]
Структура и свойства
Фениллитий - это литийорганический соединение, образующее моноклинные кристаллы. Твердый фениллитий можно описать как состоящий из димера Li2Ph2 субъединицы. Атомы Li и ipso атомы углерода фенильных колец образуют плоское четырехчленное кольцо. Плоскость фенильных групп перпендикулярна плоскости этой Li2C2 звенеть. Дополнительная сильная межмолекулярная связь возникает между этими димерами фениллития и π-электронами фенильных групп в соседних димерах, что приводит к бесконечной полимерной лестничной структуре.[4]
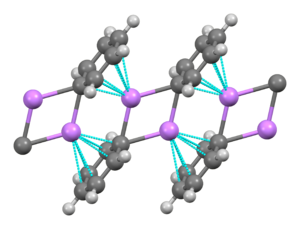
В растворе он принимает различные структуры в зависимости от органического растворителя. В тетрагидрофуран, он уравновешивает состояния мономера и димера. В обычном эфире фениллитий существует в виде тетрамера. Четыре атома Li и четыре ipso углеродных центра занимают чередующиеся вершины искаженного куба. Фенильные группы находятся на гранях тетраэдра и связаны с тремя ближайшими атомами Li.
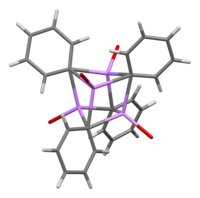
Длина связи C – Li составляет в среднем 2,33 Å. Молекула эфира связывается с каждым из участков Li через атом кислорода. В присутствии LiBr, побочного продукта прямой реакции лития с фенилгалогенидом, [(PhLi • Et2O)4] вместо этого становится [(PhLi • Et2O)3• LiBr). Атом Li в LiBr занимает одну из позиций лития в кластер кубанового типа и атом Br находится в соседнем углеродном узле.[5]
Подготовка
Фениллитий впервые был получен реакцией металлического лития с дифенилртуть:[6]
- (C6Η5)2Ηg + 2Li → 2C6Η5Li + Ηg
Взаимодействие фенилгалогенида с металлическим литием дает фениллитий:
- X-Ph + 2Li → Ph-Li + LiX
Фениллитий можно также синтезировать с помощью реакции обмена металл-галоген:
- н-BuLi + X-Ph → n-BuX + Ph-Li
Преобладающим методом получения фениллития сегодня являются два последних синтеза.
Реакции
Основное использование PhLi - облегчение образования углерод-углеродных связей посредством реакций нуклеофильного присоединения и замещения:
- PhLi + R2C = O → PhR2COLi
2-фенилпиридин получают реакцией фениллития с пиридином, процессом, который влечет за собой путь присоединения-элиминирования:[7]
- C6ЧАС5Li + C5ЧАС5N → C6ЧАС5-C5ЧАС4N + LiH
Рекомендации
- ^ «фениллитий (CHEBI: 51470)». Химические объекты, представляющие биологический интерес (ChEBI). Кембридж, Великобритания: Европейский институт биоинформатики. 2009-01-22. Главный. Получено 2013-06-01.
- ^ Wietelmann, U .; Бауэр, Р. Дж. «Литий и литиевые соединения». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a15_393.
- ^ Gilman, H .; Zoellner, E. A .; Селби, В. М. (1932). «Улучшенная процедура получения литийорганических соединений». Журнал Американского химического общества. 54 (5): 1957–1962. Дои:10.1021 / ja01344a033.
- ^ Dinnebier, R.E .; Behrens, U .; Ольбрих, Ф. (1998). "Фениллитий без основания Льюиса: Определение твердотельной структуры методом синхротронной порошковой дифракции". Журнал Американского химического общества. 120 (7): 1430–1433. Дои:10.1021 / ja972816e.
- ^ Надежда, H .; Мощность, П. П. (1983). «Выделение и кристаллические структуры комплексов эфирата фениллития, не содержащих галогенидов и богатых галогенидами [(PhLi • Et2O)4] и [(PhLi • Et2O)3• LiBr] ». Журнал Американского химического общества. 105 (16): 5320–5324. Дои:10.1021 / ja00354a022.
- ^ Грин, Д. П .; Зуев, Д. (2008). «Фениллитий». Энциклопедия реагентов для органического синтеза. Wiley and Sons. Дои:10.1002 / 047084289X.rp076.pub2. ISBN 978-0471936237.
- ^ Evans, J. C. W .; Аллен, К. Ф. Х. Органический синтез "2-фенилпиридина" (1938), т. 18, стр. 70. Дои:10.15227 / orgsyn.018.0070
