Транспортировка мембранных везикул - Membrane vesicle trafficking
Мембрана везикул торговля людьми в эукариотический клетки животных включают перемещение важных биохимических сигнальных молекул из мест синтеза и упаковки в Тело Гольджи в определенные места «высвобождения» внутри плазмы мембрана секреторной клетки в виде мембраносвязанных микропузырьков Гольджи, называемых мембранные везикулы (Клипы). В этом процессе «упакованные» клеточные продукты высвобождаются / секретируются за пределы клетки через ее плазматическая мембрана. Однако эта везикулярная мембрана сохраняется и повторно используется секреторными клетками. Это явление играет ключевую роль в синаптическом нейротрансмиссия, эндокринный секреция, слизистый секрет, гранулированный продукт секреция от нейтрофилы и др. Ученые за это открытие были награждены Нобелевская премия за 2013 год. прокариотический грамотрицательный В бактериальных клетках транспорт мембранных везикул опосредуется через наноразмерные везикулы, связанные с внешней мембраной бактерий, называемые бактериальные везикулы наружной мембраны (OMV). Однако в этом случае мембрана OMV также секретируется вместе с содержимым OMV за пределы секретно-активных бактерия. Это явление играет ключевую роль во взаимодействиях хозяин-патоген, эндотоксический шок у пациентов, инвазии и инфекция животных / растений, межвидовая конкуренция бактерий, определение кворума, экзоцитоз, так далее.
Движение внутри эукариотических клеток
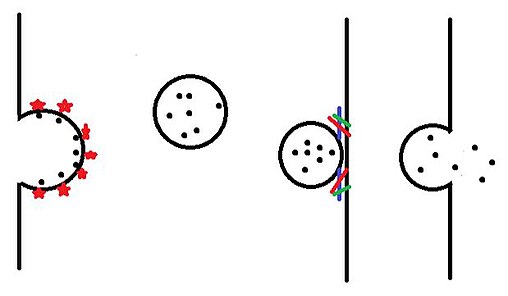
Как только везикулы образуются в эндоплазматический ретикулум и изменен в тело гольджи они направляются в самые разные места внутри ячейки. Пузырьки сначала покидают тело Гольджи и попадают в цитоплазму в процессе, называемом почкованием. Затем везикулы перемещаются к месту назначения с помощью моторные белки. По прибытии везикула соединяется с билипидным слоем в процессе, называемом слияние, а затем освобождает его содержимое.
Почкование
Рецепторы, встроенные в мембрану тела Гольджи, связывают определенный груз (например, дофамин) на просветной стороне везикулы. Эти рецепторы груза затем рекрутируют множество белков, включая другие рецепторы груза и белки оболочки такие как клатрин, COPI и COPII. По мере того как все больше и больше этих покрывающих белков объединяются, они заставляют везикулу отрастать наружу и в конечном итоге вырываются в цитоплазму. Белки оболочки затем попадают в цитоплазму для повторного использования и повторного использования.[1]
Подвижность между клеточными компартментами
Для перемещения между различными компартментами клетки везикулы полагаются на моторные белки. миозин, кинезин (в основном антероградный транспорт) и динеин (в первую очередь ретроградный транспорт). Один конец моторных белков прикрепляется к пузырьку, а другой конец - к любому из них. микротрубочки или микрофиламенты. Затем моторные белки перемещаются путем гидролиза АТФ, который продвигает везикулу к месту назначения.[2]
Док и фьюжн
Когда пузырек приближается к намеченному месту, Белки RAB в мембране везикул взаимодействуют с белками стыковки в месте назначения. Эти стыковочные белки приближают везикулу для взаимодействия с SNARE Комплекс обнаружен в целевой мембране. Комплекс SNARE реагирует с синаптобревин обнаруживается на оболочке пузырьков.[3] Это заставляет мембрану везикул противостоять мембране целевого комплекса (или внешней мембране клетки) и заставляет две мембраны сливаться. В зависимости от того, сливается ли везикула с целевым комплексом или с внешней мембраной, содержимое везикулы затем высвобождается либо в целевой комплекс, либо за пределы клетки.[4]
Примеры у эукариот
- Внутриклеточный трафик происходит между субклеточными компартментами, такими как цистерны Гольджи и мультивезикулярные эндосомы для перевозки растворимых белки как MVs.
- Почкование МВ непосредственно из плазматической мембраны как микровезикулы выпущен за пределы секретарей клетки.
- Экзосомы представляют собой МК, которые могут образовываться внутри внутреннего компартмента, такого как мультивезикулярная эндосома. Экзосомы высвобождаются в конечном итоге за счет слияния этой эндосомы с плазматической мембраной клетки.
- Угон экзосомальных механизмов некоторыми вирусами, такими как ретровирусы, при этом вирусы зарождаются внутри мультивезикулярных эндосом и впоследствии секретируются в виде экзосом.
Все эти типы (1-4) способов транспортировки мембранных пузырьков, происходящие в эукариотических клетках, были объяснены схематично.[5]
У прокариот
В отличие от эукариоты, мембранный везикулярный трафик в прокариоты является новой областью интерактивной биологии для внутривидовой (определение кворума) и межвидовой передачи сигналов на интерфейс хозяин-патоген, поскольку прокариоты лишены внутренней мембранной компартментализации их цитоплазма.
На протяжении более четырех десятилетий культуры грамм отрицательный микробы выявили наличие наноразмерных мембранных везикул. Роль мембранных везикул в патогенных процессах подозревалась с 1970-х годов, когда они наблюдались в зубном налете десен. электронная микроскопия.[6] Предполагалось, что эти везикулы способствуют адгезии бактерий к поверхности эпителиальных клеток хозяина.[7] Их роль в инвазии клеток-хозяев животных in vivo затем был продемонстрирован.[8] При межбактериальных взаимодействиях OMV выделяются Синегнойная палочка микробы сливаются с внешней мембраной других грамотрицательных микробов, вызывая их бактериолиз; Эти OMV также могут лизировать грамположительные микробы.[9] Роль OMV в Helicobacter pylori заражение человек первичные антральные эпителиальные клетки, как модель, очень напоминающая человеческий желудок, также были подтверждены[10] Вакцина-содержащие OMV также могут быть обнаружены в слизистой оболочке желудка человека, инфицированной H. pylori..[11] Сальмонелла Было также показано, что OMV играют непосредственную роль в инвазии эпителиальных клеток подвздошной кишки кур. in vivo в 1993 году (ссылка 4) и позже, при захвате защиты макрофаги в вспомогательную службу для репликации патогенов и последующего апоптоза инфицированных макрофагов при брюшнотифозной инфекции животных.[12] Эти исследования привлекли внимание к OMV в перемещение мембранных пузырьков и показал, что это явление участвует во многих процессах, таких как генетическая трансформация, определение кворума, арсенал конкуренции среди микробов и т. д. и вторжение, инфекция иммуномодуляция и др. животных-хозяев.[6] Уже был предложен механизм генерации OMV с участием грамотрицательных микробов, расширение карманов периплазма (по имени, периплазматические органеллы) из-за накопления секрета бактериальных клеток и их отщипывания в виде пузырьков, связанных с внешней мембраной (OMV) на линиях образования «мыльного пузыря» с пузырьковой трубкой, и дальнейшего слияния или поглощения диффундирующих OMV клетками-хозяевами / мишенями (рис. . 2).[13]


В заключении, перемещение мембранных пузырьков через OMV грамотрицательных организмов, пересекает виды и царства, включая царство растений[14] - в сфере передача сигналов от клетки к клетке.
Смотрите также
- Бактериальные везикулы наружной мембраны
- Эндоцитоз
- Экзоцитоз
- Взаимодействие хозяин-патоген
- Секреторный путь
- Пузырьки (биология и химия)
- Вирулентность
использованная литература
- ^ Бонифачино, Хуан (январь 2004 г.). «Механизмы почкования и слияния пузырьков». Ячейка. 116 (2): 153–166. Дои:10.1016 / S0092-8674 (03) 01079-1. PMID 14744428.
- ^ Хенли Х., Стамнес М (май 2007 г.). «Регулирование подвижности везикул на основе цитоскелета». Письма FEBS. 581 (11): 2112–8. Дои:10.1016 / j.febslet.2007.01.094. ЧВК 1974873. PMID 17335816.
- ^ Нанавати С., Маркин В.С., Оберхаузер А.Ф., Фернандес Дж.М. (октябрь 1992 г.). «Пора слияния экзоцитоза, смоделированная как липидная пора». Биофизический журнал. 63 (4): 1118–32. Bibcode:1992BpJ .... 63.1118N. Дои:10.1016 / S0006-3495 (92) 81679-X. ЧВК 1262250. PMID 1420930.
- ^ Папахаджопулос Д., Нир С., Дюзгюнес Н. (апрель 1990 г.). «Молекулярные механизмы индуцированного кальцием слияния мембран». Журнал биоэнергетики и биомембран. 22 (2): 157–79. Дои:10.1007 / BF00762944. PMID 2139437.
- ^ Тери С., Островски М., Сегура Е. (август 2009 г.). «Мембранные везикулы как конвейеры иммунных ответов». Обзоры природы. Иммунология. 9 (8): 581–93. Дои:10.1038 / nri2567. PMID 19498381.
- ^ а б Эллис Т.Н., Куэн М.Дж. (март 2010 г.). «Вирулентность и иммуномодулирующая роль везикул наружной мембраны бактерий». Обзоры микробиологии и молекулярной биологии. 74 (1): 81–94. Дои:10.1128 / MMBR.00031-09. ЧВК 2832350. PMID 20197500.
- ^ Халхул Н., Колвин-младший (февраль 1975 г.). «Ультраструктура бактериального налета, прикрепленного к десне человека». Архивы оральной биологии. 20 (2): 115–8. Дои:10.1016/0003-9969(75)90164-8. PMID 1054578.
- ^ Яшрой RC (1993). «Электронно-микроскопические исследования поверхностных пилей и пузырьков Сальмонелла 3,10: r: - организмы ». Индийский журнал наук о животных. 63 (2): 99–102.
- ^ Кадуругамува Дж. Л., Беверидж Т. Дж. (Май 1996 г.). «Бактериолитический эффект мембранных везикул Pseudomonas aeruginosa на другие бактерии, включая патогены: концептуально новые антибиотики». Журнал бактериологии. 178 (10): 2767–74. Дои:10.1128 / jb.178.10.2767-2774.1996. ЧВК 178010. PMID 8631663.
- ^ Heczko U, Smith VC, Mark Meloche R, Buchan AM, Finlay BB (ноябрь 2000 г.). «Характеристики прикрепления Helicobacter pylori к первичным клеткам антрального эпителия человека». Микробы и инфекции. 2 (14): 1669–76. Дои:10.1016 / с1286-4579 (00) 01322-8. PMID 11137040.
- ^ Fiocca R, Necchi V, Sommi P, Ricci V, Telford J, Cover TL, Solcia E (июнь 1999 г.). «Высвобождение вакуолизирующего цитотоксина Helicobacter pylori посредством как специфического пути секреции, так и образования везикул наружной мембраны. Поглощение высвобожденного токсина и везикул эпителием желудка». Журнал патологии. 188 (2): 220–6. Дои:10.1002 / (sici) 1096-9896 (199906) 188: 2 <220 :: aid-path307> 3.0.co; 2-c. PMID 10398168.
- ^ Яшрой RC (2000). "Похищение макрофагов Сальмонелла (3,10: r :-) через экзоцитотическую передачу сигналов, подобных секреции «типа III»: механизм инфицирования подвздошной кишки курицы ». Индийский журнал птицеводства. 35 (3): 276–281.
- ^ YashRoy RC (июнь 2003 г.). «Интоксикация эукариотических клеток грамотрицательными патогенами: новая бактериальная модель нановезикулярного экзоцитоза, связанного с внешней мембраной, для системы секреции типа III». Международная токсикология. 10 (1): 1–9.
- ^ Бахар О., Прюитт Р., Луу Д.Д., Швессингер Б., Дауди А., Лю Ф., Руан Р., Фонтейн-Бодин Л., Коебник Р., Рональд П. (2014). «Белок Xanthomonas Ax21 обрабатывается общей секреторной системой и секретируется вместе с везикулами внешней мембраны». PeerJ. 2: e242. Дои:10.7717 / peerj.242. ЧВК 3897388. PMID 24482761.
внешние ссылки
- Нобелевская премия 2013 года по физиологии и медицине - пресс-релиз http://www.nobelprize.org/nobel_prizes/medicine/laureates/2013/press.html
- Обнаружение везикулярного экзоцитоза у прокариот https://www.researchgate.net/publication/230793568_Discovery_of_vesicular_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub
