Эпоксидирование Хулиа – Колонна - Juliá–Colonna epoxidation
В Эпоксидирование Хулиа – Колонна асимметричный поли-лейцин катализируемый нуклеофильный эпоксидирование электронодефицитных олефинов в трехфазная система. О реакции сообщил Себастьян Хулиа в Химический институт Саррии в 1980 г.[1] с дальнейшей разработкой Хулией и Стефано Колонна (Istituto di Chimica Industriale dell'Università, Милан, Италия).[2]
 Эпоксидирование халкона по Хулиа-Колонна протекает с поли-L-лейцином и перекисью водорода в обычных трехфазных условиях. Изображение адаптировано из Juliá et al.[2]
Эпоксидирование халкона по Хулиа-Колонна протекает с поли-L-лейцином и перекисью водорода в обычных трехфазных условиях. Изображение адаптировано из Juliá et al.[2]
В исходном трехфазном протоколе халкон субстрат растворим в органической фазе, обычно толуол или четыреххлористый углерод. Щелочной окислитель пероксид водорода растворим в основном в водной фазе, и реакция происходит в слое нерастворимого полимера на границе раздела двух фаз. Альтернатива двухфазный и монофазный протоколы были разработаны с увеличенной доступностью субстрата и скоростью реакции.[3][4]
Эффективный энантиоселективный каталитическое эпоксидирование в мягких условиях очень полезно для синтеза. Не только эпоксиды эффективные синтоны для ряда преобразований, они значительно присутствуют в структурах натуральных продуктов. Кроме того, реакция была эффективно увеличена до промышленных уровней, при этом работа проводилась, в частности, Байер и Evonik. Наконец, подобная ферментам активность полиаминокислотных сегментов наводит на мысль о роли реакции в пребиотическое происхождение жизни.[5][6]
Механизм реакции
Эпоксидирование Хулиа – Колонна является асимметричное нуклеофильное эпоксидирование электронодефицитных олефины такие как α, β-ненасыщенные кетоны. Общий механизм, показанный на Рисунке 2, применим ко всем нуклеофильным эпоксидированию, но в этой реакции он контролируется полилейциновым катализатором.

В гидропероксид анион и халкон собираются в комплекс с поли-лейциновым катализатором перед реакцией с образованием промежуточного енолята пероксида. Промежуточный продукт впоследствии закрывается, что регулируется структурой катализатора, с образованием стереоселективного эпоксидного продукта.
Образование тройного комплекса


Полилиейциновые нити демонстрируют ферментоподобная кинетика с зависимостью первого порядка от гидропероксид-аниона (KM= 30 мМ) и олефиновый субстрат (KM= 110 мМ). Кинетическое исследование предполагает, что реакция протекает путем случайного стационарного образования тройного соединения (полилейцин + гидропероксид-анион + олефин) сложный. Оба субстрата должны связываться до реакции, и хотя любой из них может связываться первым, начальное связывание гидропероксида является кинетически предпочтительным. За быстрым равновесием, обеспечивающим образование комплекса, следует ограничивающее скорость образование пероксида. энолировать (Рисунок 3).[5][8]
Механическое происхождение стереоселективности
Все реагенты связываются с полилейциновым катализатором до реакции с образованием промежуточного енолята гидропероксида. Катализатор ориентирует реагенты и, что еще более важно, промежуточный енолят пероксида посредством серии водородная связь взаимодействия с четырьмя N-концевыми аминогруппами в поли-лейцине α-спираль. Хотя были предложены другие модели,[9] расчеты Келли и др. предположили, что NH-2, NH-3 и NH-4 образуют равнобедренный треугольник, доступный для водородной связи в качестве промежуточного стабилизирующего оксианионная дыра. В то время как олефин связывается либо с эндо или экзо сторона спирали стерически разрешена, только эндо Связывание ориентирует группу NH-4 на связывание с гидропероксидным фрагментом, позволяя замещение гидроксида на последней стадии реакции (фиг. 4).[7]
Катализатор
Выбор полиаминокислот
Энантиоселективность максимизируется полиаминокислотными последовательностями, содержащими наибольшее количество α-спиралей; к ним относятся поли-лейцин и поли-аланин.[1] Доступны как поли-L-, так и поли-D-аминокислоты, которые вызывают противоположную стереоиндукцию.[10]
Генерация катализатора

Исходные поли-лейциновые катализаторы были образованы реакцией лейцин-N-карбоксиангидридов с инициатором, таким как амин, спирт или вода (рис. 5).[2] В трехфазных системах полимерный катализатор должен быть пропитан органическим растворителем и раствором пероксида для образования геля перед реакцией.[11]–Особенно в двухфазных системах время реакции может быть уменьшено, а энантиоселективность увеличена за счет активации катализатора с помощью NaOH перед реакцией. Кроме того, в двухфазные системы полимер может быть иммобилизован на полистирол, полиэтиленгликоль (PEG), или кремнезем гель и превратился в пасту.[4]
Вторичная структура катализатора
Активный компонент катализатора предполагает α-спиральный структура, в которой четыре-пять N-концевых остатков активно участвуют в катализе. В то время как активные катализаторы были получены из скалемический лейцин, последовательный энантиомерный контент должен поддерживаться через N-концевую область, чтобы придать структуре соответствующую управляемость.[10] Хотя наибольшая энантиоселективность первоначально наблюдалась при n = 30 остатках,[2] 10-мерный полипептид лейцина имеет достаточную длину для обеспечения значительной энантиоселективности[10] После усовершенствования исходной процедуры для полимеров с более низкой молекулярной массой наблюдалась большая энантиоселективность, предположительно из-за большего количества доступных N-концов на используемую массу.[4]
Объем
Эпоксидирование по Хулиа – Колонна электронодефицитных олефинов первоначально было продемонстрировано с халконами, но вскоре оно было распространено на другие системы с электроноакцепторными фрагментами, такими как α, β-ненасыщенные кетоны, сложные эфиры и амиды.[1][2] Реакция также продемонстрировала эффективность с сульфон субстратов, и объем реакции расширяется с дальнейшими методологическими исследованиями.[12]
Однако некоторые классы субстратов не подходят для эпоксидирования Juliá – Colonna. Они включают:[10]
- соединения, чувствительные к гидроксиду.
- соединения с кислотными протонами в α- или α ’положениях.
- электронно-богатые олефины.
Нуклеофильное эпоксидирование естественно дополняет электрофильное эпоксидирование, такое как Эпоксидирование по методу Sharpless и Эпоксидирование Якобсена.
Стереоселективность
Структура катализатора
Стереоиндукция эпоксидирования Хулиа-Колонна зависит от α-спиральной вторичной структуры полилиейцинового катализатора. Хотя для этой индукции необходима последовательная стереохимия N-концевых аминокислот, даже 10-мерный полипептид лейцина имеет достаточную длину для обеспечения значительной энантиоселективности.[10]
Хиральная амплификация с помощью скалемических катализаторов
Эта зависимость только от N-концевой области спирали наиболее выражена при энантиоселективной стереоиндукции скалемическими катализаторами. Даже 40% энантиомерный избыток L по сравнению с D-лейцином при образовании катализатора может дать такой же энантиомерно обогащенный эпоксид, что и энантиочистый катализатор. Взаимосвязь между энантиочистностью катализатора и продукта может быть точно выражена с помощью Бернуллианский статистическая модель: eeп= (Lп-Dп) / (Lп+ Dп), где L и D - пропорции L- и D-лейцина, используемые для получения каталитических полимеров, а n - длина каталитического компонента.[5][6]
Хиральные аминокислоты, включая лейцин, были получены в экспериментах с электрическим разрядом, имитирующих пребиотические условия на Земле, и они были обнаружены в скалемических смесях в метеоритах. Было высказано предположение, что фрагменты полиаминокислот, аналогичные катализатору Хулиа-Колонна, могли быть инициированы имидазол или цианид производные, и полученные фрагменты, возможно, сыграли каталитическую роль в происхождении энантиомерного обогащения, повсеместно распространенного в жизни сегодня.[5]
Вариации
Катализаторы с привитым кремнием
Кремнезем Было показано, что привитой полилейцин эффективно катализирует эпоксидирование α, β-ненасыщенных ароматических кетонов. Прививка диоксида кремния позволяет легко извлекать катализатор с незначительной потерей активности и особенно полезна для масштабных реакций.[13]
Двухфазные (неводные) условия реакции
Для альтернативного двухфазного протокола олефиновый субстрат растворяют в тетрагидрофуран (THF) вместе с мочевина водород перекись (UHP) окислитель и основание третичного амина, такое как 8-диазабицикло [5.4.0] ундец-7-ен (DBU). Иммобилизованный полимерный катализатор образует пасту, которая служит центром реакции. Двухфазные условия реакции расширяют диапазон енонов, к которым может применяться реакция.[3]
Однофазные условия реакции с полилейцином, иммобилизованным на ПЭГ
Растворимый инициатор O, O'-бис (2-аминоэтил) полиэтиленгликоль (диаминоПЭГ) для сборки полилейцина использовали для создания триблока, растворимого в ТГФ. полимер. Использование этого катализатора в гомогенная реакция условия позволили значительно расширить методологию на α, β-ненасыщенные кетоны, диены, и бис-диены.[4]
Сокатализ с фазовым переносом
Добавление бромид тетрабутиламмония как катализатор межфазного переноса резко увеличивает скорость реакции. Предполагается, что сокатализатор увеличивает концентрацию пероксидного окислителя в органической фазе, обеспечивая более эффективный доступ к реакционноспособному тройному комплексу.[14] Эти условия были разработаны для применения в двухфазных системах, но также действуют и для трехфазных систем и используются до шкалы 100 г.[5][12]
Увеличить масштаб
Иммобилизованные катализаторы использовались в мембранные реакторы и исследуются для применения в реакторах с неподвижным слоем непрерывного потока.[11]
Приложения к синтезу
Полный синтез дилтиазема
Adger et al. использовали двухфазное эпоксидирование Хулиа – Колонна с иммобилизованным поли-L-лейцином (I-PLL) и перекисью водорода мочевины (UHP) и 8-диазабицикло [5.4.0] ундец-7-еном (DBU) в качестве ключевого шага в эффективный синтез Дилтиазем (Рисунок 6.) Дилтиазем - это коммерчески доступный фармацевтический препарат, который действует как кальциевый канал блокиратор.[11]

Полный синтез (+) - клаузинамида
Каппи и др. использовали эпоксидирование Juliá – Colonna с иммобилизованным PEG поли-L-лейцином (PEG-PLL) и перекисью водорода DABCO (DABCO-H2О2) или пероксид мочевины (UHP) в миниатюрной проточной реакторной системе с неподвижным слоем (рис. 7.). Этот протокол был использован для синтеза (+) - клаузинамида в качестве доказательства концепции разработки нового протокола реакции; (+) - клаузинамид проявляет антиамнезиакальную и гепатопротекторную активность.[15]
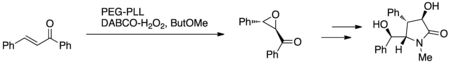
Полный синтез (+) - гониотриола 7, (+) - гониофуфурона 8, (+) - 8-ацетилгониотриола 9 и гонио-пипирона
Chen et al. использовали протокол двухфазного эпоксидирования Хулиа – Колонна с мочевиной перекисью водорода (UHP), поли-L-лейцином (PLL) и 8-диазабицикло [5.4.0] ундец-7-еном (DBU) в качестве ключевого шага в синтезе семейство стириллактонов, выделенных из Гониоталамус гигантский (Рисунок 8.) Эти соединения, включая (+) - гониотриол 7, (+) - гониофуфурон 8, (+) - 8-ацетилгониотриол 9 и гонио-пипирон, продемонстрировали цитотоксический активность против опухолевых клеток человека.[16]

Смотрите также
использованная литература
- ^ а б c Juliá, S. N .; Masana, J .; Вега, Дж. К. (1980). ""Синтетические ферменты ". Высокостереоселективное эпоксидирование халкона в трехфазной системе толуол-вода-поли (S) -аланин]". Angewandte Chemie International Edition на английском языке. 19 (11): 929. Дои:10.1002 / anie.198009291.
- ^ а б c d е Юлия, Себастьян; Гиксер, Джоан; Масана, Жауме; Рокас, Хосе; Колонна, Стефано; Аннузиата, Рита; Молинари, Генриетта (1982). «Синтетические ферменты. Часть 2. Каталитическое асимметричное эпоксидирование с помощью полиаминокислот в трехфазной системе». J. Chem. Soc., Perkin Trans. 1: 1317–1324. Дои:10.1039 / P19820001317.
- ^ а б Аллен, Джоан В .; Бержерон, Софи; Гриффитс, Мэтью Дж .; Мукерджи, Шубхасиш; Робертс, Стэнли М .; Уильямсон, Натали М .; Ву, Л. Эдуардо (1998). «Реакции асимметричного эпоксидирования Хулиа – Колонна в неводных условиях: быстрые, высоко регио- и стереоселективные превращения с использованием дешевого, пригодного для повторного использования катализатора». J. Chem. Soc., Perkin Trans. 1 (19): 3171–3180. Дои:10.1039 / A805407J.
- ^ а б c d Флуд, Роберт В .; Геллер, Томас П .; Петти, Сара А .; Робертс, Стэнли М .; Скидмор, Джон; Волк, Мартин (2001). «Эффективное асимметричное эпоксидирование α, β-ненасыщенных кетонов с использованием растворимого трехблочного полиэтиленгликоль-полиаминокислотного катализатора». Орг. Lett. 3 (5): 683–6. Дои:10.1021 / ol007005l. PMID 11259036.
- ^ а б c d е ж Carrea, G; Колонна, S; Келли, Д.; Ласкано, А; Оттолина, G; Робертс, S (2005). «Полиаминокислоты как синтетические ферменты: механизм, применение и значение для пребиотического катализа». Тенденции в биотехнологии. 23 (10): 507–13. Дои:10.1016 / j.tibtech.2005.07.010. PMID 16085328.
- ^ а б Келли, Дэвид Р .; Кроткий, Аластер; Робертс, Стэнли М. (2004). «Хиральная амплификация полипептидами и ее значение для пребиотического катализа». Chem. Comm. (18): 2021–2. Дои:10.1039 / B404379K. PMID 15367955.
- ^ а б Келли, Д. Р .; Робертс, С.М., Механизм асимметричного эпоксидирования, катализируемого полилейцином ». Chem. Comm. 2004, (18), 2018-2020. Дои:10.1039 / B404390C
- ^ Carrea, G .; Colonna, S .; Кроткий, A.D .; Ottolina, G .; Робертс, С. М., "Кинетика окисления халкона пероксидным анионом, катализируемого поли-L-лейцином". Chem. Comm. 2004, (12), 1412-1413. Дои:10.1039 / B401497A
- ^ Berkessel, A .; Gasch, N .; Glaubitz, K .; Кох, С., «Высокоэнантиоселективное эпоксидирование енона, катализируемое короткими твердофазными пептидами: доминирующая роль спиральности пептида». Орг. Lett. 2001, 3 (24), 3839–3842. Дои:10.1021 / ol0166451
- ^ а б c d е Bentley, P.A .; Каппи, М. В .; Flood, R.W .; Робертс, С. М .; Смит, Дж. А., К механистическому пониманию асимметричного эпоксидирования по Джулиа-Колонна α, β-ненасыщенных кетонов с использованием полилейцина дискретной длины. Tetrahedron Lett. 1998, 39 (50), 9297–9300. Дои:10.1016 / S0040-4039 (98) 02090-5
- ^ а б c d Adger, B.M .; Barkley, J. V .; Bergeron, S .; Каппи, М. В .; Flowerdew, B.E .; Jackson, M.P .; McCague, R .; Nugent, T. C .; Робертс, С. М., "Улучшенная процедура асимметричного эпоксидирования Джулиа-Колонна α, β-ненасыщенных кетонов: полный синтез дилтиазема и боковой цепи Таксола (TM)". J. Chem. Soc.-Perkin Trans. 1 1997, (23), 3501–3507. Дои:10.1039 / A704413E
- ^ а б Lopez-Pedrosa, J.M .; Pitts, M. R .; Робертс, С. М .; Saminathan, S .; Whittall, J., "Асимметричное эпоксидирование некоторых арилалкенилсульфонов с использованием модифицированной процедуры Джулиа-Колонна". Tetrahedron Lett. 2004, 45 (26), 5073–5075. Дои:10.1016 / j.tetlet.2004.04.190
- ^ Yi, H .; Zou, G .; Li, Q .; Chen, Q .; Tang, J .; He, M. Y., «Асимметричное эпоксидирование альфа, бета-ненасыщенных кетонов, катализируемое привитыми диоксидом кремния поли- (L) -лейциновыми катализаторами». Tetrahedron Lett. 2005, 46 (34), 5665–5668. Дои:10.1016 / j.tetlet.2005.06.096
- ^ Геллер, Т .; Герлах, А .; Kruger, C.M .; Милитцер, Х.С., «Новые условия реакции эпоксидирования Джулиа-Колонна, обеспечивающие эффективный доступ к хиральным, нерацемическим эпоксидам». Tetrahedron Lett. 2004, 45 (26), 5065–5067. Дои:10.1016 / j.tetlet.2004.04.188
- ^ а б Каппи, М. В .; Chen, W. P .; Flood, R.W .; Liao, Y. W .; Робертс, С. М .; Skidmore, J .; Smith, J. A .; Уильямсон, Н. М., "Новые процедуры асимметричного эпоксидирования -Colonna: синтез (+) - клаузинамида". Chem. Comm. 1998, (10), 1159-1160. Дои:10.1039 / A801450G
- ^ а б Chen, W. P .; Робертс, С. М., «Асимметричное эпоксидирование Джулии-Колонны фурилстирилкетона как путь к промежуточным соединениям в природные стириллактоны». J. Chem. Soc.-Perkin Trans. 1 1999, (2), 103–105. Дои:10.1039 / A808436J

