Межмолекулярные карбеноидные циклопропанирования, катализируемые металлами - Intermolecular metal-catalyzed carbenoid cyclopropanations
Межмолекулярные карбеноидные циклопропанирования, катализируемые металлами находятся органические реакции что приводит к формированию циклопропан кольцо из металла карбеноид вид и алкен.[1] в Реакция Симмонса – Смита вовлеченный металл - цинк.
Вступление
Циклопропаны могут быть образованы посредством реакции карбеноида металла (образованного в результате реакции диазосоединения с переходным металлом) и олефина. Хотя внутримолекулярный вариант этой реакции известен с 1961 г.,[2] химио- и стереоселективный межмолекулярный реакции циклопропанирования, катализируемые металлами, с использованием диазокарбонильные соединения более свежие. Комплексы карбоксилата родия, такие как тетраацетат диродия, чаще всего используются для катализа этого превращения. Были разработаны энантиоселективные циклопропанирования, в которых обычно используются предварительно сформированные хиральные карбоксилатные комплексы родия, полученные из хиральных карбоксилатных лигандов.[3]
(1)

Механизм и стереохимия
Преобладающий механизм
Окончательные механистические исследования циклопропанирования, катализируемого родием, отсутствуют. Однако механизм был рационализирован на основе распределения продукта и стереоселективности.[4] Атака диазосоединения на металлический центр генерирует цвиттерионный металл-алкильный комплекс, который вытесняет газообразный азот с образованием промежуточного соединения карбена металла. Согласованное добавление карбена металла к олефину (без прямой координации олефина с металлом) дает наблюдаемый циклопропановый продукт.[5] Конфигурация олефина сохраняется на протяжении всего процесса;[6] однако карбены металлов с гетеротопными гранями могут образовывать смесь диастереомеров, как показано справа от уравнения. (2).
(2)

Конфигурация продукта определяется траекторией приближения олефина к карбену металла. В реакциях монозамещенных карбенов металлов с концевыми олефинами олефин, вероятно, приближается к "концевому" (с двойной углерод-углеродной связью олефина, почти параллельной двойной связи металл-углерод карбена) с олефиновой группой R, направленной в сторону от заместителя карбена.[7] Вторая модель переходного состояния была предложена для реакций винилзамещенных карбенов. В этой модели олефин приближается "бок о бок" (с двойной углерод-углеродной связью олефина, перпендикулярной двойной связи металл-углерод карбена) с олефиновой группой R вдали от винильной группы.[8]
Стереоселективные варианты
Способы стереоселективного синтеза циклопропанов из диазокарбонильных соединений и олефинов основаны либо на использовании предварительно образованных хиральных родиевых катализаторов, либо на хиральных вспомогательных веществах диазокарбонильного соединения. Например, Rh2[S-DOSP]4 является высокоэффективным катализатором энантиоселективного циклопропанирования алкенов.[9]
(3)

Хиральные вспомогательные вещества, полученные из легко доступных хиральных спиртов (таких как пантолактон), могут использоваться для диастереоселективного циклопропанирования диазоэфирами.[10]
(4)

Объем и ограничения
Циклопропанирование олефинов диазокарбонильными соединениями обычно осуществляется с использованием комплексов карбоксилата родия, хотя изначально использовалась медь.[11] Сфера применения олефинов, как правило, довольно широка - богатые электронами,[12] нейтральный[13] и бедный электронами[14] все олефины были эффективно циклопропанированы с использованием каталитических систем на основе родия. В этом разделе описаны различные классы диазокарбонильных соединений, которые реагируют с олефинами при родиевом катализе с образованием циклопропанов.
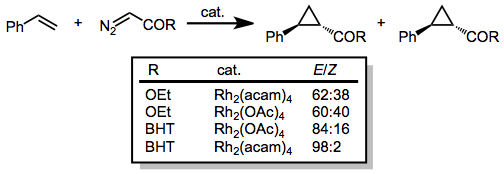
Диазоацетаты, которые имеют единственный карбонильный заместитель, присоединенный к диазоуглероду, были использованы для циклопропанирования широкого ряда олефинов. Диастереоселективность для (E) циклопропан увеличивается с увеличением размера сложноэфирной группы. Кроме того, добавление электронной плотности к катализатору (например, путем замены ацетатных лигандов на ацетамид, acam) увеличивает диастереоселективность реакции.[15]
(5)
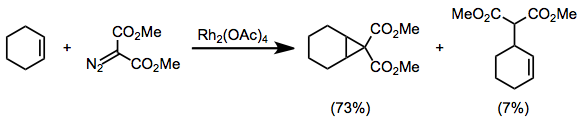
Диазокарбонильные соединения, замещенные двумя электроноакцепторными группами, такие как диазомалонаты, склонны к побочным реакциям в условиях циклопропанирования. [3 + 2] Циклоприсоединение[16] и вставка C-H[17] побочные продукты не наблюдались.
(6)
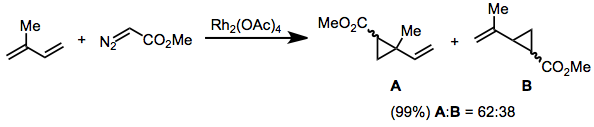
Диазоацетаты, замещенные винильной или арильной группой на диазоуглероде, не реагируют по отношению к транс-алкены. Этот результат был объяснен с помощью модели переходного состояния в формуле. (2). Реакции этих субстратов очень селективны в отношении (E) изомер циклопропана.[18]
(7)

Винилдиазоацетаты реагируют с диенами с образованием дивинилциклопропанов, которые подвергаются перегруппировке Коупа с образованием циклогептадиенов.[19] Предпочтительно реагирует более замещенная двойная связь диена.[20]
(8)

(9)
Фуранс аналогичным образом реагируют с винилдиазоацетатами, хотя промежуточный циклопропан может превращаться либо в продукт перегруппировки Коупа, либо в открытое ненасыщенное карбонильное соединение. Распределение этих продуктов сильно зависит от структуры замещения фурана.[21]
(10)

Пирролы реагируют с винилдиазоацетатами с образованием циклогептадиенов с мостиковой связью через азот. Использование метиллактата в качестве хирального вспомогательного вещества к винилдиазоацетату привело к умеренной диастереоселективности в тандемном циклопропанировании / перегруппировке Коупа Boc-защищенного пиррола.[22]
(11)

Синтетические приложения
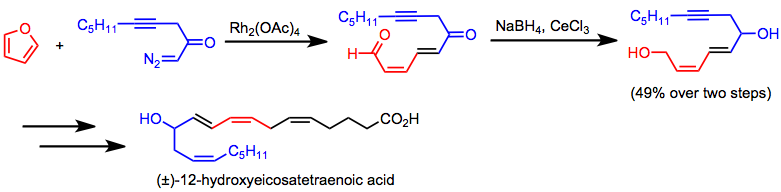
Энантиоселективное межмолекулярное циклопропанирование применялось для синтеза хиральных циклопропановых антибиотиков, таких как циластатин.[23](12)Тандемное циклопропанирование / фрагментация является ключевым этапом в синтезе 12-гидроксиэйкозатетраеновой кислоты.[24]
(12)
Сравнение с другими методами
Циклопропанирование Симмонса-Смита, в котором используются карбены, полученные из диэтилцинка и дииодметана, является популярной альтернативой циклопропанированию, катализируемому родием. В присутствии хирального диамина циклопропанирование Симмонса-Смита является энантиоселективным; однако селективность не так высока, как у соответствующих реакций, катализируемых родием.[25]
(13)

Замещенные карбеноиды цинка могут быть получены из соответствующих кетонов или альдегидов по последовательности, аналогичной механизму Редукция Клемменсена. Циклопропанирование олефинов этими промежуточными продуктами происходит с умеренной диастереоселективностью и выходом.[26]
(14)

Другие диазосоединения, помимо диазокарбонильных соединений, были использованы для катализируемых родием циклопропанирования;[27] однако с этими субстратами гораздо труднее обращаться и они нестабильны, чем диазокарбонильные соединения. Таким образом, они не получили широкого распространения в органическом синтезе.
(15)

Условия и методика экспериментов
Типичные условия
Следует проявлять особую осторожность при обращении с диазосоединениями, которые являются токсичными и потенциально взрывоопасными. Реакции следует проводить в хорошо вентилируемом вытяжном шкафу за защитным кожухом.
Карбоксилатные комплексы родия (II) легко получаются и неограниченно стабильны на воздухе. Димеризация карбена представляет собой серьезную проблему в этих реакциях, но ее можно решить путем медленного добавления диазосоединения или использования большого избытка алкена. Реакцию обычно проводят в инертной атмосфере в безводных условиях, и наиболее распространенным растворителем является дихлорметан. Однако энантиоселективность асимметричных циклопропанирований может сильно зависеть от растворителя.[28]
Пример процедуры[9]
(16)

Смесь стирола (44,2 г, 424 ммоль) и Rh2(S-ДОСП)4 (1,58 г, 0,85 ммоль) в пентане (350 мл) перемешивали при -78 ° в атмосфере аргона. К этому раствору добавляли метил (E) -2-диазо-4-фенил-3-бутеноат (17,2 г, 84,8 ммоль) в пентане (0,12 M) в течение 30 минут, и реакционную смесь затем перемешивали при -78 ° в течение 24 часов. Затем смесь концентрировали. в вакууме, и остаток очищали на диоксиде кремния, используя эфир / петролейный эфир (от 0: 100 до 10:90) в качестве элюента, с получением (1S,2S) -метил 2β-фенил-1β- [2- (Z) -стирил] циклопропан-1α-карбоксилат (16,05 г, 68%) в виде белого твердого вещества (т.пл. 57-60 °; 98% ее); ИК (CHCl3) 3110, 3090, 3060, 2980, 2950, 2880, 1735 см – 1; 1H ЯМР (148) (CDCl3) 1,85 (дд, J = 7,3, 5,1 Гц, 1 H), 2,05 (дд, J = 9,1, 5,1 Гц, 1 H), 3,04 (дд, J = 9,1, 7,3 Гц, 1 H), 3,77 (с, 3 H), 6,15 (д, J = 15,9, 1 H), 6,37, (д, J = 15,9 Гц, 1 H), 7,12–7,28 (м, 10 H); 13C ЯМР (CDCl3) 18,5, 33,2, 34,9, 52,3, 124,0, 126,1, 126,7, 127,2, 127,9, 128,3, 129,0, 133,0, 135,4, 137,0, 174,1; [α] 25D - 166 ° (c 1,1, CHCl3); Анальный. Расчет. для C19ЧАС18О2: C, 81,99; H 6,52. Найдено: C 81,74; H 6,53.
Рекомендации
- ^ Дэвис, Х. М. Л .; Антулинакис, Э. Орг. Реагировать. 2001, 57, 1. Дои:10.1002 / 0471264180.or057.01
- ^ Burke, S.D .; Гриеко, П.А. Орг. Реагировать. 1979, 26, 361.
- ^ Сингх, В. К .; Арпита, Д .; Секар, Г. Синтез 1997, 137.
- ^ Дойл, М. П. Соотв. Chem. Res. 1986, 19, 348.
- ^ Doyle, M. P .; McKervey, M.A .; Е, Т. Ин Современные каталитические методы органического синтеза с диазосоединениями: от циклопропанов до илидов; Wiley: New York, 1998, стр. 163-220.
- ^ Дойл, М. П. Chem. Ред. 1986, 86, 919.
- ^ Doyle, M. P .; Griffin, J. H .; Багери, В .; Доров, Р. Л. Металлоорганические соединения 1984, 3, 53.
- ^ Дэвис, Х. М. Л. Curr. Орг. Chem. 1998, 2, 463.
- ^ а б Дэвис, Х. М. Л .; Bruzinski, P.R .; Lake, D. H .; Kong, N .; Фолл, М. Дж. Варенье. Chem. Soc. 1996, 118, 6897.
- ^ Дэвис, Х. М. Л .; Huby, N.J.S .; Cantrell, W. R., Jr .; Олив, Дж. Л. Варенье. Chem. Soc. 1993, 115, 9468.
- ^ Дэйв, В .; Варнхофф, Э. Орг. Реагировать. 1970, 18, 217.
- ^ Пока что.; МакКервей, М. Chem. Ред. 1994, 94, 1091.
- ^ Маас, Г. Вершина. Curr. Chem. 1987, 137, 75.
- ^ Дойл, М .; Dorow, R .; Buhro, W .; Griffin, J .; Tamblyn, W .; Трюделл, М. Металлоорганические соединения 1984, 3, 44.
- ^ Дойл, М .; Багери, В .; Беспалочковый, Т .; Harn, N.K .; Бринкер, Д. А .; Eagle, C .; Ло, К. Варенье. Chem. Soc. 1990, 112, 1906.
- ^ Пиррунг, М. С .; Zhang, J .; Lackey, K .; Sternbach, D. D .; Браун, Ф. J. Org. Chem. 1995, 60, 2112.
- ^ Peace, B.W .; Вульфман, Д.С. Синтез 1973, 137.
- ^ Дэвис, Х. М. Л .; Clark, T. J .; Черч, Л.А. Tetrahedron Lett. 1989, 30, 5057.
- ^ Davies, H .; Smith, H .; Коркор, О. Tetrahedron Lett. 1987, 28, 1853.
- ^ Дойл, М .; Dorow, R .; Tamblyn, W .; Бухро, В. Tetrahedron Lett. 1982, 23, 2261.
- ^ Венкерт, Э. Ин Новые тенденции в химии натуральных продуктов, исследования в области органической химии; Rahman, A., Quesne, P. W., Eds .; Эльзевир: Амстердам, 1986; Vol. 26. С. 557–563.
- ^ Дэвис, Х. М. Л .; Хьюби, Н. Дж. С. Tetrahedron Lett. 1992, 33, 6935.
- ^ Аратани, Т. Pure Appl. Chem. 1985, 57, 1839.
- ^ Leblanc, Y .; Fitzsimmons, B.J .; Adams, J .; Perez, F .; Рокач, Я. J. Org. Chem. 1986, 51, 789.
- ^ Дания, S. E .; О'Коннор, С. П. J. Org. Chem. 1997, 62, 3390.
- ^ Мазервелл, В. Б.; Робертс, Л. J. Chem. Soc., Chem. Commun. 1992, 1582.
- ^ De Meijere, A .; Schulz, T. J .; Костиков, Р. Р .; Граупнер, Ф .; Murr, T .; Бильфельдт, Т. Синтез 1991, 547.
- ^ Doyle, M. P .; Чжоу, Q.-L .; Чарнсангавей, С .; Лонгория, М. А .; McKervey, M.A .; Гарсия, К.Ф. Tetrahedron Lett. 1996, 37, 4129.
