CMA1 - CMA1
Химаза является фермент что у людей кодируется CMA1 ген.[5]
Этот генный продукт представляет собой химотриптический серин. протеиназа который принадлежит к семейству пептидаз S1. Он экспрессируется в тучных клетках и, как полагают, участвует в деградации внеклеточный матрикс, регулирование подслизистый секреция железы и образование вазоактивных пептиды. В сердце и кровеносных сосудах этот белок, а не ангиотензин превращающий фермент, в значительной степени отвечает за преобразование ангиотензин I к вазоактивному пептиду ангиотензину II. Ангиотензин II участвует в контроле артериального давления и в патогенез из гипертония, сердечная гипертрофия, и сердечная недостаточность. Таким образом, этот генный продукт является мишенью для лечения сердечно-сосудистых заболеваний. Этот ген отображается на 14q11.2 в кластере генов, кодирующих другие протеазы.[6]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000092009 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000022225 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Caughey GH, Schaumberg TH, Zerweck EH, Butterfield JH, Hanson RD, Silverman GA, Ley TJ (май 1993 г.). «Ген химазы тучных клеток человека (CMA1): сопоставление с кластером генов катепсина G / гранзима и экспрессия, ограниченная по клонам». Геномика. 15 (3): 614–20. Дои:10.1006 / geno.1993.1115. PMID 8468056.
- ^ «Ген Entrez: химаза 1 CMA1, тучная клетка».
дальнейшее чтение
- Урата Х, Нисимура Х, Гантен Д. (1996). «Химазозависимые системы образования ангиотензина II у человека». Являюсь. J. Hypertens. 9 (3): 277–84. Дои:10.1016/0895-7061(95)00349-5. PMID 8695029.
- Такай С, Миядзаки М (2003). «Влияние ингибитора химазы на пролиферацию сосудов». Jpn. J. Pharmacol. 90 (3): 223–7. Дои:10.1254 / jjp.90.223. PMID 12499576.
- Урата Х., Киношита А., Перес Д.М. и др. (1991). «Клонирование гена и кДНК химазы сердца человека». J. Biol. Chem. 266 (26): 17173–9. PMID 1894611.
- Дженн Д.Е., Чопп Дж. (1991). «Сердечная химаза, образующая ангиотензин II, представляет собой фермент, специфичный для тучных клеток». Biochem. J. 276 (2): 567–8. Дои:10.1042 / bj2760567. ЧВК 1151130. PMID 2049082.
- Caughey GH, Zerweck EH, Vanderslice P (1991). «Структура, хромосомная принадлежность и выведенная аминокислотная последовательность человеческого гена химазы тучных клеток». J. Biol. Chem. 266 (20): 12956–63. PMID 2071582.
- Urata H, Boehm KD, Philip A, et al. (1993). «Клеточная локализация и региональное распределение химазы, формирующей ангиотензин II, в сердце» (PDF). J. Clin. Вкладывать деньги. 91 (4): 1269–81. Дои:10.1172 / JCI116325. ЧВК 288095. PMID 7682566.
- Сааринен Дж, Калккинен Н., Велгус Х.Г., Кованен П.Т. (1994). «Активация интерстициальной проколлагеназы человека путем прямого расщепления связи Leu83-Thr84 химазой тучных клеток». J. Biol. Chem. 269 (27): 18134–40. PMID 8027075.
- Schechter NM, Wang ZM, Blacher RW и др. (1994). «Определение первичных структур химазы кожи человека и катепсина G из кожных тучных клеток поражений пигментной крапивницы». J. Immunol. 152 (8): 4062–9. PMID 8144971.
- Шехтер Н. М., Джордан Л. М., Джеймс А. М. и др. (1993). «Реакция человеческой химазы с вариантами реактивного сайта альфа-1-антихимотрипсина. Модуляция свойств ингибитора по сравнению с субстратом». J. Biol. Chem. 268 (31): 23626–33. PMID 8226889.
- Сукенага Ю., Кидо Х., Неки А. и др. (1993). «Очистка и молекулярное клонирование химазы миндалин человека». FEBS Lett. 323 (1–2): 119–22. Дои:10.1016/0014-5793(93)81461-8. PMID 8495723.
- Накано А., Киси Ф., Минами К. и др. (1997). «Селективное превращение больших эндотелинов в эндотелины длиной 31 аминокислоту, сокращающие гладкие мышцы трахеи, химазой из тучных клеток человека». J. Immunol. 159 (4): 1987–92. PMID 9257865.
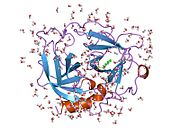
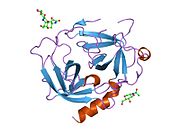
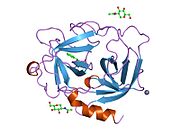
- МакГрат М.Э., Мирзадеган Т., Шмидт Б.Ф. (1998). «Кристаллическая структура человеческой химазы, обработанной фенилметансульфонилфторидом, при 1,9 А». Биохимия. 36 (47): 14318–24. Дои:10.1021 / bi971403n. PMID 9400368.
- Киши Ф., Минами К., Окишима Н. и др. (1998). «Новые эндотелины, состоящие из 31 аминокислоты, вызывают сокращение гладких мышц сосудов». Biochem. Биофиз. Res. Сообщество. 248 (2): 387–90. Дои:10.1006 / bbrc.1998.8980. PMID 9675146.
- Перейра П.Дж., Ван З.М., Рубин Х. и др. (1999). «Кристаллическая структура 2.2A человеческой химазы в комплексе с сукцинил-Ala-Ala-Pro-Phe-хлорметилкетоном: структурное объяснение ее дипептидилкарбоксипептидазной специфичности». J. Mol. Биол. 286 (1): 163–73. Дои:10.1006 / jmbi.1998.2462. PMID 9931257.
- Перейра П.Дж., Ван З.М., Рубин Х. и др. (1999). «2.2 Кристаллическая структура человеческой химазы в комплексе с сукцинил-Ala-Ala-Pro-Phe-хлорметилкетоном: структурное объяснение ее дипептидилкарбоксипептидазной специфичности». Журнал молекулярной биологии. 286 (4): 817. Дои:10.1006 / jmbi.1999.2691. PMID 10208809.
- де Паулис А., Минополи Дж., Даль Пиаз Ф. и др. (1999). «Новые аутокринные и паракринные петли фактора стволовых клеток / химазной сети». Int. Arch. Аллергия Иммунол. 118 (2–4): 422–5. Дои:10.1159/000024153. PMID 10224464.
- Caughey GH, Raymond WW, Wolters PJ (2000). «Генерация ангиотензина II альфа- и бета-химазами тучных клеток». Биохим. Биофиз. Acta. 1480 (1–2): 245–57. Дои:10.1016 / S0167-4838 (00) 00076-5. PMID 10899625.
- Меллон МБ, Фрэнк Б.Т., Фанг К.С. (2002). «Альфа-химаза тучных клеток снижает распознавание IgE профилина пыльцы березы путем расщепления антител-связывающих эпитопов». J. Immunol. 168 (1): 290–7. Дои:10.4049 / jimmunol.168.1.290. PMID 11751973.
внешняя ссылка
- Человек CMA1 расположение генома и CMA1 страница сведений о гене в Браузер генома UCSC.
| Эта статья о ген на хромосома человека 14 это заглушка. Вы можете помочь Википедии расширяя это. |