Расширение кольца Бюхнера - Buchner ring expansion
| Расширение кольца Бюхнера | |
|---|---|
| Названный в честь | Эдуард Бюхнер |
| Тип реакции | Реакция перестановки |
В Расширение кольца Бюхнера это двухступенчатый органический Реакция образования связи C-C используется для доступа к 7-членному кольца. Первый шаг предполагает формирование карбен из этилдиазоацетат, который циклопропанаты ан ароматный звенеть. В расширение кольца происходит на втором шаге, с электроциклическая реакция открытие циклопропан кольцо с образованием 7-членного кольца.

История
Реакция расширения кольца Бюхнера была впервые использована в 1885 г. Э. Бюхнер и Т. Куртиус [1][2] кто приготовил карбен из этилдиазоацетат для дополнения к бензол с использованием как термического, так и фотохимический пути в синтезе циклогептатриен производные. Полученный продукт представлял собой смесь четырех изомерных карбоновые кислоты. Вариации реакции возникают из-за способов получения карбена. Достижения в области металлоорганической химии привели к повышению селективности производных циклогептатриена. В 1980-х годах было обнаружено, что диродиевые катализаторы обеспечивают получение единичных изомеров циклопропана с высокими выходами.[3] Применения находят в медицине (синтез лекарств)[4][5][6][7][8] и материаловедение (производные фуллерена).[9][10][11]
Подготовка
Получение этилдиазоацетата:
Первый синтез производных циклогептатриена Бюхнером в 1885 г. фотолиз и термические условия для образования карбена. Методика приготовления опасного исходного материала, необходимого для образования карбена в реакции Бюхнера, этилдиазоацетата, доступна в Органический синтез.[12] В предоставленную процедуру Сирл включает предостережения из-за очень взрывоопасной природы эфиров диазоуксусной кислоты.
Приготовление карбеноида металла:
Синтез карбена в 1960-х годах был сосредоточен на использовании медь катализаторы для стереоселективный пропанация.[13] В 1980-х годах диродиевые катализаторы использовались для получения карбеноида для циклопропанирования. Появление металлохимия улучшила селективность соотношений продуктов производных циклогексатриена за счет выбора лиганда на карбеноидном катализаторе.[14]
Механизм
Шаг 1:
В механизм реакции Расширение кольца Бюхнера начинается с образования карбена из этилдиазоацетата, первоначально образующегося в результате фотохимических или термических реакций с экструзией азота.

Образовавшийся карбен присоединяется к одной из двойных связей бензола с образованием циклопропанового кольца.

Появление реагентов, катализируемых переходными металлами, обеспечивает альтернативные стереоспецифические методы циклопропанирования. Выбор металлов включает Cu, Rh и Ru с различными лигандами.[13] Использование родиевых катализаторов в реакции Бюхнера для образования карбена снижает количество продуктов за счет получения в основном кинетических циклогептатриениловых эфиров.[14] Смеси продуктов реакции Бюхнера, полученные на термических катализаторах родия II, менее сложны. Wyatt et al. изучили региоселективность термической реакции Бюхнера с использованием Rh2(O2CCF3)4 и продемонстрировал, что электрофильный характер карбена родия предпочитает реакцию при более нуклеофильный π-связи ароматического кольца.[15]

Принятый карбен каталитический цикл[16] был предложен Йетсом[17] в 1952 году. Первоначально диазосоединение окислительно присоединяется к комплексу металлического лиганда. После экструзии азота образуется карбен металла, который вступает в реакцию с богатым электронами ароматическим веществом, восстанавливая металлический катализатор, завершая каталитический цикл.

Шаг 2:
Второй этап реакции Бюхнера включает перициклический согласованное расширение кольца. На основе Правила Вудворда – Хоффмана, электроциклическое открытие Norcaradiene производные - это 6-электронная отвратительный (π 4s + σ 2s), термически разрешенный процесс.

Норкарадиен-циклогептатриен равновесие был широко изучен.[18] Положение равновесия зависит от стерический, электронные и конформационный последствия. Из-за конформационного напряжения в циклопропановом кольце норкарадиена равновесие находится на стороне циклогептатриена. Равновесие может быть смещено в сторону норкарадиена за счет дестабилизации циклогептатриена путем объемного замещения (большие стерически затрудненные группы, т.е. т-бутил) при С1 и С6.

Равновесие можно изменить, варьируя замена в C7. Группы доноров электронов (EDG) предпочитают норкарадиен, в то время как электроноакцепторные группы (EWG) отдают предпочтение циклогептатриену.

В таутомерия норкарадиена и циклогептатриена можно понять на основе Уолш циклопропановые молекулярные орбитали норкарадиенового циклопропанового кольца. Электронная рационализация для стабилизации орбиталей Уолша[18] возможно как для электроноакцепторных, так и для электронодонорных групп на углероде C7. Молекулярные орбитали электроноакцепторных групп в C7 перекрываются с HOMO-орбиталями Уолша циклопропанового кольца, вызывая укорочение связи C1-C6. В случае электронодонорных групп теперь снова возможно перекрытие орбиталей в НСМО, что приводит к увеличению разрушение характер, дестабилизирующий таутомер норкарадиена. Положение равновесия можно регулировать в зависимости от карбеновых заместителей.

Приложения
Лекарство:
Важность расширения кольца Бюхнера аннулирование химия очевидна в применении этой синтетической последовательности в синтезе биологических соединений.
При изучении аналогичной реакции присоединения карбена к тиофен, Стивен Матлин и Лам Чан применили метод расширения кольца Бюхнера в 1981 году для получения спиро производные пенициллина.[7]

В 1998 году Mander et al. синтезировал дитерпеноидный тропон, Харрингтонолид[6] с использованием химии аннелирования внутримолекулярного расширения кольца Бюхнера. Родиевый катализатор (Rh2(манделат)4) и DBU (1,8-диазабицикло [5.4.0] ундец-7-ен) были использованы для получения карбена. Было обнаружено, что этот натуральный продукт обладает противоопухолевыми и противовирусными свойствами.

Danheiser et al. использованный внутримолекулярный образование карбеноидов для производства замещенных азулены через расширение кольца типа Бюхнера. Противоязвенный препарат Эгуален (КТ1-32)[4][5] был синтезирован с использованием этой стратегии расширения-аннелирования кольца с родиевым катализатором (Rh2(OCOt-Bu)4) в эфире.

Материаловедение:
Метод расширения кольца Бюхнера был использован для синтеза исходных материалов для приложений в материаловедении с участием фотоэлектрический клетки. Разработка донорно-акцепторного (D-A) интерфейса, состоящего из проводящий полимер доноры и бакминстерфуллерен производные акцепторы создают композицию с разделением фаз, которая усиливает фотопроводимость (доступно только с полимерными донорами) в процессе фотоиндуцированного переноса заряда фотоэлектрических элементов.[19] В фуллерен соединения могут быть функционализированы для смешиваемости C60 повысить эффективность солнечная батарея в зависимости от полимерного тонкая пленка синтезированы.[11]
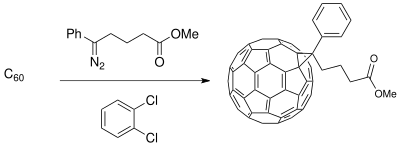
Ограничения
К недостаткам реакции относятся побочные реакции карбенового фрагмента. Необходимо учитывать выбор растворителя для реакции. В дополнение к потенциалу углерод-водородной связи реакции вставки, введение углерод-галогенкарбена возможно при дихлорметан используется как растворитель.[20]

Контроль за региоселективность во время добавления карбена необходимо избегать побочных продуктов, образующихся сопряженный изомеры циклогептатриена. Ноэлс и др. использовали катализаторы Rh (II) для образования карбена в мягких условиях реакции (комнатная температура) для региоселективного получения кинетического неконъюгированного изомера циклогептатриена.[3][8][21]

Смотрите также
Рекомендации
- ^ Buchner, E .; Курций, Т. (1885), "Ueber die Einwirkung von Diazoessigather auf aromatisch Kohlenwasserstoffe", Бер. Dtsch. Chem. Ges., 18 (2): 2377–2379, Дои:10.1002 / cber.188501802119
- ^ Buchner, E .; Курций, Т. (1885), «Синтез бета-кетоэфиров из альдегидов и диазоуксусной кислоты»., Бер. Dtsch. Chem. Ges., 18 (2): 2371–2377, Дои:10.1002 / cber.188501802118
- ^ а б Hubert, A.J .; Ноэлс, А. Ф .; Anciaux, A.J .; Warin, R .; Тейсси, П. (1981), "Реакции диазосоединений, катализируемые переходными металлами. 2." Дополнение к ароматическим молекулам: катализ Бюхнеровского синтеза циклогептатриенов » (PDF), J. Org. Chem., 46 (5): 873–876, Дои:10.1021 / jo00318a010
- ^ а б Данхайзер, Р. Л.; J. L. Kane, J .; Shea, K. M .; Кромби, А. Л. (2001), "Стратегия расширения цикла-аннулирования для синтеза замещенных азуленов. Получение и реакции связывания Сузуки 1-азуленилтрифлатов", Орг. Lett., 3 (7): 1081–1084, Дои:10.1021 / ol0156897, PMID 11277800
- ^ а б Danheiser, R. L .; Crombie, A. L .; Kane, J.L.J .; Ши, К. М. (2004), «Стратегия расширения цикла-аннулирования для синтеза замещенных азуленов и олигоазуленов. 2. Синтез азуленилгалогенидов, сульфонатов и соединений азуленилметаллов и их применение в реакциях связывания, опосредованных переходными металлами», J. Org. Chem., 69 (25): 8652–8667, Дои:10.1021 / jo048698c, PMID 15575741
- ^ а б Mander, L.N .; Frey, B .; Wells, A. P .; Роджерс, Д. Х. (1998), "Синтез необычных дитерпеноидных тропонов, хайнанолидола и Харрингтонолида", Варенье. Chem. Soc., 120 (8): 1914–1915, Дои:10.1021 / ja9738081
- ^ а б Matlin, S.A .; Чан, Л. (1981), "Новые спиропроизводные пенициллина", Буквы Тетраэдра, 22 (40): 4025–4028, Дои:10.1016 / S0040-4039 (01) 82055-4
- ^ а б Reisman, S.E .; Nani, R. R .; Левин, С. (2011), "Buchner and Beyond: Циклопропанирование арена применительно к общему синтезу природных продуктов" (PDF), Synlett, 7 (17): 2437–2442, Дои:10.1055 / с-0031-1289520
- ^ Прато, М. (1997), «[60] Химия фуллеренов для материаловедения», J. Mater. Chem., 7 (7): 1097–1109, Дои:10.1039 / A700080D
- ^ Wudl, F .; Gonzalez, R .; Хаммелен, Дж. К. (1995), "Специальная кислотно-катализируемая и фотохимическая изомеризация надежного фуллероида в метанофуллерен", J. Org. Chem., 60 (8): 2618–2620, Дои:10.1021 / jo00113a049
- ^ а б Wudl, F .; Hummelen, J.C .; Knight, B.W .; LePeq, F. (1995), "Получение и характеристика фуллероидов и производных метанофуллерена", J. Org. Chem., 60 (3): 532–538, Дои:10.1021 / jo00108a012
- ^ Серл, Н. Э. (1956), «Этилдиазоацетат», Органический синтез, 36: 25, Дои:10.15227 / orgsyn.036.0025
- ^ а б Lebel, H .; Marcoux, J .; Molinaro, C .; Шаретт А. (2003), "Реакции стереоселективного циклопропанирования", Chem. Ред., 103 (4): 977–1050, Дои:10.1021 / cr010007e, PMID 12683775
- ^ а б McKervey, A .; Йе, Т. (1994), "Органический синтез с альфа-диазокарбонильными соединениями", Chem. Ред., 94 (4): 1091–1160, Дои:10.1021 / cr00028a010
- ^ Wyatt, E.E .; Галлоуэй В. Р. Дж. И Спринг, Д. Р. (2011), «Региоселективность в термических реакциях типа Бюхнера, катализируемых родием (II), замещенных арилгалогенидов: исследования в направлении синтеза галогенид-замещенных циклогептатриенов», Synlett, 2011 (10): 1449–1453, Дои:10.1055 / с-0030-1260562
- ^ Пиррунг, М. С .; Liu, H .; Morehead, J .; Эндрю Т. (2002), "Хемзимы родия: Кинетика Михаэлиса-Ментена в карбеноидных реакциях, катализируемых карбоксилатом диродия (II)", Варенье. Chem. Soc., 124 (6): 1014–1023, Дои:10.1021 / ja011599l, PMID 11829610
- ^ Йейтс, П. (1952), "Катализируемое медью разложение диазокетонов", Варенье. Chem. Soc., 74 (21): 5376–5381, Дои:10.1021 / ja01141a047
- ^ а б Maguire, A. R .; Макнамара, О. А. (2011), "Норкарадиен-циклогептатриеновое равновесие", Тетраэдр, 67: 9–40, Дои:10.1016 / j.tet.2010.10.030
- ^ Ю., Г .; Gao, J .; Hummelen, J.C .; Wudl, F .; Хигер, А. Дж. (1995), "Полимерные фотоэлектрические элементы: повышенная эффективность за счет сети внутренних гетеропереходов донор-акцептор", Наука, 270 (5243): 1789–1791, Bibcode:1995Научный ... 270.1789Y, CiteSeerX 10.1.1.320.7494, Дои:10.1126 / science.270.5243.1789, S2CID 135489167, ProQuest 213566279
- ^ Lovely, C.J .; Browning, R.G .; Бадаринарай, В .; Расика Диас, Х. В. (2005), "Катализируемая серебром реакция Бюхнера", Буквы Тетраэдра, 46 (14): 2453–2455, Дои:10.1016 / j.tetlet.2005.02.052
- ^ Деринг, W. v. E .; Laber, G .; Vonderwahl, R .; Чемберлен, Н. Ф .; Уильямс, Р. Б. (1956), "Структура кислот Бюхнера", Варенье. Chem. Soc., 78 (20): 5448, Дои:10.1021 / ja01601a080
